膠質(zhì)細(xì)胞源性神經(jīng)營養(yǎng)因子對帕金森病大鼠多巴胺能神經(jīng)元的修復(fù)作用
許加軍,楊洪安,王國棟
(山東大學(xué)附屬省立醫(yī)院,濟(jì)南250021)
膠質(zhì)細(xì)胞源性神經(jīng)營養(yǎng)因子(GDNF)有保護(hù)多巴胺能神經(jīng)元和修復(fù)其損傷的作用[1~3],保護(hù)作用通常發(fā)生在損傷即刻,持續(xù)數(shù)小時,而修復(fù)作用通常在傷后數(shù)天至數(shù)周才表現(xiàn)出來,并持續(xù)較長時間。如在神經(jīng)元損傷后數(shù)小時內(nèi)或損傷前預(yù)防給藥,以保護(hù)作用為主;如給藥覆蓋帕金森病整個病程,則以修復(fù)作用為主。2013年10~12月,我們向帕金森病模型大鼠腦室或殼核內(nèi)直接注射GDNF,觀察其對大鼠黑質(zhì)紋狀體系統(tǒng)多巴胺能神經(jīng)元的修復(fù)作用。現(xiàn)報告如下。
1 材料與方法
1.1 動物模型的制備 健康雄性SD70大鼠,由北京維通利華實驗動物技術(shù)有限公司提供。常規(guī)飼養(yǎng),自由進(jìn)食水。2%戊巴比妥鈉(40 mg/kg)腹腔注射麻醉,固定于立體定向儀。以前囟為標(biāo)準(zhǔn)參考點,參照大鼠腦立體定位圖譜,于右側(cè)前腦內(nèi)側(cè)束(MFB,A/P:- 3.6 mm;L:+2.0 mm;V:- 9.0 mm)及腹側(cè)被蓋區(qū)(VTA,A/P:-6.0 mm;L:+0.5 mm;V:-8.0 mm)分別立體定向注入12 μg 6-OHDA(3 μg/μL),注射速度為 1 μL/min,經(jīng) 2周的跟蹤監(jiān)測,獲得39只穩(wěn)定對側(cè)旋轉(zhuǎn)的帕金森病模型[4]。腹腔麻醉下應(yīng)用立體定向技術(shù)分別在20只大鼠右側(cè)腦室近紋狀體側(cè)和19只大鼠雙側(cè)殼核中央部放置微型導(dǎo)管(外徑0.5 mm)。導(dǎo)管通過一段軟管接于埋于側(cè)腹部皮下的緩釋泵[5]。無論是單側(cè)腦室置管還是雙側(cè)殼核置管,GDNF均能作用于雙側(cè)腦區(qū)。
1.2 GDNF給藥方法 術(shù)后1周內(nèi)所有造模成功大鼠每日通過導(dǎo)管輸注賦形劑(10 mmol/L枸櫞酸鹽、150 mmmol/L NaCl緩沖液)。術(shù)后2~3周,15只大鼠(觀察A組)腦室內(nèi)注射人重組GDNF,7.5 μg/d;14只(觀察B組)殼核內(nèi)注射人重組GDNF,7.5 μg/d;5只(對照 A 組)腦室內(nèi)注射賦形劑,5只(對照B組)殼核內(nèi)注射賦形劑至實驗結(jié)束。
1.3 黑質(zhì)酪氨酸羥化酶陽性(TH+)多巴胺能神經(jīng)元大小、數(shù)量及紋狀體TH+神經(jīng)纖維密度測算 所有動物麻醉后,心內(nèi)注射肝素化冰生理鹽水,然后取其腦組織置于冰腦模上行冠狀切片,層厚為1 mm。在包含尾狀核、殼核、伏隔核的層面行雙側(cè)腦組織打孔取標(biāo)本。將該層面每側(cè)紋狀體按照距離腦室遠(yuǎn)近分為內(nèi)側(cè)部、中間部和外側(cè)部三個區(qū)域分別進(jìn)行標(biāo)本采集。
4℃下,把紋狀體冠狀切片標(biāo)本以及整個中腦組織均放在4%的甲醛中固定,然后用滑動切片機切片,取包含黑質(zhì)、紋狀體層面行TH免疫組化染色,光鏡下觀察。操作按試劑盒說明書進(jìn)行。采用光學(xué)分餾方法對中腦組織多巴胺能神經(jīng)元進(jìn)行無偏立體細(xì)胞計數(shù),獲得TH+神經(jīng)元數(shù)目以及大小(被蓋腹側(cè)區(qū)域不計入興趣區(qū)域)。計數(shù)雙側(cè)紋狀體TH+神經(jīng)纖維密度,以側(cè)腦室作為參考點,用1.2 mm×1.2 mm柵格從背到腹計數(shù)。
1.4 統(tǒng)計學(xué)方法 采用SPSS19.0統(tǒng)計軟件。數(shù)據(jù)用±s表示。組間比較采用t檢驗和方差分析。P<0.05為差異有統(tǒng)計學(xué)意義。
2 結(jié)果
各組大鼠中腦組織黑質(zhì)TH+多巴胺能神經(jīng)元大小和數(shù)目見表1,紋狀體內(nèi)側(cè)部TH+神經(jīng)纖維密度見表2。由表1、表2可見,對照A、B組大鼠右側(cè)中腦組織黑質(zhì)TH+多巴胺能神經(jīng)元大小和數(shù)目及紋狀體內(nèi)側(cè)部TH+神經(jīng)纖維密度均較左側(cè)降低,P均<0.05。觀察A組與對照A組相比、觀察B組與對照B組相比,雙側(cè)中腦組織黑質(zhì)TH+多巴胺能神經(jīng)元大小和數(shù)目及紋狀體內(nèi)側(cè)部TH+神經(jīng)纖維密度均明顯升高,P均<0.05。
表1 各組大鼠中腦組織黑質(zhì)TH+多巴胺能神經(jīng)元大小和數(shù)目比較(±s)
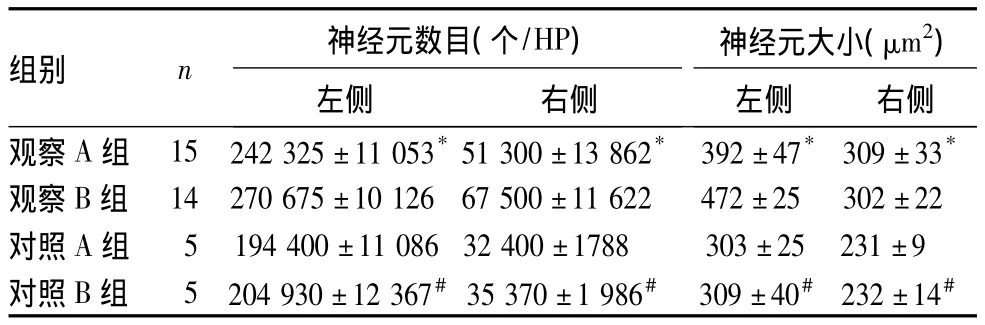
表1 各組大鼠中腦組織黑質(zhì)TH+多巴胺能神經(jīng)元大小和數(shù)目比較(±s)
注:與對照 A組相比,*P <0.05;與對照 B 組相比,#P <0.05
組別 n 神經(jīng)元數(shù)目(個/HP)左側(cè) 右側(cè)神經(jīng)元大小(μm2)左側(cè) 右側(cè)觀察A組 15 242 325±11 053*51 300±13 862* 392±47* 309±33*觀察B組 14 270 675±10 126 67 500±11 622 472±25 302±22對照A組 5 194 400±11 086 32 400±1788 303±25 231±9對照B組 5 204 930±12 367#35 370±1 986# 309±40# 232±14#
表2 各組大鼠紋狀體內(nèi)側(cè)部TH+神經(jīng)纖維密度比較(±s)
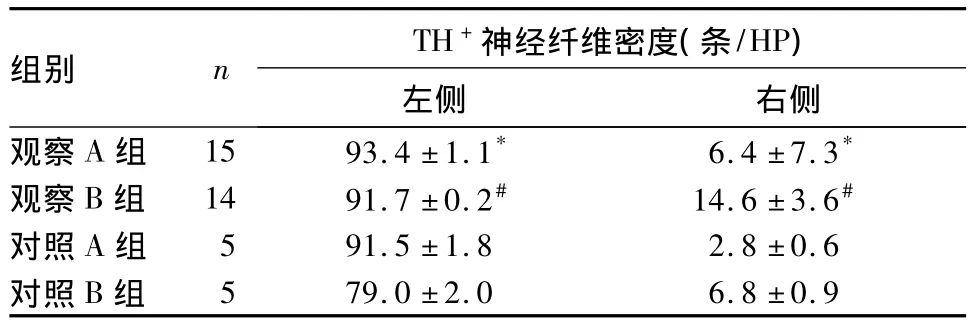
表2 各組大鼠紋狀體內(nèi)側(cè)部TH+神經(jīng)纖維密度比較(±s)
注:與對照 A 組相比,*P <0.05;與對照 B 組相比,#P <0.05
組別 n TH+神經(jīng)纖維密度(條/HP)左側(cè) 右側(cè)觀察 A 組 15 93.4 ±1.1* 6.4 ±7.3*觀察 B 組 14 91.7 ±0.2# 14.6 ±3.6#對照 A 組 5 91.5 ±1.8 2.8 ±0.6對照B組5 79.0 ±2.0 6.8 ±0.9
3 討論
本研究結(jié)果顯示向帕金森大鼠腦室或紋狀體內(nèi)輸注GNDF對黑質(zhì)紋狀體系統(tǒng)多巴胺能神經(jīng)元具有顯著性修復(fù)作用,可增加腦組織黑質(zhì)TH+多巴胺能神經(jīng)元大小和數(shù)目及紋狀體內(nèi)側(cè)部TH+神經(jīng)纖維密度,改善黑質(zhì)紋狀體系統(tǒng)功能。金美芳等[1]采用慢病毒作載體,使GDNF基因在PD模型黑質(zhì)紋狀體部位持續(xù)表達(dá),結(jié)果與本研究大體相同,但其轉(zhuǎn)染GDNF基因是實驗損毀1周后進(jìn)行,主要強調(diào)GDNF對黑質(zhì)紋狀體的保護(hù)功能。另外在其研究中,腦內(nèi)GDNF給藥劑量無法控制,不能長期監(jiān)測。本研究中GDNF給藥始于損毀后2周,避開了GDNF保護(hù)作用有效期[6],明確觀察GDNF對多巴胺能神經(jīng)元顯著修復(fù)作用。
本研究結(jié)果顯示殼核或者腦室內(nèi)注射均可以收到良好的神經(jīng)元修復(fù)效果,這與既往研究[7]結(jié)論一致。GDNF對殘存多巴胺神經(jīng)纖維具有顯著修復(fù)作用,這與文獻(xiàn)[8]結(jié)論一致。對照組近腦室側(cè)紋狀體TH+神經(jīng)纖維密度最高,說明殘存纖維主要集中在近腦室紋狀體,而在實驗組,纖維再生和修復(fù)最明顯也發(fā)生在近腦室紋狀體,說明GDNF神經(jīng)修復(fù)作用主要作用對象為損毀后殘存神經(jīng)纖維,這正是GDNF能夠上調(diào)黑質(zhì)紋狀體系統(tǒng)多巴胺能神經(jīng)元活性主要機制。
本研究結(jié)果顯示,腦室內(nèi)或殼核內(nèi)輸注GDNF不但能修復(fù)損毀側(cè)黑質(zhì)神經(jīng)元,還能顯著增加健側(cè)黑質(zhì)神經(jīng)元數(shù)目,這與文獻(xiàn)[9]結(jié)果相同。故認(rèn)為腦室內(nèi)或殼核內(nèi)注射GDNF可以通過擴(kuò)散逆向運輸在黑質(zhì)等鄰近腦區(qū)廣泛分布[10]。目前有證據(jù)表明帕金森動物模型中黑質(zhì)神經(jīng)元調(diào)亡前會出現(xiàn)多巴胺表型丟失,從而造成這些神經(jīng)元活性喪失[11](即這些細(xì)胞并不表達(dá)TH),這可以作為GDNF發(fā)揮作用的靶細(xì)胞。目前有證據(jù)表明在成年動物新皮層、紋狀體和黑質(zhì)等部分腦區(qū)均存在神經(jīng)再生[12]。所以GDNF也可能通過促進(jìn)神經(jīng)再生途徑對黑質(zhì)紋狀體細(xì)胞進(jìn)行修復(fù)。
[1]金美芳,李潔.PD模型中GDNF與星形膠質(zhì)瘤對黑質(zhì)DA能神經(jīng)元的影響[J].中國實用神經(jīng)疾病雜志,2008,11(6):8-10.
[2]Xiao CH,Wang YQ,Liu HW,et al.Intrastriatal glial cell line-derived neurotrophic factors for protecting dopaminergic neurons in the substantia nigra of mice with Parkinson disease[J].Neu Reg Res,2007,2(4):207-210.
[3]Burke RE.GDNF as a candidate striatal target-derived neurotrophic factor for the development of substantia nigra dopamine neurons[J].J Neural Transm Suppl,2006,(70):41-45.
[4]鄧興力,雷德強,劉如恩,等.帕金森病大鼠模型的建立[J].廣東醫(yī)學(xué),2012,33(3):313-315.
[5]Inoue K.The mechanism and control of neuropathic pain[J].Rinsho Shinkeigaku,2009,49(11):779-782.
[6]Dietz GP,Valbuena PC,Dietz B,et al.Application of a bloodbrain-barrier-penetrating form of GDNF in a mouse model for Parkinsin's disease[J].Brain Res,2006,1082(1):61-66.
[7]Kirik D,Rosenblad C,Bjorklund A,et al.Long-term rAAV mediated gene transfer of GDNF in the rat Parkinson's model:intrastriatal but not intranigral transduction promotes functional regeneration in the lesioned nigrostriatal system[J].J Neurosci,2000,20(3):4686-4700.
[8]Zhang Y,Zhu W,Wang YG,et al.Interaction of SH2-Bbeta with RET is involved in signaling of GDNF-induced neurite outgrowth[J].J Cell Sci,2006,119(8):1666-1676.
[9]劉洪梅,余景考,丁艷霞,等.GDNF激活星形膠質(zhì)細(xì)胞保護(hù)PD模型大鼠黑質(zhì)多巴胺能神經(jīng)元[J].神經(jīng)解剖學(xué)雜志,2006,22(4):367-372.
[10]Buytaert-Hoefen KA,Alvarez E,F(xiàn)reed CR.Generation of tyrosine hydroxylase positive neurons from human embryonic stem cells after coculture with cellular substrates and exposure to GDNF[J].Stem Cells,2004,22(5):669-674.
[11]Fornai F,Schluter OM,Lenzi P,et al.Parkinson-like syndrome induced by continuous MPTP infusion:convergent roles of the ubiquitin-proteasome system and alpha-synuclein[J].Proc Natl Acad Sci USA,2005,102(9):3413-3418.
[12]Gould E,Gross CG.Neurogenesis in adult mammals:some progress and problems[J].J Neurosci,2002,22(3):619-623.

