缺血后處理抑制TLR2信號通路對大鼠缺血再灌注腦損傷的保護作用
王伯玉 陸 斌 羅毅男 葛鵬飛 周 暢
(吉林大學第一醫院神經外科,吉林 長春 130021)
缺血后再灌注造成的腦損傷已經成為影響閉塞血管-血管再生預后的重要因素〔1〕。動物實驗發現,局灶性缺血和再灌注造成腦損傷的病理因素很多,如氧化應激、內質網應激和蛋白質聚集〔2,3〕。然而,越來越多的證據表明,炎癥反應是決定腦缺血后果的關鍵因素,抑制神經炎癥因子已經成為保護腦損傷的治療靶點。
1 材料與方法
1.1動物 成年雄性大鼠(n=45; 體重280~300 g; 7~8周齡,由吉林大學實驗動物中心提供,飼養溫度控制在22℃~25℃,12 h的光/暗周期處理,自由進食進水。所有動物操作獲得吉林大學動物實驗倫理委員會的批準。根據實驗室動物護理和使用指導原則,盡可能減少在本研究中動物所遭受的痛苦和用于實驗的動物數量〔4〕。
1.2缺血后處理方案 將大鼠隨機分成假手術組、局灶性缺血組和缺血后處理組(每組15只)。局灶性缺血組和缺血后處理組的大鼠按照描述進行2 h的局灶性腦缺血處理,局灶性缺血組大鼠不進行進一步的再灌注中斷處理。缺血后處理組大鼠接受2 h的局灶性缺血處理后,進行3次30 s/30 s的再灌注/再阻塞處理。假手術組大鼠接受除大腦中動脈閉塞外的其他相同操作。
1.3梗死體積測量 再灌注24 h后,由操作人員(研究外人員)在每組中隨機選出5只大鼠,用過量的戊巴比妥注射處死大鼠,快速剝離大腦。梗死體積的測量需借助TTC染色 (TTC; Sigma-Aldrich, St. Louis, MO, USA)。將大腦切成2 mm厚的冠狀切片,4%多聚甲醛過夜浸泡,用1%TTC溶液37℃染色30 min。用動物全腦組織測量大腦梗死的比例〔5〕。
1.4神經系統評估 大腦中動脈閉塞24 h后,按照下列評分系統對所有小組進行神經系統評估,分為0 分(沒有明顯病態)、1分(尾巴止停時側前肢彎曲)、2分(牽拉尾巴時側前肢抓地力降低)、3分(多方向自發活動;只有在牽拉尾巴時發生側向盤旋)、4分(自發側向盤旋)、5分(麻醉復蘇后死亡) 。每組5只大鼠。
1.5檢測指標 局灶性缺血處理24 h后,剝離大腦,RT-PCR 測定TNF-α和IL-1β mRNA 表達量。用特異性酶聯免疫吸附試驗(ELISA)試劑盒(Thermo Scientific Company, Rockford, IL, USA)測量IL-1β和TNF-α蛋白濃度。所有標準品和樣本均重復4次,每次3個重復。
1.6蛋白質免疫印跡 將缺血半影區皮質組織均勻分布到冰冷的緩沖液中,勻漿離心(10 000r/min,20 min,4℃),并測量上清液中的蛋白質濃度。
用12% SDS-PAGE 進行蛋白質免疫印跡分析。每個實驗組有四個樣本(來自不同大鼠)用于統計學分析。電泳后,將蛋白質轉移到PVDF膜上。膜上有抗-TLR2 (1∶1 000,Abcam, Cambridge, MA, USA)的探針。室溫下,將膜用抗兔二抗(1∶50 000)孵育1 h。ECL檢測顯影,用Kodak 1D凝膠分析軟件對蛋白質條帶的光密度進行定量。假手術組的光密度值作為基線參考值,每個實驗組與假手術組的比值作為變化值。
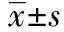
2 結 果
大腦中動脈閉塞所造成的腦缺血成功誘導局灶性缺血組和缺血后處理組中所有大鼠的梗死。與局灶性缺血組相比,缺血后處理組的梗死體積和神經系統評分均顯著降低(P<0.01)。RT-PCR結果顯示:與假手術組相比,局灶性缺血組神經炎癥因子TNF-α和IL-1β的轉錄水平均顯著升高(P<0.01)。然而,缺血后處理可以顯著消除這種效應(P<0.01)。ELISA結果顯示:與假手術組相比,局灶性缺血組神經炎癥因子TNF-α和IL-1β的表達水平也均顯著升高(P<0.01)。缺血后處理會抑制由缺血/再灌注造成的TNF-α和IL-1β表達增加(P< 0.01)。 蛋白質免疫印跡結果顯示:缺血后處理會顯著限制TLR2(促神經炎癥細胞因子TNF-α和IL-1β的上游調控因子)的表達。
3 討 論
目前的研究表明,3次30 s的再灌注/再阻塞是一種有效的缺血后處理方法,它會降低腦梗死體積并改善神經系統功能。此外,缺血后處理會抑制由局灶性缺血/再灌注造成促炎癥細胞因子TNF-α和IL-1β轉錄和表達水平提高。同時,缺血后處理也會降低TLR2的表達水平。
腦損傷是造成缺血/再灌注后神經系統障礙的主要因素之一〔6〕。另一方面,減少腦梗死對局灶性缺血/再灌注處理大鼠的神經系統功能有益。這些報道表明,對受傷腦組織的保護有助于改善神經系統功能。盡管已經提出了氧化應激和鈣離子超載這些理論來解釋缺血/再灌注后的腦損傷,但是目前認為炎癥反應是造成腦損傷的關鍵因素之一〔7〕。在這項研究中發現,缺血后處理可以改善經局灶性缺血/再灌注處理過大鼠的神經機能障礙,并會降低腦梗死的體積。這表明缺血后處理所造成神經系統功能的改善與損傷腦組織的減少有關。
盡管沒有直接的研究表明細胞因子 IL-1β和TNF-α是TLR2的調控靶點,但是先前研究表明TLR2也參與由大腦缺血/再灌注所造成的炎癥反應。在本研究中,缺血后處理會降低損傷腦組織中的TLR2水平,這可能有助于缺血后處理對腦損傷的保護作用。
總之,缺血后處理會顯著降低由局灶性缺血/再灌注造成的腦梗死體積并改善其神經機能障礙。缺血后處理的保護作用與TLR2, TNF-α和IL-1β的抑制顯著相關。同時,抗炎癥作用可以作為預防由缺血/再灌注所造成腦損傷的新研究靶點。
4 參考文獻
1Tjoumakaris SI, Jabbour PM, Rosenwasser RH.Neuroendovascular management of acute ischaemic stroke〔J〕. Neurosurg Clin N Am, 2009; 20:419- 29.
2Buch P, Patel V, Ranpariya V,etal. Neuroprotective activity of Cymbopogon martinii against cerebral ischemia/reperfusion-induced oxidative stress in rats〔J〕. J Ethnopharmacol, 2012;142:35-40.
3Osada N, Kosuge Y, Ishige K,etal. Characterization of neuronal and astroglial responses to ER stress in the hippocampal CA1 area in mice following transient forebrain ischemia〔J〕.Neurochem Int, 2010;57:1-7.
4National research council(US) committee for the update of the guide for care and use of laboratory animals.Guide for the care and use of laboratory animals〔M〕. 8th edn. Washington (DC): National Academies Press (USA), 2011:32-5.
5Li ZY, Liu B, Yu J,etal. Ischaemic postconditioning rescues brain injury caused by focal ischaemia/reperfusion via attenuation of protein oxidization〔J〕. J Int Med Res, 2012;40:954-66.
6Guo RB, Wang GF, Zhao AP,etal. Paeoniflorin protects against ischemia-induced brain damages in rats via inhibiting MAPKs/NF-κB-mediated inflammatory responses〔J〕. PLoS One, 2012;7:e49701.
7Wang Y, Ge P, Zhu Y. TLR2 and TLR4 in the brain injury caused by cerebral ischemia and reperfusion〔J〕. Mediators Inflamm 2013;2013:124614. doi: 10.1155/2013/124614.

