益賽普聯合甲氨蝶呤治療類風濕關節炎的作用機制
張 磊
(東營市勝利油田中心醫院風濕免疫科,山東 東營 257034)
類風濕關節炎(RA)屬于臨床常見疾病,表現為關節滑膜炎,屬于系統性自身免疫性疾病,可引起進行性、持續性的滑膜炎癥,導致骨關節的畸形。臨床治療提倡盡早采用慢性抗風濕藥物聯合治療〔1〕。 益賽普為一種腫瘤壞死因子(TNF)受體-抗體融合蛋白,治療RA具有顯著的效果〔2〕。甲氨蝶呤為臨床上治療RA最常見的藥物之一,取得了良好的治療效果。有學者報道,益賽普聯合甲氨蝶呤治療RA具有起效快、療效明顯、副作用少的特點〔3〕,但其作用機制少見報道。本研究通過探討益賽普聯合甲氨蝶呤治療RA前后血清白細胞介素(IL)-1、環氧合酶(COX)-2、TNF-α、IL-4和IL-10水平變化,探討其作用機制。
1 材料與方法
1.1研究對象 選取2012~2013年來我院風濕科門診就診的RA患者46例,其中男17例,女29例,年齡25~60歲,診斷滿足美國風濕病學會于1987年修正的RA診斷標準〔4〕。排除對藥物具有過敏體質的患者;精神異常者;內臟器官有嚴重疾病的患者;無消化道潰瘍、血液系統、內分泌系統的病變。另抽取30例到我院進行獻血的健康人群作為正常組。所有研究對象均簽署我院知情同意書。
1.2治療方法 治療組RA患者口服甲氨蝶呤10 mg/次,1次/w,同時皮下注射益賽普,25 mg/次,2次/w,連續治療12 w。
1.3指標觀察 采用酶聯免疫吸附法(ELISA)檢測治療前后RA患者血清中的IL-1β、COX-2、TNF-α、IL-4和IL-10的變化,實驗步驟依照試劑盒說明書進行。正常組按照上述步驟進行檢測。
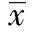
2 結 果
與正常組相比,RA患者治療前血清中的IL-1β、COX-2和TNF-α的水平顯著上升(6.36±0.86 vs 11.23±1.17,11.32±2.35 vs 27.65±1.76,7.66±0.93 vs 76.1±5.37);血清IL-4,IL-10的水平與正常組相比無差異(30.11±1.67 vs 28.78±2.51,48.35±2.62 vs 47.21±2.83)。與治療前相比,治療后RA患者血清中的IL-1β、COX-2、TNF-α、IL-4和IL-10的值分別為6.85±0.78,17.25±2.33,9.61±1.02,46.45±1.08,71.25±1.76,其中IL-1β、COX-2和TNF-α水平治療后顯著下降,IL-4和IL-10水平顯著上升(P<0.05)。
3 討 論
RA作為自身免疫性疾病,其發病機制到目前為止尚未完全明確,有相關報道指出,單核細胞、淋巴細胞等分泌的細胞因子在RA滑膜組織中大量浸潤,細胞因子在促進RA形成過程中起著關鍵的作用。
IL-1和TNF-α作為引起RA的關鍵因子,為促進RA形成的病理因素〔5〕。有報道指出,正常的關節滑膜液中含有少量的IL-1,主要以IL-1β存在,在RA患者的血清中可檢測到大量的IL-1因子;并具有加快RA惡化的作用;同時具有促進滑膜增厚等作用〔6,7〕。IL-1促進淋巴細胞的分化,釋放前列腺素E2和膠原酶,其對滑膜的炎癥反應具有促進作用,可損傷軟骨基質〔8〕。TNF-α作為引起RA滑膜炎的關鍵因子,具有促進炎癥反應和免疫反應的作用,在RA整個反應進程中表現活躍。TNF-α可激活淋巴細胞等,促進成纖維細胞的增生,并可誘導IL-1等炎癥介質的生成,從而加重滑膜及軟骨的損傷〔6〕。臨床研究表明RA患者的血液和滑膜液中TNF-α水平增高,TNF-α受體表達量顯著增多〔9〕。甲氨蝶呤作為臨床治療RA經典藥物,可降低RA患者滑膜組織中的IL-1和TNF-α的水平;益賽普通過影響RA形成的關鍵環節發揮良好的治療RA的作用〔10〕。本研究說明益賽普聯合甲氨蝶呤可通過下調IL-1和TNF-α治療RA。
有學者推測,RA患者IL-1和TNF-α高水平的表達,可誘導滑膜組織大量生成COX-2,促進前列腺素E2的生成,引起炎癥反應〔11〕。COX-2在介導炎癥的發生過程中起重要作用,在RA滑膜炎中表達增強。COX-2和血管因子可在RA的發生和發展中起著調控作用,當給予COX-2拮抗劑時,前列腺素E2被抑制,從而減輕RA的炎癥反應〔12〕。張永紅等〔13〕發現,通過抑制 COX-2 mRNA的表達,可減少前列腺素E2的合成,抑制滑膜細胞的增生,阻斷RA的發展,達到治療RA的目的。
IL-4和IL-10作為RA的主要拮抗因子被廣泛關注〔14〕。IL-4通過抑制多種致炎因子,減少IL-1和TNF-α在滑膜和軟骨細胞的表達,下調NO和減少前列腺素E2的合成,并具有保護軟骨和其他組織等功能,在RA過程中起到抑制炎癥反應的作用〔15〕。IL-10可抑制TNF-α和IL-2等,阻斷前列腺素E2的合成;并誘導滑膜中產生IL-1的拮抗劑,發揮抗炎作用〔16〕。本研究結果表明,益賽普聯合甲氨蝶呤用藥可顯著的提高RA患者血清中的IL-4和IL-10的水平。
綜上,RA的發病機制尚不明確,而對細胞因子的研究可推動對RA機制的認識和探究〔15〕。益賽普聯合甲氨蝶呤可降低RA患者IL-1、TNF-α和COX-2的表達量,上調IL-4和IL-10而發揮治療的作用,為治療RA提供合理和科學的理論依據。
4 參考文獻
1黃 烽.類風濕關節炎聯合治療必要性探討〔J〕.中華風濕病學雜志, 2004;8(5): 259-61.
2Raza K,Bucklcy CE,Salmon M,etal.Treating very early rheumatoid arthritis〔J〕.Best Pract Res Clin Rheumatol,2006;20(5):849-63.
3魏 巍,韓 捷.益賽普聯合甲氨蝶呤治療中老年類風濕關節炎療效評價〔J〕.浙江中西醫結合雜志,2011;21(4):247-9.
4Amett FC, Edworthy SM, Bloch DA,etal.The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis〔J〕.Arthritis Rheum,1988;31(3):315-22.
5Miossec P, van den Berg W.Th1 /Th2 cytokine balance in arthritis〔J〕.Arthritis Rheum, 1997;40(12):2105-51.
6高 薇,魯 靜,趙麗娟.炎性細胞因子與類風濕關節炎〔J〕.中國現代醫學雜志, 2007;17(4):450-4.
7Dayer JM.The pivotal role of interleukin-1 in the clinical manifestations of rheumatoid arthritis〔J〕.Rheumatology, 2003;42(2):3-10.
8Strand V, Kavanaugh AF.The role of interleukin-1 in bone resorption in rheumatoid arthritis〔J〕.Rheumatology, 2004;43(Suppl- 3):Ⅱ-Ⅰ10-Ⅲ16.
9龐學豐,劉 歡,高立珍,等.寒痹康沖劑對類風濕關節炎細胞因子的影響〔J〕.事珍國醫國藥,2010;21(11):2777-8.
10姚航平,李敏偉,張立煌,等.滑膜成纖維細胞環氧化酶-2和誘導型一氧化氮合酶在類風濕關節炎中的表達〔J〕.中華檢驗醫學雜志,2002;25(11):345-8.
12王建華,吳岳嵩.血管內皮生長因子與類風濕關節炎〔J〕.中華風濕病學雜志,2001;5(6):387-9.
13張永紅,于慧敏,聶英坤.紫草素對類風濕關節炎滑膜成纖維細胞COX- 2 表達的影響〔J〕.哈爾濱醫科大學學報,2012;46(3):261-5.
14孫曉云,蘇 茵,任麗敏,等.甲氨蝶呤對類風濕關節炎患者的治療作用及對相關細胞因子的影響〔J〕.北京大學學報(醫學版),2006;38(4):356-9.
15徐曉玲,梁瑞霞,黃君健,等.細胞因子在類風濕關節炎發病機制中的作用〔J〕.生物技術通訊,2008;19(1):111-4.
16Mocdellin S, Marincila F, Rossi CR,etal.The multifaceted relationship between IL- 10 and adaptive immunity: putting together the pieces of a puzzle〔J〕.Cytokine Growth Factor, 2004;15(1): 61- 76.

