絞股藍總皂苷對光老化人皮膚成纖維細胞Caspase-3信號通路的影響
王繼慧,張小卿,馬月丹,張 燚,馬賢德,吳景東
在整體、器官、細胞和基因、蛋白水平上找到可測量的異常,已成為中外醫學的研究趨勢[1]。皮膚光老化即因長期或急性大劑量受到日光照射所導致的皮膚損傷和衰老。皮膚衰老(包括光老化)現代機制可闡述為,細胞的遺傳基因調控是根本,自由基的作用可能為內因,細胞代謝障礙是基礎,環境因素包括光損傷為外因的衰老機制理論。細胞凋亡被認為是機體穩態維持和DNA損傷細胞清除的重要調節機制。細胞凋亡可調節皮膚發育,在維持皮膚生理穩態和避免腫瘤發生中起關鍵作用[2]。但是,細胞凋亡過多,會導致機體免疫力下降,容易激發感染,一些人類皮膚病就是以細胞凋亡的增加為特征[3]。長波紫外線(UVA)照射細胞后,首先在細胞內產生大量活性氧,成為皮膚光損傷的主要因素。過量的活性氧會導致細胞氧化應激并產生細胞凋亡轉錄因子,引起細胞凋亡[4]。研究認為,經紫外線輻射受損的細胞,如果其損傷修復率提高,凋亡率就明顯下降[5]。
楊靚[6]研究發現,絞股藍可以顯著影響細胞凋亡發生途徑和結果,細胞凋亡與Caspase信號通路密切相關;絞股藍總皂苷(Gyp)具有較強的清除自由基、抗氧化等作用[7]。提示絞股藍對光老化皮膚細胞凋亡可能有保護性影響。人皮膚結構中,真皮內的成纖維細胞具有合成和分泌蛋白質并參與組織損傷后修復的功能。但關于絞股藍對光老化人皮膚成纖維細胞(HSF細胞)凋亡影響的實驗研究目前還十分少見。本實驗通過觀測Gyp含藥血清對光老化HSF細胞凋亡及相關基因和蛋白的調控,通過探討Caspase-3信號通路對細胞凋亡的調控作用,期望能揭示Gyp對光老化HSF細胞凋亡的保護性影響。本實驗采用的永生化HSF細胞作為可在體外傳代的永生化細胞無成瘤性,與正常HSF細胞分化特性高度相似,是研究HSF細胞的良好工具。
1 材料與方法
1.1 實驗動物 選擇雄性SPF級SD大鼠20只,體質量(200±20)g,購于中國醫科大學,常規顆粒飼料喂養,自由飲水,12 h晝夜節律。
1.2 實驗試劑 HSF細胞購于上海艾研生物科技有限公司;Gyp購于成都曼斯特生物科技有限公司(批號:MUST-11031401);細胞蛋白提取試劑(批號:P0013)、BCA法蛋白定量試劑盒(批號:P0012S)、ECL發光液(批號:P0018)購于碧云天生物科技有限公司。
1.3 實驗設備 電熱恒溫振蕩器(SHA-B型)常州國華儀器設備廠生產;酶標儀(antho2010型)奧地利Anthos公司生產;凝膠成像分析系統(ChemiImager5500型)美國Alphainnotech Chemi Imager生產;水平搖床(WD-9405B型)北京六一儀器廠生產;垂直板電泳裝置(Mini-Protein Ⅲ型)美國Bio-Rad公司生產;電泳儀(EPS300)上海天能科技有限公司生產;轉印電泳槽(DYY 40B型)北京六一儀器廠生產;UBA(UV)光源(20 W)訂制于南京華強電子有限公司;紫外光光度計(UV-340A型)臺灣路昌電子儀器有限公司生產。
1.4 實驗方法
1.4.1 含藥血清的制備、細胞培養和光老化模型復制 將20只大鼠按照隨機數字表法平均分為4組,分別是正常血清組和低、中、高劑量含藥血清組,每組5只。根據Meeh-Rubner公式,算出200 g體質量大鼠每天給藥量大約80 mg,并以此作為低劑量含藥血清組大鼠日給藥量,中劑量含藥血清組給藥量是低劑量含藥血清組的2倍,高劑量含藥血清組給藥量是低劑量含藥血清組的4倍。將Gyp溶于0.9%氯化鈉溶液后灌胃,1次/d,共7 d,等第7天灌胃結束1 h后,主動脈取血,于促凝管內,室溫靜置1 h,1 200×g離心10 min,收集上清液。將每組大鼠血清分別收集于同一50 ml離心管中,置于56 ℃水浴中滅活,0.22 μm過濾滅菌,凍存備用。用含10%胎牛血清和1%雙抗的DMEM培養基,37 ℃,5%二氧化碳(CO2)環境中培養HSF細胞,隔日傳代。參照陶冶等[8]研究進行光老化HSF細胞模型復制:紫外線的照射劑量計算方法參考文獻[9],照射劑量(J/cm2)=照射強度(W/cm2)×照射時間(s),通過紫外線輻照計測量照射強度,使照射劑量達到36 J/cm2。將處于對數生長期的HSF細胞消化成單細胞懸液,以1×104個/ml的濃度接種于另一培養瓶,5 ml/瓶,共接種25瓶。連續培養24 h后,棄去舊培養液,加入適量的磷酸鹽緩沖液(PBS),反復洗至PBS無色,加入PBS,2 ml/瓶,于UVA下照射。光源選用UVA 365 nm燈管,采用5根并排照射。培養瓶距燈源15 cm,待照射穩定后測量UVA的照射功率。
1.4.2 實驗分組及含藥血清干預 取處于對數生長期的HSF細胞,棄去舊培養液,以0.25%胰酶消化后加入新鮮培養液制成細胞懸液,以1×104個/ml接種于25 cm2的培養瓶中,共計30瓶,共分為6組。其中,隨機抽取5瓶,作為空白對照組,正常培養,不施加任何干預因素。其余25瓶細胞,于37 ℃,CO2培養箱培養48 h后,棄去舊培養液,PBS清洗3次至PBS無色,加入2 000 μl PBS,放在UVA下照射,待照射穩定后測量UVA的照射功率,選擇36 J/cm2UVA劑量建立光老化HSF細胞模型。將上述所剩的25瓶經過UVA照射的細胞隨機分為5組,采取不同干預方法,分別為UVA模型組、正常血清干預組、低劑量含藥血清干預組、中劑量含藥血清干預組和高劑量含藥血清干預組,每組5瓶。其中,UVA模型組HSF細胞經照射后,棄去PBS,加入5 ml新鮮培養液培養12 h;正常血清組HSF細胞經UVA照射后,棄去PBS,加入5 ml含10%正常大鼠血清的新鮮培養液培養12 h;低、中、高劑量含藥血清干預組HSF細胞經UVA照射后,棄去PBS,分別加入5 ml含10%低、中、高劑量大鼠含藥血清的新鮮培養液培養12 h。
1.5 指標檢測
1.5.1 采用二氯熒光素(DCF)法檢測UVA誘導的細胞活性氧表達 接種細胞:96孔板,接種細胞數為1.5萬/孔。二氯二氫熒光素-乙酰乙酸酯(DCFH-DA)孵育:接種24 h后用有糖Earle′s液洗兩遍,并換上終濃度為25 μmol/L DCFH-DA培養箱孵育30 min。處理:DCFH-DA孵育結束后,再用有糖Earle′s液洗兩遍給予處理。酶標儀檢測熒光強度。
1.5.2 增殖反應測定 四甲基偶氮唑鹽微量酶反應比色法(MTT法)檢測各組HSF細胞活性。無菌操作取各組單個細胞懸液,用Hanks液洗3次,每次離心10 min(800×g)。用苔盼藍計數活細胞數為96%,用含10%小牛血清的RPMI-1640培養液調整濃度至5×108/ml,將細胞懸液加入96孔培養板,100 μl/孔。分別設定刺激孔和對照孔,刺激孔加入Con-A(終濃度為5 μg/ml),對照孔加入等量的RPMI-1640培養液,同時刺激孔和對照孔再設3個平行孔,混勻后,將培養板置于37 ℃含5%CO2培養箱中,培養72 h。在培養結束前4 h取出培養板,向每孔中加入噻唑藍15 μl(5 g/L),繼續培養4 h后,輕輕棄去上清液,每孔加入二甲基亞砜(DMSO)150 μl,在振蕩器上振蕩10 min,使結晶物充分溶解,在酶聯免疫檢測儀上490 nm波長處測各孔光密度值(OD值)。
1.5.3 反轉錄-聚合酶鏈反應(RT-PCR)和Western-blotting法檢測細胞Caspase-3 mRNA和蛋白表達情況 RT-PCR:分別進行光老化各組HSF細胞總RNA提取、cDNA第一鏈合成、PCR和瓊脂糖凝膠電泳實驗。在波長為254 nm的紫外燈下觀察實驗結果,于凝膠成像系統中拍照并保存數據。Western-blotting:收集細胞,PBS漂洗并裂解細胞,然后測定Caspase-3濃度,30%聚丙烯酰胺凝膠電泳,蛋白轉移到聚偏氟乙烯(PVDF)膜上,將麗春紅染色過的PVDF膜用去離子水漂洗3次,洗去紅色條帶。置于25 ml封閉液中,室溫搖床上緩慢搖動1 h,一抗稀釋于封閉液中4 ℃搖晃過夜,三乙醇胺緩沖鹽水溶液(TBS/T)漂洗3次;二抗稀釋于封閉液中,室溫搖晃1 h,再以TBS/T漂洗3次,蛋白信號由ECL試劑盒檢測,記錄結果。
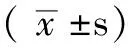
2 結果
2.1 各組HSF細胞活性氧水平比較 6組HSF細胞活性氧(平均熒光強度)及活性氧水平比較,差異均有統計學意義(P<0.01);其中與空白對照組比較,UVA模型組、正常血清干預組、低劑量含藥血清干預組、中劑量含藥血清干預組和高劑量含藥血清干預組HSF細胞活性氧(平均熒光強度)及活性氧水平升高,差異均有統計學意義(P<0.01);與UVA模型組和正常血清干預組比較,低劑量含藥血清干預組、中劑量含藥血清干預組、高劑量含藥血清干預組HSF細胞活性氧(平均熒光強度)及活性氧水平降低,差異均有統計學意義(P<0.01,見表1)。

表1 6組HSF細胞活性氧水平比較Table 1 Comparison of reactive oxygen species in each group of HSF
注:與空白對照組比較,*P<0.01;與UVA模型組比較,▲P<0.01;與正常血清干預組比較,△P<0.01
2.2 各組HSF細胞增殖活性比較 6組HSF細胞OD值比較,差異有統計學意義(P<0.01);其中與空白對照組比較,UVA模型組、正常血清干預組、低劑量含藥血清干預組、中劑量含藥血清干預組、高劑量含藥血清干預組OD值降低,差異均有統計學意義(P<0.01);與UVA模型組及正常血清干預組比較,中劑量含藥血清干預組、高劑量含藥血清干預組OD值升高,差異均有統計學意義(P<0.01,見表2)。

表2 6組HSF細胞OD值比較Table 2 Comparison of OD of each group of HSF
注:與空白對照組比較,*P<0.01;與UVA模型組比較,▲P<0.01;與正常血清干預組比較,△P<0.01
2.3 各組HSF細胞Caspase-3 mRNA表達水平比較 6組HSF細胞Caspase-3 mRNA表達水平比較,差異有統計學意義(P<0.01);其中與空白對照組比較,UVA模型組、正常血清干預組、低劑量含藥血清干預組、中劑量含藥血清干預組、高劑量含藥血清干預組Caspase-3 mRNA表達水平升高,差異均有統計學意義(P<0.01);與UVA模型組及正常血清干預組比較,低劑量含藥血清干預組、中劑量含藥血清干預組、高劑量含藥血清干預組Caspase-3 mRNA表達水平降低,差異均有統計學意義(P<0.01);與低劑量含藥血清干預組比較,中劑量含藥血清干預組、高劑量含藥血清干預組Caspase-3 mRNA表達水平降低,差異均有統計學意義(P<0.01);與中劑量含藥血清干預組比較,高劑量含藥血清干預組Caspase-3 mRNA表達水平降低,差異有統計學意義(P<0.01,見表3、圖1)。
2.4 各組HSF細胞Caspase-3表達水平比較 6組HSF細胞Caspase-3表達水平比較,差異有統計學意義(P<0.01);其中與空白對照組比較,UVA模型組、正常血清干預組、低劑量含藥血清干預組、中劑量含藥血清干預組、高劑量含藥血清干預組Caspase-3表達水平升高,差異均有統計學意義(P<0.01);與UVA模型組和正常血清干預組比較,低劑量含藥血清干預組、中劑量含藥血清干預組、高劑量含藥血清干預組Caspase-3表達水平降低,差異均有統計學意義(P<0.01);與低劑量含藥血清干預組和中劑量含藥血清干預組比較,高劑量含藥血清干預組Caspase-3表達水平降低,差異均有統計學意義(P<0.01,見表4、圖2)。
3 討論
中國醫學典籍中的“陽淫”“明淫”致病學說,討論了日光過度照射而致熱疾的發病機制。中醫診治的面部損美性疾病如黧黑斑、雀斑和黑變病等,病因病機都涉及日光照射皮膚所致的損害,提示光毒是誘發皮膚損傷乃至日久引起皮膚老化和損美性疾病的主要外感因素[10]。

注:A空白對照組,B UVA模型組,C正常血清干預組,D低劑量含藥血清干預組,E中劑量含藥血清干預組,F高劑量含藥血清干預組
圖1 RT-PCR法檢測各組HSF細胞中Caspase-3 mRNA表達
Figure1 Caspase-3 mRNA expression of each group of HSF determined by RT-PCR

表3 6組HSF細胞Caspase-3 mRNA表達水平比較Table 3 Comparison of Caspase-3 mRNA expression of each group of HSF
注:與空白對照組比較,*P<0.01;與UVA模型組比較,●P<0.01;與正常血清干預組比較,△P<0.01;與低劑量含藥血清干預組比較,▲P<0.01;與中劑量含藥血清干預組比較,☆P<0.01

表4 6組HSF細胞Caspase-3表達水平比較Table 4 Comparison of Caspase-3 protein expression of each group of HSF
注:與空白對照組比較,*P<0.01;與UVA模型組比較,●P<0.01;與正常血清干預組比較,△P<0.01;與低劑量含藥血清干預組比較,▲P<0.01;與中劑量含藥血清干預組比較,☆P<0.01

注:A空白對照組,B UVA模型組,C正常血清干預組,D低劑量含藥血清干預組,E中劑量含藥血清干預組,F高劑量含藥血清干預組
圖2 Western-blotting法檢測各組HSF細胞中Caspase-3表達
Figure2 Caspase-3 protein expression of each group of HSF determined by Western-blotting
中藥絞股藍味甘微苦性寒,歸脾肺腎三經,具益氣養陰、健脾胃、清肺熱之功。現代實驗研究發現,Gyp有顯著鎮靜、鎮痛、抗氧化、抗疲勞等作用,與皮膚光老化損傷的防治目標相吻合[11-13]。
近年體內研究證實,絞股藍具有一定的抗皮膚光老化作用[14]。Gyp為絞股藍主要藥理成分,其藥理作用可能與絞股藍有相似之處。故在本研究中,將Gyp作為干預因素施加于大鼠,以制備含藥血清。
研究表明,紫外線輻射可使HSF細胞的膠原合成減少,使皮膚失去緊致和彈力,產生皮膚皺紋,并誘導光老化發生[15]。皮膚光老化與UVA誘導細胞凋亡發生密切相關。本研究證實,UVA模型組HSF細胞凋亡顯著增加。當采用Gyp含藥血清干預后,細胞增殖活性則明顯上升,且高劑量含藥血清組干預效果最為顯著,提示Gyp對細胞的積極作用。
細胞在生理狀態下,通過正常代謝過程而產生的各種活性氧,在抗氧化物質作用下能夠及時被清除。當紫外線作用于細胞,首先是細胞內發色基團(包括:DNA、尿刊酸、芳香族氨基酸等)吸收其電磁能量,并將其轉化為化學能量,譬如與氧分子相互作用,產生活性氧簇[16-17]。當細胞受到過度刺激而使活性氧產生過多,可導致細胞細胞凋亡甚至壞死。本研究中UVA誘導細胞產生過量活性氧,提示活性氧在紫外線光老化中起著重要作用,這與以往實驗結果一致[18]。而Gyp含藥血清干預后HSF細胞中活性氧水平下調,表明絞股藍可以緩解或減輕紫外線誘導的光老化HSF細胞毒性,并使損傷得到明顯恢復,對細胞活性具有保護性作用。
細胞內線粒體基因組(線粒體DNA) 突變率可以很好反映皮膚中UVA的累積損傷,因為該比例與年齡無關,而與皮膚光老化的程度有關[19]。UVA誘導的細胞凋亡是一個復雜事件,人體皮膚通過細胞凋亡來消除光損傷細胞,涉及不同的途徑。其中的細胞色素C釋放和Caspase激活的生物化學通路,主要在細胞受到死亡受體非依賴性刺激時被激活,并有放大死亡受體通路信號的作用,而紫外線輻射就屬于這類刺激。該通路中,Caspase蛋白家族的級聯激活起著重要作用,Caspase激活是凋亡發生的關鍵環節之一[20-21]。生理狀態下,Caspase家族在胞質中以酶原形式存在。UVA輻射通過某些途徑促使線粒體釋放細胞色素C等促凋亡因子,促使Caspase-9與其結合形成凋亡小體,Caspasde-9被激活后,引起Caspase-3的激活,從而誘導細胞凋亡。Caspase-3作為Caspase家族成員中執行細胞凋亡的關鍵酶之一,是細胞凋亡的中樞效應器[22]。又有研究證實,線粒體通路激活的標志性蛋白就是Caspase-3,多種刺激因素的啟動信號均可激活Caspase-3,然后裂解多種蛋白,阻止DNA復制和細胞修復破壞細胞核整體結構,最終導致細胞凋亡。因此,Caspase-3活化程度可作為判斷細胞凋亡嚴重性的可靠指標之一[23-24]。
本研究發現,UVA模型組HSF細胞中Caspase-3基因和蛋白表達都上升,提示UVA刺激HSF細胞后,在細胞信號轉導的級聯反應中,Caspase-3被活化,從而啟動下游凋亡信號,可引起細胞凋亡現象發生。但當加入抗氧化劑Gyp后,各組光老化模型細胞中Caspase-3基因和蛋白表達下調,即Gyp下調了由該通路發生的DNA轉錄水平,提示Gyp作為功效良好的抗氧化劑,可以拮抗紫外線誘導的光老化HSF細胞的氧化應激反應,緩解細胞遭受不利因素的刺激強度,最終減輕光老化損傷程度、減少細胞凋亡的發生,起到對HSF細胞抵抗紫外線損傷的保護作用。其作用機制包括抑制細胞內活性氧的過量生成,也包括抑制與細胞凋亡相關的Caspase家族信號通路的活性,最終減輕UVA誘導的HSF細胞光老化現象,提示絞股藍對光老化HSF細胞有一定保護作用。
1 Kern PA,Ranganathan S,Li C,et al.Adipose tissue tumor necrosis factor and interleukin-6 expression in human obesity and insulin resistance [J].Am J Physiol Endocrinol Metab,2001,280(5):E745-751.
2 Pustisek N,Situm M.UV-radiation,apoptosis and skin [J].Coll Antropol,2011,35(Suppl 2):339-341.
3 胡野,凌志強.細胞凋亡與分子醫學[M].北京:軍事醫學科學出版社,2002:20-21.
4 Zhou BR,Yin HB,Xu Y,et al.Baicalin protects human skin fibroblasts from ultraviolet A radiation-induced oxidative damage and apoptosis[J].Free Radic Res,2012,46(12):1458-1471.
5 Kulms D,P?ppelmann B,Yarosh D,et al.Nuclear and cell membrane effects contribute independently to the induction of apoptosis in human cells exposed to UVB radiation [J].Proc Natl Acad Sci USA,1999,96(14):7974-7979.
6 楊靚.絞股藍總皂苷誘導小鼠白血病L1210細胞凋亡及機制探討[D].西安:陜西師范大學,2011.
7 黃梅,王學軍,楊凱.中藥抗氧化成分及抗氧化活性的體外評價方法[J].重慶科技學院學報:自然科學版,2006,8(3):109-112.
8 陶冶,張小卿,馬賢德,等.絞股藍總皂苷含藥血清對光老化HaCaT細胞NF-κB通路的影響[J].安徽醫科大學學報,2012,47(10):1178-1181.
9 李薇.長波紫外線對人角質形成細胞和成纖維細胞的形態、數目及誘導型一氧化氮合酶表達的影響[D].長沙:中南大學,2007.
10 劉寧.美容中醫學[M].北京:人民衛生出版社,2010:329-334.
11 李楠,谷繼卜,曲桂霞.絞股藍水煎劑對老齡小鼠SOD和LPO的抗衰老研究[J].黑龍江醫藥科學,2012,35(4):41.
12 李杰,楊舟,詹琤琤.絞股藍化學成分與藥理作用研究概況[J].湖北中醫雜志,2012,34(10):74-76.
13 蘇齊鑒,梁飛立,李益忠,等.絞股藍總甙片聯合山楂精降脂片治療高效抗逆轉錄病毒治療后血脂異常的療效研究[J].中國全科醫學,2012,15(11):3903.
14 吳景東.絞股藍抗皮膚光老化的實驗研究[D].沈陽:遼寧中醫藥大學,2006.
15 Tang S,Lucius R,Wenck H,et al.UV-mediated downregulation of the endocytic collagen receptor,Endo180,contributes to accumulation of extracellular collagen fragments in photoaged skin[J].J Dermatol Sci,2013,70(1):42-48.
16 Valencia A,Kochevar IE.Nox1-based NADPH oxidase is the major source of UVA-induced reactive oxygen species in human keratinocytes [J].J Invest Dermatol,2008,128(1):214-222.
17 Dwivedi N,Flora SJ.Concomitant exposure to arsenic and organophosphates on tissue oxidative stress in rats [J].Food Chem Toxicol,2011,49(5):1152-1159.
18 Bossi O,Gartsbein M,Leitges M,et al.UV irradiation increases ROS production via PKCdelta signaling in primary murine fibroblasts[J].J Cell Biochem,2008,105(1):194-207.
19 Brirch-Machin MA.Tindall M,Turner R,et al.Mitochondrial DNA deletions in human skin reflect photo- rather than chronologic aging [J].J Invest Dermatol,1998,110(2):149-152.
20 薛書霞,張景華,李景武,等.P53、Caspase-3和凋亡調節蛋白FasL在乳腺癌的表達及其意義[J].海南醫學院學報,2011,18(1):21-23.
21 蔣令修,王金蘭,婁季宇,等.硫酸鎂對實驗性腦出血大鼠細胞凋亡及Caspase-3表達的影響[J].疑難病雜志,2012,11(2):120.
22 Earnshaw WC,Martins LM,Kaufmann SH,et al.Mammalian caspased:structure,activation,substrates,and functions during apoptosis [J].Annu Rev Biochem,1999,68:383-424.
23 Wang XH,Zhang L,Mitch WE,et al.Caspase-3 cleaves specific 19 S proteasome subunits in skeletal muscle stimulating proteaseme activity [J].Biol Chem,2010,285(28):21249-21257.
24 李里,宮亮,吳玉斌.增殖細胞核抗原和caspase-3在單側輸尿管梗阻大鼠模型中的表達及其意義[J].中國全科醫學,2012,15(10):3489.

