溶瘤病毒OncoVexGM-CSF在惡性腫瘤中的應用及研究進展
柯 雪,董 武,白 楓,楊 琨
近年來,隨著基因工程在醫(yī)學領域的應用,一種新型抗腫瘤方法——溶瘤病毒(Oncolytic viruses)療法成為腫瘤治療的研究熱點,溶瘤病毒療法具有選擇性殺傷惡性腫瘤細胞、療效可靠且毒副作用少等優(yōu)點。溶瘤病毒對惡性腫瘤細胞有很強的感染力,可在惡性腫瘤細胞中大量復制、增殖,并溶解破壞惡性腫瘤細胞并釋放更多的病毒,感染更多的惡性腫瘤細胞,且正常細胞不受其影響,從而達到清除惡性腫瘤的治療目的[1-3]。早在20世紀初,研究者們便發(fā)現(xiàn)在接種病毒疫苗的腫瘤患者中,腫瘤出現(xiàn)自發(fā)性退化;早期的動物實驗證實新城疫病毒和流感病毒可以使鼠腫瘤消退。經(jīng)歷了1個世紀的研究發(fā)展,溶瘤病毒載體范圍越來越大,其中包括單純皰疹病毒(HSV)、腺病毒、水泡性口炎病毒 (VSV)、新城疫病毒、麻疹病毒、脊髓灰質炎病毒、細小病毒、呼腸孤病毒、痘苗病毒等。筆者以“ Oncolytic viruses”為關鍵詞在PubMed檢索2006—2013年發(fā)表的相關文獻,對溶瘤病毒OncoVexGM-CSF在惡性腫瘤中的應用及研究進展進行綜述。
HSV是在基因工程中一種常用的病毒,野生型HSV分為Ⅰ型和Ⅱ型,其中Ⅰ型HSV(HSV-1)復制能力強、基因組大、能插入較大的基因片段、所引發(fā)的并發(fā)癥較為輕微,因此在基因治療中常被用作載體。OncoVexGM-CSF便是基于HSV-1研制的一種新型溶瘤病毒,目前被認為是單劑量治療惡性腫瘤最具前景的溶瘤病毒[4-5]。
1 OncoVexGM-CSF的構建
HSV-1與其他溶瘤病毒載體相比具有以下優(yōu)勢:(1)能感染多種腫瘤細胞(包括人黑色素瘤細胞);(2)復制周期短,從而產(chǎn)生更好的溶瘤作用;(3)能夠整合1種或多種外源基因,從而增強其抗瘤作用;(4)已被廣大臨床研究機構接受和運用[6]。對HSV-1的研究始于轉基因溶瘤性HSV G207[7],研究者將G207用于惡性腦膠質瘤的治療并取得了滿意效果,從而開始了HSV-1應用于惡性腫瘤治療的一系列研究。第二代HSV-1產(chǎn)品G47△改良自G207,已證實其在膀胱癌、結直腸癌、胃癌及前列腺癌中均有明顯的治療作用[8-11]。
OncoVexGM-CSF由HSV-1的JS1菌種構建,剔除了HSV-1中的ICP34.5和ICP47基因,并將人粒-巨噬細胞集落刺激因子(GM-CSF)整合插入到了ICP34.5位點,是一種加入了免疫調控因子GM-CSF的新型溶瘤病毒。因此,又稱之JS1/ICP34.5/ICP47-/GM-CSF,其構建原理見表1。
ICP34.5基因是一種和神經(jīng)毒性相關的基因,剔除ICP34.5基因后HSV-1失去了神經(jīng)毒活性并能選擇性地在腫瘤細胞中快速復制[12-13]。剔除ICP34.5基因的HSV-1能選擇性地在腫瘤細胞復制,其作用機制在于腫瘤細胞高表達DNA復制修復蛋白和增殖細胞核抗原(PCNA),導致病毒在無ICP34.5基因的情況下在腫瘤細胞內正常復制[14],而在正常的真核細胞,病毒復制依賴于PCNA-ICP34.5復合體。因此,剔除ICP34.5基因后的HSV-1只能在腫瘤細胞內有效復制。ICP47基因在病毒的免疫逃逸中扮演了重要角色,其主要通過抑制抗原提呈相關轉運蛋白1(TAP1)和抗原提呈相關轉運蛋白2(TAP2)而阻止抗原遞呈作用[15]。因此,剔除ICP47基因可促進病毒抗原遞呈作用,有利于建立特異性免疫反應。此外,剔除ICP47基因還可增加HSV獨特型短-(US)11基因的表達,從而在不削弱腫瘤選擇性的同時促進病毒增殖。US11基因在正常情況下由延遲型病毒啟動子操控,剔除ICP47基因后,US11則受控于立早型ICP47啟動子。由US11基因編碼的21 kDa RNA結合蛋白集中于胞核且具有抑制細胞蛋白激酶R(PKR)激活的作用。早期US11的表達阻斷了PKR激活過程并促進剔除ICP34.5基因的HSV-1在腫瘤細胞內復制[14]。因此,剔除ICP34.5和ICP47基因的OncoVexGM-CSF可選擇性地在腫瘤細胞內復制,且免疫原性增強,致病性減弱。
OncoVexGM-CSF最大的特點是整合了人GM-CSF編碼序列,而GM-CSF是一種強有力的樹突狀細胞(DC細胞)募集和促成熟因子。OncoVexGM-CSF在體外對各種腫瘤細胞株的溶瘤活性已被證實。Cody等[13]在鼠腹部雙側建立了A20腫瘤模型,證實剔除ICP34.5和ICP47基因的HSV(JS1/ICP34.5-/ICP47-)只能引起注射區(qū)瘤體消失,但剔除ICP34.5和ICP47基因并同時加載了人GM-CSF(JS1/ICP34.5-/ICP47-/GM-CSF)的HSV則能引起注射區(qū)和對側未注射區(qū)瘤體同時消失。所以,人GM-CSF對引發(fā)全身免疫反應起決定作用。
2 OncoVexGM-CSF的溶瘤機制
在黑色素瘤體區(qū)域直接注射OncoVexGM-CSF能在局部募集GM-CSF,從而吸引成熟DC細胞吞噬瀕死的黑色素瘤細胞。因此,OncoVexGM-CSF通過兩種作用機制而發(fā)揮治療作用:(1)對腫瘤細胞的直接溶瘤、破壞作用及刺激DC細胞等而引發(fā)腫瘤特異性免疫反應;(2)啟動抗原特異性T細胞免疫反應。
表1 OncoVexGM-CSF的構建原理
Table1 The construction principle of OncoVexGM-CSF
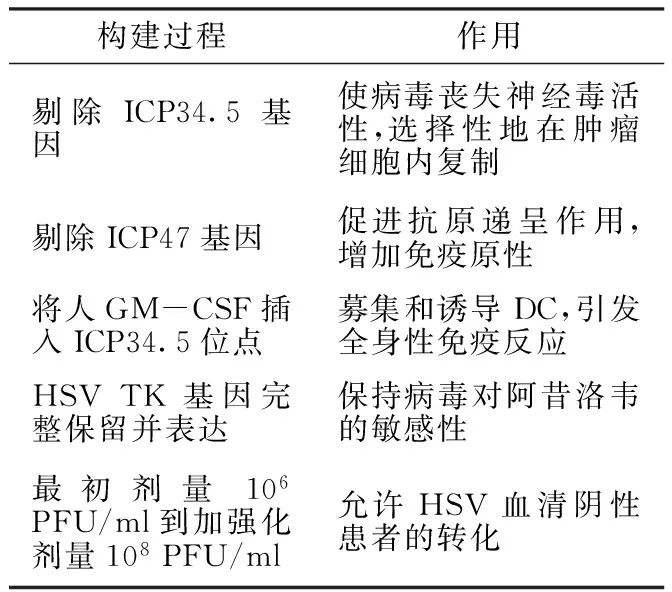
構建過程作用剔除ICP34.5基因使病毒喪失神經(jīng)毒活性,選擇性地在腫瘤細胞內復制剔除ICP47基因促進抗原遞呈作用,增加免疫原性將人GM-CSF插入ICP34.5位點募集和誘導DC,引發(fā)全身性免疫反應HSVTK基因完整保留并表達保持病毒對阿昔洛韋的敏感性最初劑量106PFU/ml到加強化劑量108PFU/ml允許HSV血清陰性患者的轉化
注:GM-CSF=粒-巨噬細胞集落刺激因子,DC=樹突狀細胞,HSV TK=單純皰疹病毒胸腺嘧啶核苷激酶,PFU=空斑形成單位;HSV=單純皰疹病毒
3 OncoVexGM-CSF的安全性和耐受性
Koga等[24]對9位放棄后續(xù)放療的神經(jīng)瘤患者進行早期溶瘤病毒HSV 1716治療安全性評價,證實了105PFU/ml劑量的HSV 1716直接注射入瘤體并未產(chǎn)生任何毒副作用;實驗室檢查和尸檢均證明無一例患者在瘤體注射HSV 1716后發(fā)生腦炎。而在轉移性黑色素瘤中,此劑量的HSV 1716也不會產(chǎn)生毒性或在非瘤細胞內復制。研究人員正在試圖進一步證明HSV能夠在神經(jīng)膠質瘤中生存和復制,且不會對宿主造成毒性作用[25]。對于惡性膠質瘤,另一種溶瘤病毒HSV G207也被證實在3×109PFU/ml劑量時沒有毒副作用。
Hu等[5]對30例難治性惡性腫瘤(乳腺癌、頭頸癌、胃腸癌、惡性黑色素瘤)患者進行的Ⅰ期臨床試驗中,13例患者分別接受了單次劑量為106、107和108PFU/ml的OncoVexGM-CSF治療,1次/1~3周,而由于HSV血清陰性患者在接受了107PFU/ml的OncoVexGM-CSF治療后出現(xiàn)了局部紅斑擴大和炎性反應,因此,研究者認為單次劑量107PFU/ml為HSV血清陰性患者血清轉化為陽性前的OncoVexGM-CSF最大耐受劑量;研究者還對注射OncoVexGM-CSF后1、4、8、24、48 h注射病損區(qū)進行刮拭,并對所取下的標本進行噬菌斑測定,結果表明皮膚表面均無病毒存在,提示OncoVexGM-CSF耐受性較好。在該臨床試驗中還發(fā)現(xiàn),單次劑量組患者的主要毒副作用為腫瘤局部反應和低熱,且在HSV血清陰性患者中更為明顯;多劑量組患者的毒副作用主要是全身癥狀,如發(fā)熱、出汗、疲乏,也可見食欲減退、惡心、嘔吐、便秘等;研究者對2例單次劑量給藥患者和8例多劑量給藥患者進行血液和尿液檢查,均未檢出HSV DNA,表明HSV未感染未注射區(qū)[5]。Senzer等[18]對50例不能切除的轉移性黑色素瘤患者進行的Ⅱ期臨床試驗中,共有42例(85%)患者存在毒副作用,多數(shù)為全身癥狀,其中發(fā)熱26例(52%)、寒戰(zhàn)24例(48%)、疲勞16例(32%)、惡心15例(30%)、嘔吐10例(20%)、頭痛10例(20%)、呼吸困難10例(20%);其他毒性作用則與OncoVexGM-CSF治療無關。

表2 OncoVexGM-CSF的各期臨床試驗
注:SD=完全緩解
此外,病毒復制和腫瘤細胞增殖速度的相互作用也是溶瘤病毒治療中有待攻克的難點,有學者通過大量實驗建立了兩者達到平衡的計算機模型,可以幫助選擇OncoVexGM-CSF最佳治療劑量[26]。
4 OncoVexGM-CSF的各期臨床試驗
對OncoVexGM-CSF進行的前期臨床前試驗均證實了其安全性,未出現(xiàn)病毒外溢或產(chǎn)生神經(jīng)毒性,這為后期進行更多的臨床試驗奠定了基礎。2001年開始的一項小型臨床試驗中,首次將ICP34.5基因缺失型HSV用于5例轉移性黑色素瘤患者的治療,注射劑量為103PFU/ml,其中2例患者接受了1次注射,2例患者接受了2次注射,1例患者接受了4次注射;結果顯示,1例患者在2次注射后出現(xiàn)了瘤體變平,接受了2次及以上注射的3例患者的腫瘤都有壞死現(xiàn)象[27],與早期對膠質瘤患者的研究結果相似[6]。Hu等[5]對30例難治性惡性腫瘤(乳腺癌、頭頸癌、胃腸癌、惡性黑色素瘤)患者進行的Ⅰ期臨床試驗中,將患者分為單次劑量組13例和多劑量組17例,并將OncoVexGM-CSF注射入患者表皮或皮下組織,其中單次劑量組患者分別接受106、107、108PFU/ml的OncoVexGM-CSF,多劑量組患者接受多次治療。結果顯示,患者的主要毒副作用是局部炎癥、紅斑和發(fā)熱,引起HSV血清陰性患者產(chǎn)生局部炎癥的劑量上限是107PFU/ml,多劑量組患者血清HSV轉化為陰性的劑量上限為106PFU/ml,但即使到了108PFU/ml,患者耐受性也很好;生物學活性(病毒復制、局部反應、GM-CSF表達和HSV抗原相關的腫瘤壞死)方面,OncoVexGM-CSF1次/2~3周給藥產(chǎn)生的局部反應較小,病毒復制速度也較快。在該試驗中,19例患者治療后接受了活檢,其中14例患者出現(xiàn)腫瘤壞死現(xiàn)象,壞死區(qū)域都能檢測到HSV。研究者據(jù)此認為,OncoVexGM-CSF耐受性良好,多次治療也是安全的,且抗腫瘤效果明顯。可以說,Ⅰ期臨床試驗證實了OncoVexGM-CSF的安全性和生物學活性,為后續(xù)研究擬定了劑量計劃。
Senzer等[18]進行的一項多中心Ⅱ期臨床試驗中納入了50例Ⅲc或Ⅳ期不可切除黑色素瘤患者,根據(jù)腫瘤數(shù)量和大小,OncoVexGM-CSF初始劑量為106PFU/ml,每次4 ml,3周后改為108PFU/ml,1次/2周。根據(jù)實體瘤應答評價標準(RECIST),該試驗獲得了28%(14/50)的客觀應答(即注射區(qū)和未注射區(qū)瘤體消退)率。而腫瘤免疫治療不能忽略的一個問題是其低反應性,該試驗中28%的客觀反應率高于IL-2治療的客觀反應率(10%~15%)[28]。生存率方面,患者兩年生存率為52%(26/50),且患者腫瘤微環(huán)境MART-1特異性T細胞數(shù)量在注射區(qū)和未注射區(qū)均升高。
對黑色素瘤最有效的溶瘤載體是可復制傳代并整合了GM-CSF的HSV-1,已證實OncoVexGM-CSF的體外溶瘤活性及在小鼠體內的抗瘤作用,并在Ⅰ期和Ⅱ期臨床試驗中驗證了其安全性和有效劑量。基于這些成果,OncoVexGM-CSF對黑色素瘤的Ⅲ期試驗正在進行中,但具體內容尚未報道。Ⅲ期臨床試驗最初共納入360例黑色素瘤患者,其中對照組240例,試驗組120例。Ⅲ期臨床試驗與Ⅱ期臨床試驗不同之處在于:(1)Ⅲ期臨床試驗不僅納入Ⅲc期和Ⅳ期黑色素瘤患者,還納入了Ⅲb期黑色素瘤患者;(2)伴有廣泛內臟損傷,轉移灶直徑>3 cm,骨和中樞神經(jīng)系統(tǒng)受到侵蝕或血清乳酸脫氫酶升高的患者被排除在外,因為Ⅱ期臨床試驗表明這些患者反應性較差;(3)與對照組相比,試驗組必須有10%及以上的患者在至少6個月內達到了持續(xù)的客觀應答,才認為該試驗結果為陽性;(4)對照組給予GM-CSF治療而不是安慰劑,其原因在于患者更易接受和有報道認為GM-CSF能夠延緩黑色素瘤病情發(fā)展[6]。各期臨床試驗內容及結果見表2。
5 展望
溶瘤病毒療法是一種將病毒導入瘤體的新型惡性腫瘤治療方法,在專業(yè)領域,人們最為關心的還是能否將其應用于臨床,創(chuàng)造一種微型生物學武器以特異性地殺傷瘤細胞而又不對正常組織或細胞造成損傷是腫瘤治療領域亟待攻克的難點,創(chuàng)造一種新的可復制病毒療法遠比測試已有病毒載體的治療作用更迫切。早期臨床試驗不僅證明溶瘤病毒療法是一項“有趣的”學術活動,而且其具有巨大的開發(fā)前景。
OncoVexGM-CSF代表了一種操控免疫系統(tǒng)的抗癌新療法,與直接的抗瘤細胞相比更具優(yōu)越性,不需要昂貴且耗時耗力的體外疫苗制備。Ⅰ期臨床試驗已證實了OncoVexGM-CSF的耐受性和安全性,Ⅱ期臨床試驗證實了其對不可切除的Ⅲc期及Ⅳ期黑色素瘤患者良好的客觀反應率,Ⅲ期臨床試驗結果是目前最值得期待的,且研究者有把握此試驗會成功。相信隨著研究的進一步深入及問題的逐步解決,OncoVexGM-CSF治療惡性腫瘤的安全性、有效劑量、溶瘤效果在Ⅲ期臨床試驗中的進一步驗證,OncoVexGM-CSF在惡性腫瘤治療中的作用將是未來備受矚目的焦點,有可能成為惡性腫瘤治療的分水嶺。
1 Liu R,Varghese S,Rabkin SD.Oncolytic herpes simplex virus vector therapy of breast cancer in C3(1)/SV40 T-antigen transgenic mice[J].Cancer Res,2005,65(4):1532-1540.
2 Liu RB,Martuza RL,Rabkin SD.Intracarotid delivery of oncolytic HSV vector G47 to metastatic breast cancer in the brain[J].Gene Therapy,2005,12(8):647-654.
3 Liu RB,Rabkin SD.Oncolytic herpes simplex virus vectors for the treatment of human breast cancer[J].Chinese Medical Journal,2005,118(4):307-312.
4 Tamura K,Wakimoto H,Agarwal AS.Multimechanistic tumor targeted oncolytic virus overcomes resistance in brain tumors[J].Mol Ther,2013,21(1):68-77.
5 Hu JC,Coffin RS,Davis CJ,et al.A phase Ⅰ study of OncoVexGM-CSF,a second-generation oncolytic herpes simplex virus expressing granulocyte macrophage colony-stimulating factor[J].Clin Cancer Res,2006,12(22):6737-6747.
6 Kaufman HL,Bines SD.OPTIM trial:a Phase Ⅲ trial of an oncolytic herpes virus encoding GM-CSF for unresectable stage Ⅲ or Ⅳ melanoma[J].Future Oncol,2010,6(6):941-949.
7 Aghi MK,Chiocca EA.Phase ib trial of oncolytic herpes virus G207 shows safety of multiple injections and documents viral replication[J].Mol Ther,2009,17(1):8-9.
8 Muthana M,Rodrigues S,Chen YY,et al.Macrophage delivery of an oncolytic virus abolishes tumor regrowth and metastasis after chemotherapy or irradiation[J].Cancer Res,2013,73(2):490-495.
9 Passer BJ,Cheema T,Wu S,et al.Combination of vinblastine and oncolytic herpes simplex virus vector expressing IL-12 therapy increases antitumor and antiangiogenic effects in prostate cancer models[J].Cancer Gene Ther,2013,20(1):17-24.
10 Zeng W,Hu P,Wu J,et al.The oncolytic herpes simplex virus vector G47△ effectively targets breast cancer stem cells[J].Oncol Rep,2013,29(3):1108-1114.
11 Hemminki A.Portrait of a leader in immunotherapeutics:oncolytic viruses for treatment of cancer[J].Hum Vaccin Immunother,2012,8(8):1018-1021.
12 施桂蘭,莊秀芬,韓香萍.新型溶瘤病毒oHSV2 hGM-CSF的構建及其抗腫瘤作用[J].中華腫瘤雜志,2012,34(2):89-95.
13 Cody JJ,Scaturro P,Cantor AB,et al.Preclinical evaluation of oncolytic δγ(1)34.5 herpes simplex virus expressing interleukin-12 for therapy of breast cancer brain metastases[J].Int J Breast Cancer,2012(2012):628697.
14 Friedman GK,Haas MC,Kelly VM,et al.Hypoxia Moderates γ(1)34.5-Deleted Herpes Simplex Virus Oncolytic Activity in Human Glioma Xenoline Primary Cultures[J].Transl Oncol,2012,5(3):200-207.
16 Lin YC,Mahalingam J,Chiang JM,et al.Activated but not resting regulatory T cells accumulated in tumor microenvironment and correlated with tumor progression in patients with colorectal cancer[J].Int J Cancer,2013,132(6):1341-1350.
17 施桂蘭,張叔人,劉濱磊.腫瘤微環(huán)境與炎癥反應及溶瘤病毒治療的關系[J].中國腫瘤生物治療雜志,2012,19(1):87-92.
18 Senzer NN,Kaufman HL,Amatruda T,et al.Phase Ⅱ clinical trial of a granulocyte-macrophage colony-stimulating factor-encoding,second-generation oncolytic herpesvirus in patients with unresectable metastatic melanoma[J].J Clin Oncol,2009,27(34):5763-5771.
21 Gabrilovich DI,Nagaraj S.Myeloid-derived suppressor cells as regulators of the immune system[J].Nat Rev Immunol,2009,9(3):162-174.
22 Kaufman HL,Kim DW,DeRaffele G,et al.Local and distant immunity induced by intralesional vaccination with an oncolytic herpes virus encoding GM-CSF in patients with stage Ⅲc and Ⅳ melanoma[J].Ann Surg Oncol,2010,17(3):718-730.
23 Zea AH,Rodriguez PC,Atkins MB,et al.Arginase-producing myeloid suppressor cells in renal cell carcinoma patients:a mechanism of tumor evasion[J].Cancer Res,2005,65(8):3044-3048.
24 Koga,M,Nakayama I,Sakai T,et al.Disseminated herpes simplex virus type-1 infection in long-term usage of everolimus[J].J Dermatol,2013,40(1):83-84.
25 Mace AT,Ganly I,Soutar DS,et al.Potential for efficacy of the oncolytic Herpes simplex virus 1716 in patients with oral squamous cell carcinoma[J].Head Neck,2008,30(8):1045-1051.
26 Wodarz D,Komarova N.Towards predictive computational models of oncolytic virus therapy:basis for experimental validation and model selection[J].PLoS One,2009,4(1):e4271.
27 Urdinguio RG,F(xiàn)ernandez AF,Moncada-Pazos A,et al.Immune-dependent and independent antitumor activity of GM-CSF aberrantly expressed by mouse and human colorectal tumors[J].Cancer Res,2013,73(1):395-405.
28 Bell J.Oncolytic viruses:an approved product on the horizon?[J].Mol Ther,2010,18(2):233-234.
29 Harrington K,Hingorani M,Tanay M,et al.Phase Ⅰ/Ⅱ dose escalation study of OncoVexGM-CSFand chemoradiotherapy(CRT)in untreated stage Ⅲ/Ⅳ squamous cell cancer of the head and neck(SCCHN)[J].J Clin Oncol,2009,27(15 Suppl):6018.

