甲基多巴透過POPC磷脂雙層膜過程的分子動力學模擬
卞富永 張繼偉 王 丹 徐四川,*
(1云南大學化學科學與工程學院,自然資源藥物化學教育部重點實驗室,昆明650091;2楚雄醫藥高等專科學校,云南楚雄675005)
1 引言
高血壓病是一種常見的多發病,致殘率和致死率都較高,嚴重危害人類健康.1-3造成高血壓疾病的主因是心排血量的減少和外周血管阻力增大,存在著復雜的增大血壓的發病機制.4,5針對不同的發病機制,目前已開發了四類藥物治療高血壓病:6第一類是噻嗪類利尿劑,是通過利尿作用減少人體內鈉的總量,促使血管舒張的藥物;7-9第二類是腎上腺素能神經阻斷藥物,分為α-腎上腺素能神經阻斷劑和β-腎上腺素能神經阻斷劑,10-15分別治療原發性高血壓病和伴有腎病的糖尿病患者的高血壓病;第三類是鈣離子通道阻斷劑,抑制減少鈣離子通過鈣離子通道進入細胞,促使血管舒張;9第四類是血管緊張素轉化酶抑制劑,通過血管舒緩激肽調解血管平滑肌細胞生長過程中內皮素的減少和前列腺環素血管舒展物質的釋放,增大纖維蛋白的溶解性治療高血壓病.16顯然,由于高血壓發病機制的復雜性,和高血壓病高致殘率和高致死率的狀況,研究目前臨床藥物的理化性質,用于開發副作用小且更有效的新藥物治療高血壓病,是一項重要的熱點前沿研究課題.5,15
甲基多巴(圖1)是具有旋光性的多巴類物質,通過阻斷中樞神經系統的腎上腺素能神經,作為降血壓藥物,應用于臨床已經多年.17,18甲基多巴(左旋體)的藥理機制是通過血腦屏障,19-21在中樞神經細胞系統中脫羧和β-羥化轉變為α-甲基去甲腎上腺素,22,23然后激動中樞α受體,增強抑制性神經元的機能,導致外周交感功能抑制,外周血管阻力降低而使得血壓下降.類似于其它的降血壓藥物,甲基多巴也產生一些嚴重的副反應包括眩暈、嗜睡、疲乏、嘔吐等.因為只有甲基多巴進入細胞內才可能發揮藥效性能,為了理解甲基多巴的藥效性能和副作用,需要研究甲基多巴透過細胞膜的能力和在細胞膜中間層擴散運動等重要的基本理化性質.24,25
甲基多巴是外源分子,沒有專門的轉運蛋白運輸該分子透過細胞膜進入細胞內.甲基多巴只能依賴本身分子特性和能力透過細胞膜.甲基多巴透過細胞膜的特性能力可采用其透過細胞膜過程的自由能變化來表征.粒子透過細胞膜過程的自由能變化值可以通過分子模擬或者通過實驗測定方法獲得.目前,已有很多文獻26-37報導采用分子動力學平均力勢(PMF)方法和卵磷脂脂質分子生物膜,模擬研究粒子透過細胞膜的自由能結果與實驗測定的結果非常一致.我們采用分子動力學PMF方法,已經成功模擬研究了多巴胺透過1-棕櫚酰-2-油酰-卵磷脂(POPC)卵磷脂脂質分子雙層膜過程的動力學,38獲得與實驗觀察相一致的結果.在本文中,我們同樣使用卵磷脂脂質分子POPC雙層膜模擬分子生物膜,運用Gromacs程序中傘形樣本和分子動力學PMF方法,研究獲得甲基多巴透過卵磷脂脂質分子雙層膜的自由能變化;探討甲基多巴透過細胞膜的能力和在細胞膜中間層擴散運動的特性,加深理解甲基多巴的物化性質和治療高血壓病的機制.
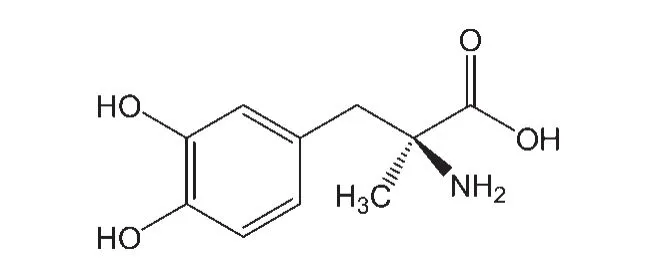
圖1 左旋甲基多巴(MD)分子結構Fig.1 Molecular structure of α-methyldopa(MD)
2 材料與方法
2.1 POPC磷脂雙層膜結構與分子模擬
POPC分子是一種卵磷脂脂質分子,39在生物膜中這是一類最普遍的磷脂酰膽堿分子.在POPC尾端中含有未飽和的碳碳雙鍵,使分子具有一定的剛性,與飽和尾端磷脂脂質分子相比,被優先選用模擬生物細胞膜,40,41各類相關研究工作42-55已經被大量發表.我們采用的POPC-水模型,含有128個POPC分子,是被兩層SPC模型56,57水相包圍的POPC雙層膜,其結構已經表征.40
本研究的實驗方法與我們報道的多巴胺體系38中所采用的方法相同.為了便于閱讀,一些研究步驟重復敘述在本文中.首先采用Gromacs 4.5程序58-60中editconf指令,使POPC-水模型結構中心和甲基多巴分子結構中心都坐落在原點坐標(X=0,Y=0,Z=0)上.通過合并它們的原子坐標,形成新的三組分復合物(POPC-H2O-MD).在該復合物中,甲基多巴的部分原子坐標可能與POPC原子坐標重疊,造成不合理的結構接觸,可以通過Gromacs程序中分子動力學模擬em(energy minimization)優化步驟來解除.然后采用Gromacs程序,在POPC膜-水-MD模型兩層水相加上更多的SPC模型水分子,使體系共有8851個水分子,另外還包括128個POPC分子和一個甲基多巴分子.
為設定甲基多巴分子力場參數,采用Gaussian 03程序61中的B3LYP/6-31G(d,p)方法優化甲基多巴分子幾何數據(幾何數據通過內坐標書寫).基于優化的甲基多巴分子結構,采用prodrg程序62(網址:http://davapc1.bioch.dundee.ac.uk/)獲得甲基多巴分子力場參數的基本數據,再根據gmx(Gromos96)力場格式59寫出甲基多巴分子力場參數(見Supporting Information).在圖S1中,基于甲基多巴分子結構特點,我們采用雙離子分子形式構建甲基多巴分子力場參數,因為在生物體系中和在中性酸堿度條件下,這種雙離子分子形式更容易存在.在我們以前的工作38,63,64中,使用該常用的構建分子力場參數方法都取得了與各種實驗結果非常一致的結果.POPC分子力場參數來自文獻數據,40改寫使之與gmx力場格式相一致.
POPC-H2O-MD體系應用Gromacs 4.5程序模擬研究,模擬結果采用VMD程序65顯現和分析.模擬參數設定類似于我們以前工作的參數,38應用周期邊界條件,步長2 fs.先用最陡下降法進行4萬步能量優化.其次,在允許水分子移動情況下,甲基多巴和POPC分子采用LINCS算法66約束進行200 ps模擬,期間在標準壓力條件下,采用Berendsen耦合溫度方式,溫度從0 K逐漸上升到310 K.然后,去掉約束,對整個體系進行5 ns模擬,每2 ps輸出模擬體系的結果,模擬過程中保持溫度37°C(310 K),101325 Pa(1個大氣壓)的恒壓.采用1 nm的截斷半徑進行范德華相互作用計算,采用PME方法計算長程靜電作用力.67,68其它一些分子模擬參數采用Gromacs 4.5程序常用設定的數值.69能量分組為MD、POPC和SOL(即H2O),運用Gromacs程序分析均方根差(RMSD)測定體系的穩定性.
2.2 甲基多巴透過POPC磷脂雙層膜軌跡和自由能勢能面
本工作基于Gromacs 4.5學術版本中的傘形樣本(umbrella sampling)方法和分子動力學PMF方法,58模擬甲基多巴在POPC磷脂雙層膜中間層擴散和透過軌跡,計算其自由能勢能面.軌跡起點研究體系是上述分子模擬優化的結構體系.所需要的甲基多巴軌跡動力學模擬體系的拓撲文件與POPC磷脂雙層膜結構模擬的拓撲文件相同.另外還需要構建一個軌跡模擬參數文件:模擬步長2 fs,步數500000,每1 ps輸出一個體系結構構象,模擬溫度37°C,能量分組為MD、POPC和SOL,周期邊界條件,軌跡方向設定為XZ和Y方向,最大的施加力為1000 kJ?mol-1,甲基多巴最大運動速度為10 nm?ns-1,另外一些力場參數與前面的體系模擬參數相同.設定甲基多巴為體系的運動組.參考體系組則根據軌跡運動方向的反方向確定一個合適的POPC磷脂分子中某個原子作為參考系.XZ軸方向參考系是第83號磷脂分子中第46號原子(POPC83:C46),Y軸方向參考系是第32號磷脂質分子中第46號原子(POPC32:C46).運動組和參考體系的信息需要另外一個文件稱之為指針文件單獨給定.輸入上述文件,在云南大學高性能計算中心計算機上并行計算.計算輸出的結果就是甲基多巴在POPC磷脂雙層膜中間層擴散和透過軌跡的數據文件.然后,從模擬獲得的甲基多巴在POPC磷脂雙層膜中間層擴散和透過軌跡的文件中,取出體系構象文件.基于運動組和參考體系最小質心距離作為起點,根據運動組和參考系質心間隔距離增加0.05 nm規則,從1000個構象文件中挑選出相對應的傘形樣本體系,用于傘形樣本模擬計算.傘形樣本模擬計算輸入的文件分別是挑選出來的傘形樣本文件,前面所采用的拓撲文件和指針文件,以及另外設定一個傘形樣本模擬參數文件.傘形樣本模擬參數與軌跡模擬參數基本上相同,只是運動速度設定為0 nm?ns-1,表明甲基多巴分子不在軌跡上運動,而是在給定的兩個組結構質心距離上,做分子動力學模擬達到再平衡,模擬步數設定為300000(600 ps),采用RMSD測定體系平衡穩定性.在穩定的系列傘形樣本體系基礎上,采用Gromacs 4.5程序中的加權柱狀圖分析(WHAM)方法,70把有偏采樣的結果轉換為無偏采樣的統計結果,從系列傘形樣本模擬結果中計算出平均力勢(PMF).PMF即為自由能勢能面,基于該自由能勢能面,可以計算出自由結合能的變化(ΔGbind).通過Gromacs 4.5程序中g_wham指令調用WHAM方法,計算及輸出PMF數據.使用PMF數據作圖,獲得自由能勢能面,即PMF圖形結果.通過g_wham程序,還輸出柱狀圖型數據.柱狀圖型結果可以顯示傘形樣本重疊程度,較好的重疊說明通過g_wham方法計算的自由能勢能面具有可靠性.
3 結果與討論
3.1 POPC磷脂雙層膜結構分子動力學模擬
在三組分復合物(POPC-H2O-MD)中,最初甲基多巴分子處在雙層膜的中間.通過5 ns分子動力學模擬,圖2中,采用VMD程序中的VDM方式顯示甲基多巴分子還是處在雙層膜中心區,只是稍稍偏離了中心位置.甲基多巴分子結構(圖1)中既有極性基團又有非極性基團,非極性基團與POPC磷脂非極性部分相互作用,盡可能使該分子處在雙層膜中心區.
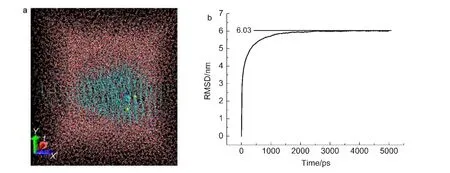
圖2 (a)5 ns分子動力學模擬的POPC-H2O-MD體系結構圖;(b)POPC-H2O-MD體系主鏈的RMSD隨分子動力學模擬時間變化曲線Fig.2 (a)Structure of POPC-H2O-MD membrane obtained by 5 ns molecular dynamics simulation;(b)root mean square deviation(RMSD)vs simulation time within 5 ns for POPC-H2O-MD membrane backbone
圖2中體系總的RMSD數據顯示,通過5 ns分子動力學模擬,POPC-H2O-MD三組分體系趨向于穩定.該體系各個組成體系的RMSD隨模擬時間變化曲線列在圖S2中.從分子模擬角度來看,這些RMSD數值表明該體系達到了穩定平衡.該體系穩定平衡所需要模擬時間比較短,是因為POPC分子屬長條型結構,比較柔軟容易被優化,而且該體系的主體結構,被水相包圍POPC雙層膜結構,本身是一個平衡體系.
上述分子模擬優化的三組分穩定平衡體系,作為研究甲基多巴在POPC磷脂雙層膜中間層擴散和透過運動軌跡的起點結構體系.
3.2 甲基多巴在POPC磷脂雙層膜中間層擴散和透過運動軌跡
基于POPC磷脂雙層膜具有對稱性的結構特點,我們主要研究分子在一個單層運動,分子在雙層膜另外一個單側層運動應具有相似的結果.在一些文獻所報道的工作中,也是采用該方式,即研究具有對稱性的膜結構的體系,側重研究分子在磷脂一個單側層運動軌跡.71-73根據甲基多巴分子在細胞膜中運動軌跡所模擬方向的特點(圖3),我們研究了沿著Y軸和XZ軸方向甲基多巴分子運動軌跡.沿著Y軸方向的軌跡,用于模擬甲基多巴分子垂直于生物膜表面透過過程,而在POPC磷脂雙層膜內,則模擬甲基多巴平行于POPC磷脂分子長條形方向擴散.沿著XZ軸方向的軌跡,用于模擬甲基多巴分子垂直于POPC磷脂分子擴散運動,并且通過斜著方式透過POPC磷脂雙層膜,模擬甲基多巴斜著透過生物膜表面過程.由于生物膜可以是球體結構,甲基多巴分子可能采取與生物膜表面傾斜的方式透過.
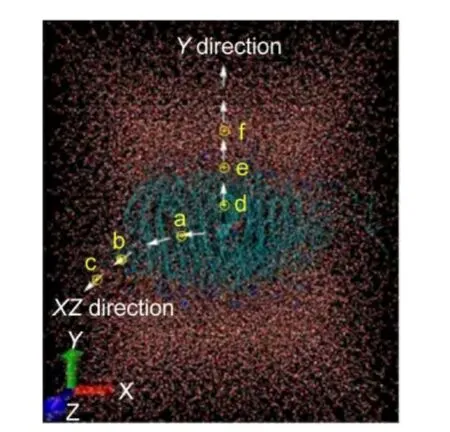
圖3 甲基多巴在POPC磷脂雙層膜中分別沿XZ軸和Y軸方向擴散和透過運動軌跡圖Fig.3 Picture of tracks for methyldopa to diffuse within and permeate through the POPC phospholipid bilayer membrane along XZ andYcoordinate directions respectively
使甲基多巴分子在磷脂雙層膜中運動產生軌跡需要一個外力.本研究設定外力最大值是1000 kJ?mol-1,而實際體系則根據甲基多巴周圍情況,能提供小于1000 kJ?mol-1合適的外力,使甲基多巴分子運動,產生運動軌跡.另外還需要一個參考組,作為給外力的支點.在XZ軸方向上,采用編號為83的磷脂分子中46號碳原子作為參考系(即POPC83:C46,83是指磷脂分子的編號,46是該碳原子在磷脂分子中的編號).圖2中,VDM顯示C46位于甲基多巴的右側.C46質心與甲基多巴分子質心起始點距離約為0.66 nm.C46與甲基多巴分子處在同一層,開始施加一個外力場,甲基多巴沿著XZ軸水平方向在POPC磷脂雙層膜中間層做橫向擴散運動,一直到質心距離約為2.60 nm(表1),在圖3中a點,明顯發生拐彎現象.當繼續施加外力場時,到質心距離約為5.66 nm時(表1),即圖3中b點,甲基多巴剛好透過POPC磷脂雙層膜進入外圍水體系.當質心距離為6.01 nm時,約在圖3中c點,甲基多巴已經斜向透過POPC磷脂雙層膜.
在Y軸方向上,參考系是編號為32磷脂分子中46號碳原子(POP32:C46).圖2中,VDM顯示該碳原子(C46)處在甲基多巴分子的正下方.由于C46原子處在第32號磷脂分子中,具有承受外力作用下其質心相對不易變化的性質,因此使用該參考系比較容易控制甲基多巴沿著Y軸方向移動.在Y軸方向,甲基多巴質心與參考系質心最初距離約為0.46 nm.施加一個外力場,甲基多巴先是在POPC磷脂雙層膜中間層做擴散運動,一直到質心距離約為2.70 nm(表2),即圖3中d點.甲基多巴在Y軸方向上的運動是直線的,沒有發生拐彎.但是,可以采用VMD程序顯現和分析甲基多巴運動軌跡,研究甲基多巴所處的磷脂膜非極性和極性區域,盡管它們沒有嚴格的區分界限,并且結合在軌跡坐標上甲基多巴的自由能變化數值,可以確定和分辨出甲基多巴在磷脂膜空間擴散和透過運動.繼續施加外力場,到質心距離約為4.95 nm時,即圖3中e點,甲基多巴處于透過POPC磷脂雙層膜中的磷酸根和甘油區域,質心距離到5.15 nm時,即圖3中f點,甲基多巴完全透過POPC磷脂雙層膜進入到外圍的水相中.
3.3 甲基多巴運動軌跡上的傘形樣本選定
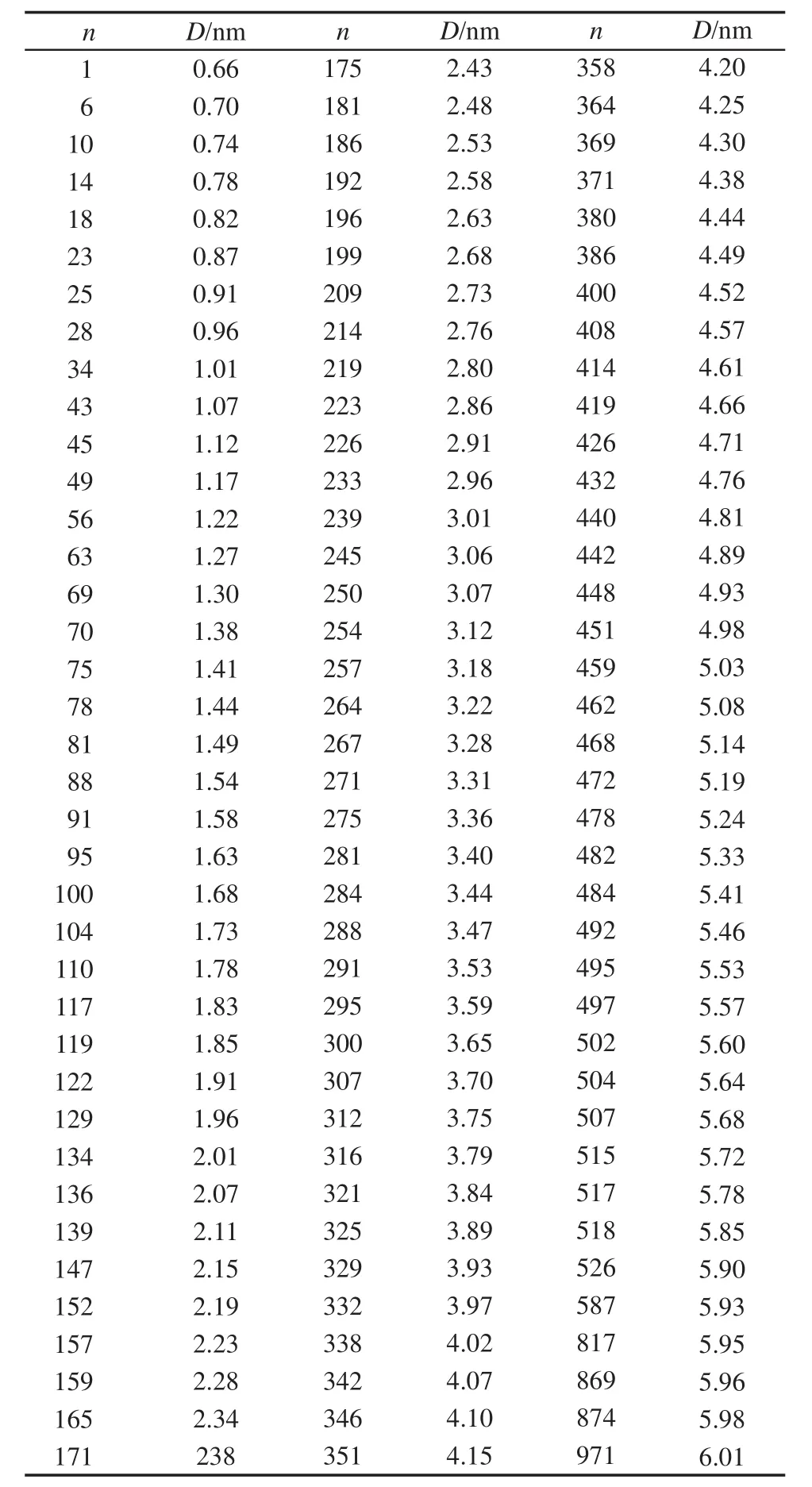
表1 根據質心距離等間隔增加0.05 nm,從甲基多巴沿著XZ軸方向透過POPC磷脂雙層膜軌跡文件中挑選出的傘形樣本Table 1 Umbrella samplings chosen according to the interval distance of 0.05 nm added between moving and reference groups in the sampling from the track file recorded for methyldopa to pass through the POPC phospholipid bilayer membrane along the XZ direction
由于外界給力使得甲基多巴運動,不僅造成了甲基多巴分子結構會發生一定程度的變形,而且使雙層膜體系也偏離了平衡.因此,需要開展傘形樣本的模擬計算,限定運動組和參考體系質心距離,使甲基多巴分子和雙層膜體系重新平衡.在甲基多巴透過POPC磷脂雙層膜軌跡文件中,XZ和Y軸方向上都保存了1000個軌跡點構象數據,不需要全部用來做傘形樣本分子模擬計算.1000個軌跡點構象數據對應于1000 ps分子模擬時長,每1 ps保留一個軌跡點構象數據.所以樣本編號(n)與軌跡模擬時長(單位為ps)相對應.使用軌跡點構象數據,可以計算出不同編號樣本中,參考系質心與運動組質心距離(D).甲基多巴分子不僅有平動還有轉動,參考系的原子也隨著分子動力學模擬進程而運動,參考組與運動組質心距離出現不規則(表1和表2).因此按照甲基多巴運動系與參考系質心距離等間隔增加約0.05 nm規則,挑選傘形樣本,用于分子動力學模擬實現再平衡.
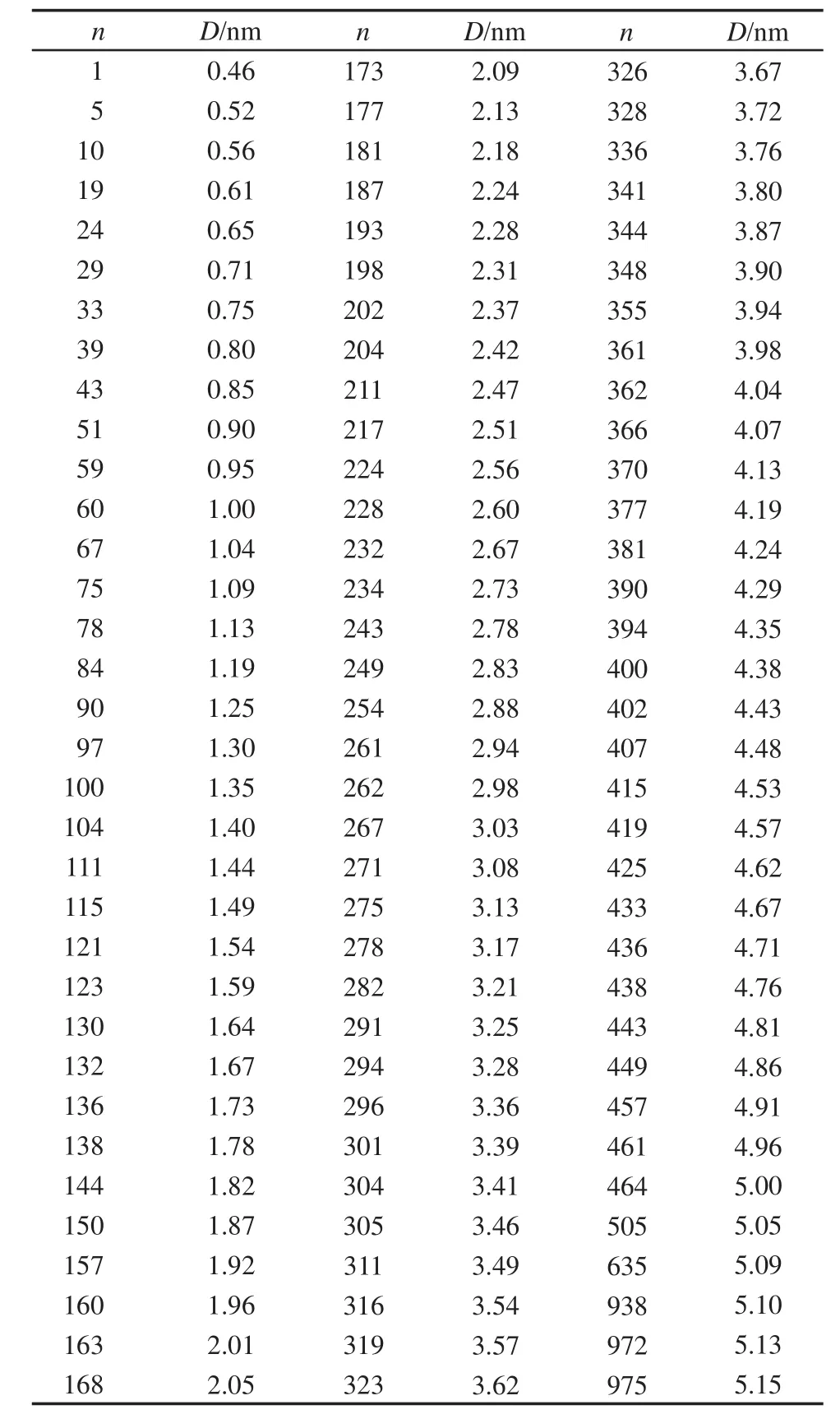
表2 根據質心距離等間隔增加0.05 nm,從甲基多巴沿著Y軸方向透過POPC磷脂雙層膜軌跡文件中挑選出的傘形樣本Table 2 Umbrella samplings chosen according to the interval distance of 0.05 nm added between moving and reference groups in the sampling from the track file recorded for methyldopa to pass through the POPC phospholipid bilayer membrane along the Y direction
表1是從XZ軸方向的軌跡文件中挑選出來的傘形樣本,分成三部分,從0.66到2.63 nm是甲基多巴在POPC磷脂雙層膜中間層的橫向擴散運動;質心距離從2.63到5.68 nm,是甲基多巴沿XZ軸方向傾斜著透過POPC磷脂雙層膜過程;質心距離從5.68到6.01 nm是甲基多巴在POPC磷脂雙層膜外的水相中的運動情況.在跨膜區,質心距離變化比較大,即使是相鄰的傘形樣本,質心距離變化也會大于0.05 nm,因為在該區域,甲基多巴分子不僅有平動而且還有比較大的轉動,因此質心距離間隔變化比較大.而且參考系的原子也隨著分子動力學進程而運動,因此與運動組質心距離出現不規則.
表2是Y軸方向上挑選出來的傘形樣本,也是分成3個部分.質心距離從0.46到2.73 nm為甲基多巴分子在POPC磷脂雙層膜中間層縱向擴散;質心距離從2.73到4.96 nm為甲基多巴分子正沿著Y軸方向跨POPC磷脂雙層膜過程,質心距離從4.96到5.15 nm為甲基多巴分子在POPC磷脂雙層膜外的水相中的運動情況.
3.4 甲基多巴在POPC磷脂雙層膜中間擴散和透過過程的自由能
在XZ軸方向,挑選了114個傘形樣本,用于分子模擬,分別限定運動組和參考組在固定的質心距離上,使體系重現平衡.由于做很多樣本分子模擬計算,需要設置合適的模擬步數.通過研究發現,分子模擬步數設為30萬即模擬時間為600 ps,就能夠使體系重新達到平衡狀態.其中,選擇了2個傘形樣本,樣本181是甲基多巴沿XZ軸方向擴散運動時開始拐彎的點,樣本517是甲基多巴透過了POPC磷脂雙層膜之后在水相中運動的樣本.這兩個樣本受到外力場都比較大,體系偏離平衡程度相對比較大.圖4a中,從579到600 ps之間,樣本181體系的RMSD一直保持在5.45與5.46 nm之間.圖4b中,從584到600 ps之間,樣本517體系的RMSD一直保持在5.42與5.41 nm之間.數值說明通過30萬步分子模擬,都實現了樣本體系的重新平衡.在做甲基多巴軌跡過程中,施加了外力,使體系偏離了平衡,應該是局部不平衡,所以只需要比較短的時間模擬,就使得樣本體系重新平衡.其它樣本體系的RMSD結果類似(圖形數據沒有給出).
在Y軸方向上,挑選了102個傘形樣本,用于分子模擬,重新實現平衡.模擬步數也是設定為30萬步.其中,選擇了兩個樣本,樣本202和443是甲基多巴在POPC磷脂雙層膜中擴散和即將透過的樣本,體系偏離平衡程度相對比較大.圖4c中,從580到600 ps之間,樣本202體系的RMSD一直保持在5.42與5.43 nm之間.圖4d中,從576到600 ps之間,樣本443體系的RMSD一直保持在5.45與5.44 nm之間.數值也說明通過30萬步分子模擬,都實現了樣本體系重新平衡.其它樣本體系的RMSD結果也相似(圖形數據沒有給出).
盡管在兩條軌跡上挑選了很多傘形樣本用于分子模擬計算,實現樣本再平衡,但是還是屬于有偏采樣的結果.因此,需要通過WHAM方法,即加權柱狀圖統計分析法,把有偏采樣的系列傘形樣本模擬計算結果轉化為無偏采樣的統計結果,描繪出自由能勢能面.圖5是基于系列重新平衡的樣本體系,通過統計計算和繪制的甲基多巴沿著XZ軸方向在POPC磷脂雙層膜中擴散和透過過程自由能勢能面,和在反應坐標上的傘形樣本加權柱狀圖(數據沒有給出).傘形樣本加權柱狀圖顯示,樣本窗口有比較好的緊密程度,表示重疊性好,因此取得比較好的自由能變化曲線.從原點(o點)到a點,可以看成甲基多巴沿著XZ軸方向橫向擴散過程,自由能變化值在27.7 kJ?mol-1(310 K)之內.從a點到b點,是甲基多巴沿著XZ軸方向連續不斷的斜著透過POPC磷脂膜,需要的自由能變化為343.9 kJ?mol-1(310 K).圖5中的b點體系軌跡結構圖顯示甲基多巴已經透過了POPC磷脂膜.

圖4 四個傘形樣本RMSD隨模擬時間變化曲線Fig.4 RMSD vs simulation time for four umbrella samples
圖6是甲基多巴沿著Y軸方向,在POPC磷脂雙層膜中擴散及其透過過程的自由能變化曲線,和該反應坐標上的傘形樣本加權柱狀圖.傘形樣本加權柱狀圖顯示樣本窗口也具有很好的重疊性,因此也取得了比較好的自由能變化曲線.甲基多巴沿著Y軸方向在POPC磷脂雙層膜中間層縱向擴散運動,最初質心距離是0.46 nm,但是統計的開始距離是0.32 nm,出現統計的質心間隔距離稍微前移現象.該現象也出現在XZ軸方向的統計結果中.從距離0.32到2.70 nm,即圖6中從原點(o點)到d點,體系軌跡結構圖顯示,甲基多巴沿著Y軸方向在POPC磷脂雙層膜中間做縱向擴散運動,自由能變化為16.9 kJ?mol-1(310 K),說明甲基多巴在磷脂雙層膜中間更容易縱向擴散.POPC磷脂是長條形狀,甲基多巴順著長條形狀磷脂分子應該是更容易擴散.甲基多巴運動到間隔距離為4.90 nm時(即圖6中e點)的體系軌跡結構圖顯示,甲基多巴已經透過POPC磷脂雙層膜.也就是說,從d點到e點,是甲基多巴沿著Y軸方向連續不斷的透過POPC磷脂膜,需要自由能變化為99.9 kJ?mol-1(310 K),數值證明甲基多巴分子沿著Y軸方向確實具有能力透過POPC磷脂雙層膜.當甲基多巴運動到間隔距離是4.90 nm時(即e點)的體系軌跡結構圖,大約是樣本457對應于457 ps運動軌跡時間,確實已經處在了水相之中,但是由于邊界條件限制,甲基多巴分子沒有運動到更遠的間隔距離,所以在圖6中PMF圖形上端端部只出現一個小平臺.
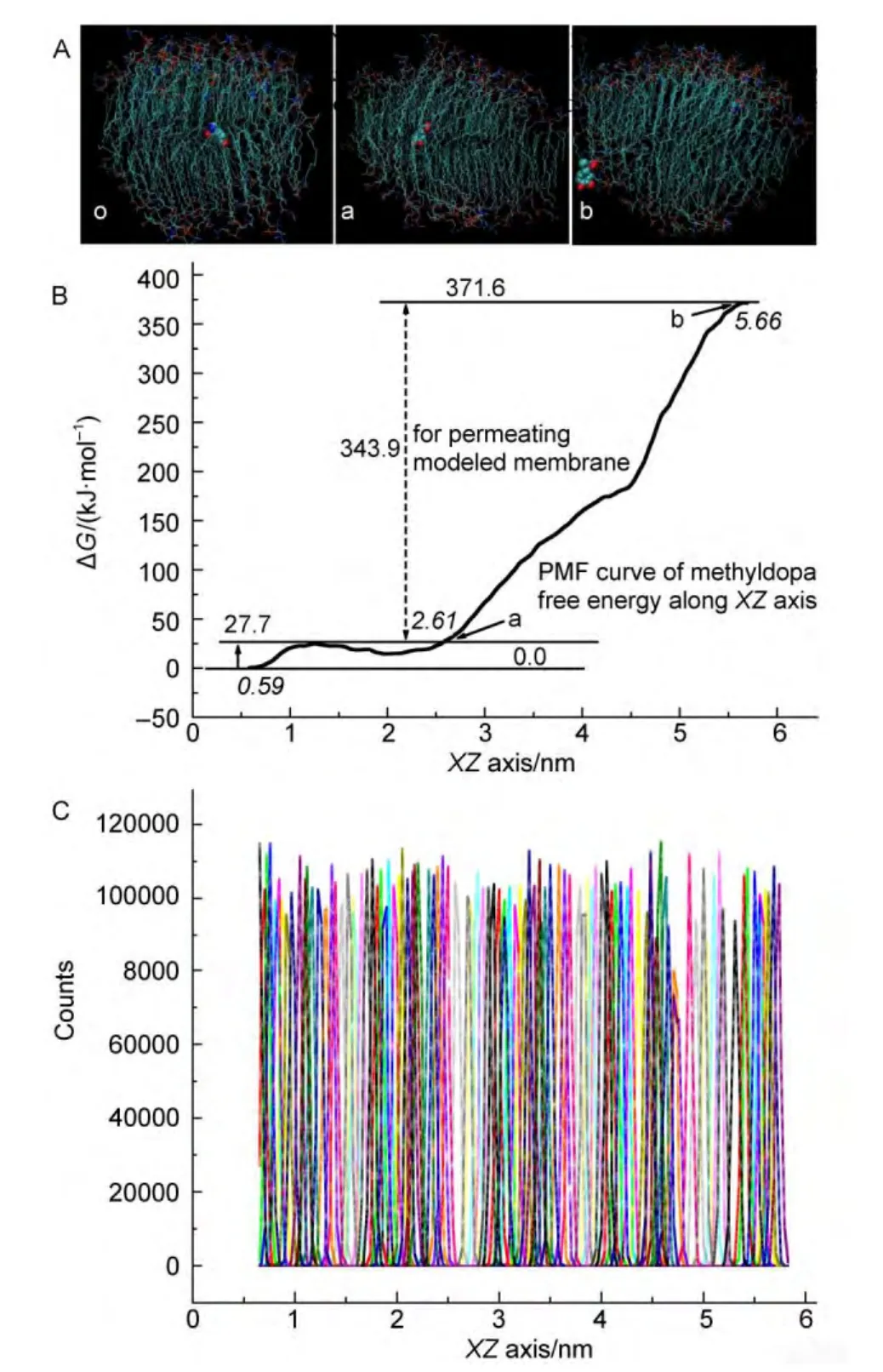
圖5 (A)甲基多巴體系軌跡結構圖(不包括水相);(B)甲基多巴沿著XZ軸方向透過POPC磷脂雙層膜自由能變化(PMF)以及(C)采用WHAM方法獲得的XZ反應坐標上的加權柱狀圖Fig.5 (A)Methyldopa structural figures of system tracks(not including water phase);(B)PMF for methyldopa along the XZ direction to pass through the POPC phospholipid bilayer membrane;(C)the histograms of umbrella samplings along the XZ reaction coordinates obtained by WHAM algorithm
根據POPC磷脂雙層膜對稱性特點,在體系軌跡雙層膜結構中間部位d點,甲基多巴分子從另外一層磷脂膜,沿著負Y軸方向,連續不斷的透過POPC磷脂膜,也應該需要自由能變化為99.9 kJ?mol-1.因此,甲基多巴分子從POPC磷脂雙層膜外透過該雙層膜到達磷脂膜內,應該需要克服的自由能能壘為99.9 kJ?mol-1.
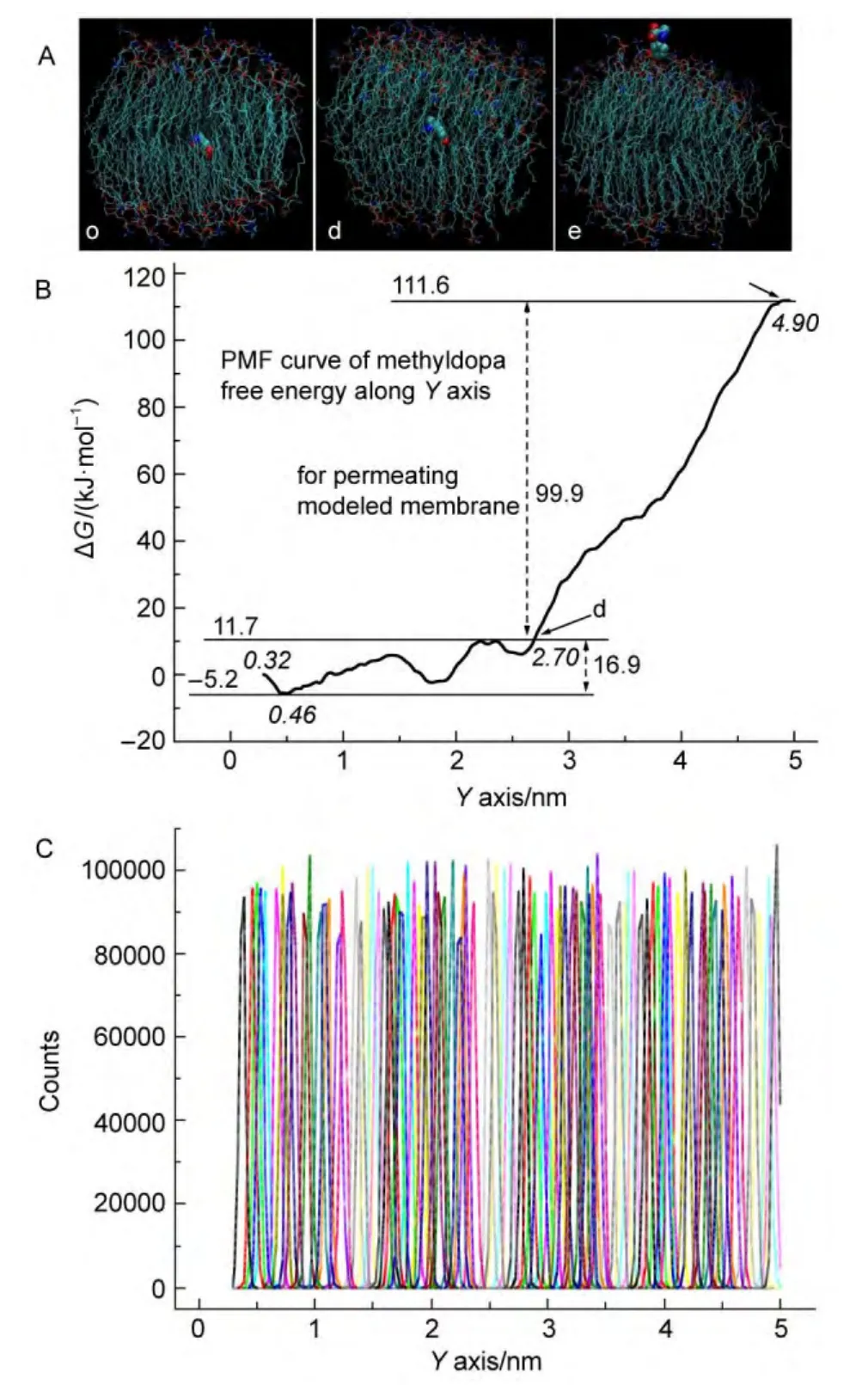
圖6 (A)甲基多巴體系軌跡結構圖(不包括水相);(B)甲基多巴沿著Y軸方向透過POPC磷脂雙層膜自由能變化(PMF)以及(C)采用WHAM方法獲得的Y反應坐標上的加權柱狀圖Fig.6 (A)Methyldopa structural figures of system tracks(not including water phase);(B)PMF for methyldopa along the Y direction to pass through the POPC phospholipid bilayer membrane;(C)the histograms of umbrella samplings along the Y reaction coordinates obtained by WHAM algorithm
在最近文獻報道的工作中,采用PMF方法計算Na+-Cl-離子對、Cl-和Na+透過卵磷脂脂質分子生物膜的自由能壘分別是115.9、99.1和92.0 kJ?mol-1,36而實驗測得Cl-和Na+透過磷脂酰絲氨酸衍生物膜的自由能壘分別是(98.7±11.3)和(87.4±1.7)kJ?mol-1,37分子模擬結果與實驗測定結果具有很好的一致性.同樣基于卵磷脂脂質分子生物膜,通過分子動力學模擬甲基多巴縱向透過卵磷脂脂質分子生物膜的自由能壘與Cl-離子透過的自由能壘數值相近,說明甲基多巴類似于Cl-離子應該具有透過細胞膜的能力.但是,在生物體內,大量轉運Cl-和Na+,需要通過離子運輸蛋白通道來完成.而甲基多巴透過細胞膜只能通過濃度梯度來完成克服自由能能壘為99.9 kJ?mol-1的細胞膜阻力,使得大量的甲基多巴分子不容易透過細胞膜,造成甲基多巴不能充分發揮藥效作用,并且產生各種各樣的副作用.
4 結論
基于卵磷脂脂質分子生物膜,通過分子動力學模擬獲得甲基多巴在雙層膜中間區域擴散運動的自由能壘為16.9-27.7 kJ?mol-1(310 K),證明甲基多巴分子在細胞膜中間層很容易擴散.甲基多巴縱向透過卵磷脂脂質分子生物膜的自由能壘是99.9 kJ?mol-1(310 K),說明甲基多巴應該具有透過細胞膜的能力.但是,由于甲基多巴是通過濃度梯度透過細胞膜,上述甲基多巴透過細胞膜的自由能壘使得一定比例的甲基多巴分子不能透過細胞膜,可造成多種副作用,與該藥物臨床表現相吻合.
致謝:云南大學高性能計算中心提供分子模擬計算工作的支持.
Supporting Information:The molecular dynamics force field parameters ofα-methyldopa(MDP)and more RMSDs for POPCH2O-MD membrane,water(H2O),MD,POPC and POPC-MD backbones are included.This information is available free of chargeviathe internet at http://www.whxb.pku.edu.cn.
(1) Swift,P.A.;Macgregor,G.A.Journal of Renin-Angiotensin-Aldosterone System2002,3,103.doi:10.3317/jraas.2002.010
(2)Chobanian,A.V.;Bakris,G.L.;Black,H.R.;Cushman,W.C.;Green,L.A.;Izzo,J.L.;Jones,D.W.;Materson,B.J.;Oparil,S.;Wright,J.T.;Roccella,E.J.Hypertension2003,42,1206.doi:10.1161/01.HYP.0000107251.49515.c2
(3)Vedin,J.A.;Wilhelmsson,C.E.Werko,L.Brit.Heart J.1973,35,1285.doi:10.1136/hrt.35.12.1285
(4) Dollery,C.T.;Harington,M.;Hodge,J.V.Brit.Heart J.1963,25,670.doi:10.1136/hrt.25.5.670
(5)Bosworth,H.B.;Olsen,M.K.;Oddone,E.Z.Am.Heart.J.2005,149(5),795.
(6)Arauz-Pacheco,C.;Parrott,M.A.;Raskin,P.Diabetes Care2002,25,134.doi:10.2337/diacare.25.1.134
(7) Lant,A.Drugs1986,31(4),40.
(8) Bissoli,N.S.;Vasqufz,E.C.;Cabral,A.M.Pharmacol.Res.1996,33,47.doi:10.1006/phrs.1996.0008
(9) Warram,J.H.;Laffel,L.M.;Valsania,P.;Christlieb,A.R.;Krolewski,A.S.Arch Intern.Med.1991,151(7),1350.doi:10.1001/archinte.1991.00400070114014
(10) Langer,S.Z.;Cavero,I.;Massingham,R.Hypertension1980,2,372.doi:10.1161/01.HYP.2.4.372
(11) Pollare,T.;Sithell,H.;Selnius,J.;Berne,C.Diabetologia1988,31,415.doi:10.1007/BF00271585
(12) Hansson,L.;Lindhol,L.H.;Niskanen,L.;Lanke,J.;Hedner,T.;Niklason,A.;Luomanmaki,K.;Dahlof,B.;de Faire,U.;Molin,C.;Karlberg,B.;Wester,P.O.;Bjorck,J.E.Lancet1999,353,611.doi:10.1016/S0140-6736(98)05012-0
(13) Brown,M.J.;Palmer,C.R.;Castaigne,A.;de Leeuw,P.W.;Mancia,G.;Rosenthal,T.;Ruilope,L.M.Lancet2000,356,366.doi:10.1016/S0140-6736(00)02527-7
(14) Hansson,L.;Hedner,T.;Lund-Johansen,P.;Kjeldsen,S.E.;Lindholm,L.H.;Syvertsen,J.O.;Lanke,J.;de Faire,U.;Dahlof,B.;Karlberg,B.Lancet2000,356,359.doi:10.1016/S0140-6736(00)02526-5
(15)Lagunin,A.A.;Gomazkov,O.A.;Filimonov,D.A.;Gureeva,T.A.;Dilakyan,E.A.;Kugaevskaya,E.V.;Elisseeva,Y.E.;Solovyeva,N.I.;Poroikov,V.V.J.Med.Chem.2003,46,3326.doi:10.1021/jm021089h
(16) Ferrari,R.;Ceconi,C.;Curello,S.;Pepi,P.;Mazzoletti,A.;Visioli,O.Cardiovasc.Drugs.Ther.1996,10,639.doi:10.1007/BF00052511
(17) Luke,R.G.;Kennedy,A.C.Br.Med.J.1964,4(1),27.
(18) Johnson,P.;Kitchin,A.H.;Lowther,C.P.;Turner,R.W.Br.Med.J.1966,1,133.doi:10.1136/bmj.1.5480.133
(19) Iliodromiti,S.;Mackenzie,F.;Lindsay,R.S.Drug Notes2010,27(4),166.
(20) Mancia,G.;Ferrai,A.;Gregorin,L.J.Am.Cardiol.1980,46(5),1237.
(21) Webster,J.;Jeffers,T.A.;Galloway,D.B.;Petrie,J.C.;Barker,N.P.Br.Med.J.1977,8(1),76.
(22) Bobik,A.;Jennings,G.;Jackman,G.;Oddie,C.;Korner,P.Hypertension1986,8,16.doi:10.1161/01.HYP.8.1.16
(23) Freed,C.R.;Wang,C.H.;U2Prichcrd,D.C.Hypertension1984,6,II34.
(24) Robertson,D.;Tung,C.S.;Goldberg,M.R.;Hollister,A.S.;Gerkens,J.F.;Oates,J.A.Hypertension1984,6,45.
(25) Korner,P.I.;Head,G.A.;Bobik,A.;Badoer,E.;Aberdeen,J.A.Hypertension1984,6,63.
(26) Marrink,S.J.;Berendsen,H.J.C.J.Phys.Chem.1994,98,4155.doi:10.1021/j100066a040
(27) Marrink,S.J.;Jaehnig,F.;Berendsen,H.J.C.Biophys.J.1996,71,632.doi:10.1016/S0006-3495(96)79264-0
(28) Zahn,D.;Brickmann,J.Chem.Phys.Lett.2002,352,441.doi:10.1016/S0009-2614(01)01437-3
(29)Bemporad,D.;Essex,J.W.;Luttmann,C.J.Phys.Chem.B2004,108,4875.doi:10.1021/jp035260s
(30)Shinoda,W.;Mikami,M.;Baba,T.;Hato,M.J.Phys.Chem.B2004,108,9346.doi:10.1021/jp035998+
(31) Nichols,J.W.;Deamer,D.W.Proc.Nat.Acad.Sci.U.S.A.1980,77,2038.doi:10.1073/pnas.77.4.2038
(32) Benga,G.;Pop,V.I.;Popescu,O.;Borza,V.J.Biochem.Biophys.Methods1990,21,87.doi:10.1016/0165-022X(90)90057-J
(33) Jansen,M.;Blume,A.Biophys.J.1995,68,997.doi:10.1016/S0006-3495(95)80275-4
(34)Andrasko,J.;Forsén,S.Biochem.Biophys.Res.Commun.1974,60,813.doi:10.1016/0006-291X(74)90313-1
(35) Graziani,Y.;Livne,A.J.Membr.Biol.1972,7,275.doi:10.1007/BF01867920
(36)Khavrutskii,I.V.;Gorfe,A.A.;Lu,B.;McCammon,J.A.J.Am.Chem.Soc.2009,131,1706.doi:10.1021/ja8081704
(37) Papahadjopoulos,D.;Nir,S.;Ohki,S.Biochim.Biophys.Acta1972,266,561.doi:10.1016/0005-2736(72)90354-9
(38) Zhang,J.W.;Bian,F.Y.;Shi,G.J.;Xu,S.C.Acta Phys.-Chim.Sin.2014,30(1),183.[張繼偉,卞福永,施國軍,徐四川.物理化學學報,2014,30(1),183.]doi:10.3866/PKU.WHXB201311281
(39) Yang,F.Y.Biological Cell;Science Press:Beijing,2005.[楊福愉.生物膜.北京:科學出版社,2005.]
(40) Hoff,B.;Strandberg,E.;Ulrich,A.S.;Tieleman,D.P.;Posten,C.Biophys.J.2005,88,1818.doi:10.1529/biophysj.104.052399
(41) Janosi,L.;Gorfe,A.A.J.Chem.Theory Comput.2010,6,3267.doi:10.1021/ct100381g
(42) Su,Z.Y.;Wang,Y.T.J.Phys.Chem.B2011,115,796.doi:10.1021/jp107599v
(43) Dunkin,C.M.;Pokorny,A.;Almeida,P.F.;Lee,H.S.J.Phys.Chem.B2011,115,1188.doi:10.1021/jp107763b
(44) Chen,R.;Poger,D.;Mark,A.E.J.Phys.Chem.B2011,115,1038.doi:10.1021/jp110002q
(45) Merlino,A.;Vitiello,G.;Grimaldi,M.;Sica,F.;Busi,E.;Basosi,R.;D’Ursi,A.M.;Fragneto,G.;Paduano,L.;D’Errico,G.J.Phys.Chem.B2012,116,401.doi:10.1021/jp204781a
(46)Yamamoto,E.;Akimoto,T.;Shimizu,H.;Hirano,Y.;Yasui,M.;Yasuoka,K.J.Phys.Chem.B2012,116,8989.
(47) Polyansky,A.A.;Volynsky,P.E.;Nolde,D.E.;Arseniev,A.S.;Efremov,R.G.J.Phys.Chem.B2005,109,15052.doi:10.1021/jp0510185
(48) Puri,A.;Jang,H.;Yavlovich,A.;Masood,M.A.;Veenstra,T.D.;Luna,C.;Aranda-Espinoza,H.;Nussinov,R.;Blumenthal,R.Langmuir2011,27,15120.doi:10.1021/la203453x
(49)Manna,M.;Mukhopadhyay,C.Langmuir2009,25,12235.doi:10.1021/la902660q
(50) Hartshorn,M.;Jewett,C.M.;Brozik,J.A.Langmuir2010,26,2609.doi:10.1021/la904308g
(51) Mondal,S.;Mukhopadhyay,C.Langmuir2008,24,10298.doi:10.1021/la8015589
(52) Soemo,A.R.;Wirth,M.J.Langmuir2010,26,2196.doi:10.1021/la9038914
(53) Payandeh,J.;Gamal El-Din,T.M.;Scheuer,T.;Zheng,N.;Catterall,W.A.Nature2012,486,135.
(54) J?nsson,P.;Jonsson,M.P.;H??k,F.Nano Lett.2010,10,1900.doi:10.1021/nl100779k
(55) Carr,R.;Weinstock,I.A.;Sivaprasadarao,A.;Müller,A.;Aksimentiev,A.Nano Lett.2008,8,3916.doi:10.1021/nl802366k
(56) Berendsen,H.J.C.;Postma,J.P.M.;van Gunsteren,W.F.;Hermans,J.;Pullman,B.J.Am.Chem.Soc.2001,123,8638.doi:10.1021/ja0159618
(57)Miyamoto,S.;Kollman,P.A.J.Comput.Chem.1992,13,952.
(58) Hess,B.;Kutzner,C.;van der Spoel,D.;Lindahl,E.J.Chem.Theory Comput.2008,4,435.doi:10.1021/ct700301q
(59) Van der Spoel,D.;Lindahl,E.;Hess,B.;Groenhof,G.;Mark,A.E.;Berendsen,H.J.C.J.Comput.Chem.2005,26,1701.
(60) Berendsen,H.J.C.;van der Spoel,D.;van Drunen,R.Comp.Phys.Commun.1995,91,43.doi:10.1016/0010-4655(95)00042-E
(61) Frisch,M.J.;Trucks,G.W.;Schlegel,H.B.;et al.Gaussian 03,Revision E.01;Gaussian Inc.:Wallingford,CT,2004.
(62) Schuettelkopf,A.W.;vanAalten,D.M.F.Acta Crystallogr.2004,D60,1355.
(63)Wang,Y.;Bian,F.;Deng,S.R.;Shi,Q.;Ge,M.F.;Wang,S.;Zhang,X.K.;Xu,S.C.Journal of Biomolecular Structure&Dynamics2011,28,881.doi:10.1080/07391102.2011.10508615
(64) Xu,S.C.;Chi,S.M.;Jin,Y.;Shi,Q.;Ge,M.F.;Wang,S.;Zhang,X.K.J.Mol.Model.2012,18,377.doi:10.1007/s00894-011-1083-7
(65) Humphrey,W.;Dalke,A.;Schulten,K.J.Mol.Graph.1996,14,33.doi:10.1016/0263-7855(96)00018-5
(66) Hess,B.;Bekker,H.;Berendsen,H.J.C.;Fraaije,J.G.E.M.J.Comput.Chem.1997,18,1463.
(67) Darden,T.;York,D.;Pedersen,L.J.Chem.Phys.1993,98,10089.doi:10.1063/1.464397
(68) Essman,U.;Perera,L.;Berkowitz,M.L.;Darden,T.;Lee,H.;Pedersen,L.G.J.Chem.Phys.1995,103,8577.doi:10.1063/1.470117
(69) Berendsen,H.J.C.;Postma,J.P.M.;Gunsteren,W.F.;Dinola,A.;Haak,J.R.J.Chem.Phys.1984,81,3684.doi:10.1063/1.448118
(70) Hub,J.S.;de Groot,B.L.;van der Spoel,D.J.Chem.Theory Comput.2010,6,3713.doi:10.1021/ct100494z
(71) Chiu,S.W.;Subramaniam,S.;Jakobsson,E.Biophys.J.1999,76,1939.doi:10.1016/S0006-3495(99)77353-4
(72) Erdtman,E.;dos Santos,D.J.V.A.;L?fgren,L.;Eriksson,L.A.Chem.Phys.Lett.2008,463,178.doi:10.1016/j.cplett.2008.08.021
(73) Bauer,B.A.;Lucas,T.R.;Meninger,D.J.;Patel,S.Chem.Phys.Lett.2011,508,289.doi:10.1016/j.cplett.2011.04.052

