HPLC法檢測海藻糖的研究
趙偉,段瑩瑩,張曰輝,曹大鵬,周生民,馮文紅
(山東福洋生物科技有限公司,山東德州253100)
HPLC法檢測海藻糖的研究
趙偉,段瑩瑩,張曰輝*,曹大鵬,周生民,馮文紅
(山東福洋生物科技有限公司,山東德州253100)
建立了一種利用高效液相色譜法檢測葡萄糖、麥芽糖和海藻糖混合溶液中海藻糖的方法。采用Xbridge-NH2色譜柱,流動相為乙腈/水=4∶1加0.1%的氨水,流速1.0 mL/min,柱溫35℃,該條件下葡萄糖、麥芽糖、海藻糖能完全分開,葡萄糖、麥芽糖、海藻糖的質量濃度在0.1~4.0 g/100 mL范圍與峰面積呈良好線性關系,相關系數R2為0.999 8~0.999 9,相對標準偏差為1.60%,回收率為98.2%~99.4%。
高效液相色譜法;檢測;海藻糖;混合溶液
海藻糖是一種被稱為生命之糖的非還原性二糖,有使細胞膜及蛋白質等生物大分子穩定的作用[1],能使干燥脫水后的生物體以極低乃至停止新陳代謝的形式被保護,一旦環境許可,生物體即能復活,而不損害生命物質[2]。海藻糖能保護酵母菌的胞吞作用不受其產生的酒精的抑制[3],海藻糖的強表達能提高在高滲透壓下大腸桿菌的生長能力[4],海藻糖在食品、醫藥、保健、化妝品以及農作物育種方面也有廣泛的應用[5]。海藻糖的生物合成方法有利用生物自然合成[6-8]和酶法合成[9-13]。海藻糖合成酶是由NISHIMOTO T等[13]從脂肪桿菌屬(Pimelobacter sp.)R48和水生棲熱菌(Thermus aquaticus)中最早發現并提純的。國際上,日本等國以淀粉為原料,通過酶法反應成功進行了海藻糖的工業化生產,為其的進一步應用奠定了良好的基礎[2]。海藻糖轉化酶能夠將麥芽糖轉化為海藻糖[10]。有很多方法可以對海藻糖的含量進行測量,如高效液相色譜(high performance liquid chromatography,HPLC)法[6-12]、蒽酮-硫酸法[13]、3,5-二硝基水楊酸(dinitrosalicylic acid,DNS)法[14]等,但是這些方法不能簡便準確的測定溶液中海藻糖、麥芽糖和葡萄糖的含量。為了對海藻糖轉化酶的反應條件進行優化,需要測定海藻糖轉化率,本研究用示差折光檢測器和氨基柱的高效液相色譜法對溶液中海藻糖所占比例進行測定,該方法能夠準確測定混合溶液中海藻糖,麥芽糖和葡萄糖各自的含量,比其他方法更加簡便準確,以期為海藻糖工業化生產提供參考。
1 材料與方法
1.1 材料與試劑
海藻糖、麥芽糖、葡萄糖:美國Sigma公司;乙腈(色譜純):西隴化工股份有限公司;氨水:萊陽市康德化工股份有限公司。
1.2 儀器與設備
LC-20 AT型HPLC色譜儀(配Waters515泵、Waters 2414型示差折光檢測器、N2000雙通道色譜工作站、柱溫控制系統):美國Waters公司。
1.3 方法
1.3.1 色譜條件
色譜柱:XBridgeTMNH2(3.5 μm×4.6 μm×250 mm);柱溫:35℃;流動相:V乙腈∶V水=4∶1,配好后加0.1%氨水;流速:1.0 mL/min;檢測器溫度:40℃。
1.3.2 混合標準溶液的配制
分別準確稱取葡萄糖、麥芽糖、海藻糖各1.000 0 g,將這三種糖定容至100 mL容量瓶中,搖勻后超聲混勻20 min,進樣前用0.22 μm的濾膜過濾。
1.3.3 標準曲線的制作
用超純水分別配制質量濃度分別為0.1 g/100 mL、0.2 g/100 mL、0.4 g/100 mL、0.8 g/100 mL、1.6 g/100 mL、3.2 g/ 100mL、4.0g/100mL葡萄糖、麥芽糖、海藻糖的標準溶液,HPLC分析后繪制標準曲線,得到線性回歸方程和相關系數(R2)。
2 結果與分析
2.1 檢測條件的確定
文獻中測定海藻糖一般用氨基柱,流動相為V乙腈∶V水為4∶1,流速為1 mL/min,但是本試驗用Xbridge-NH2色譜柱時測得的麥芽糖和海藻糖均為駝峰,在流動相中加入0.1%的氨水后,駝峰消失,峰型良好,由于氨水易揮發,不會對儀器設備產生影響,因此本試驗選用其作為胺修飾劑,葡萄糖、麥芽糖和海藻糖的分離效果好,能夠準確的測量各糖的含量,滿足分析溶液中海藻糖的含量。
2.2 組分的定性定量分析
分別進1%的葡萄糖、麥芽糖和海藻糖的標準品,根據保留時間定性分析,根據外標法進行定量分析,然后進混合標準品,結果分離度良好,混合標準品色譜圖見圖1。
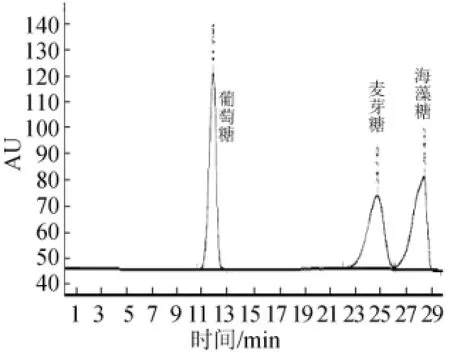
圖1 混合標準品色譜圖Fig.1 Chromatogram of mixed standards
2.3 標準曲線與回歸方程
以糖質量濃度(x,g/100 mL)為橫坐標,峰面積(y)為縱坐標,葡萄糖、麥芽糖及海藻糖HPLC標準曲線見圖2,相關系數與回歸方程見表1。
由表1可知,葡萄糖、麥芽糖、海藻糖的質量濃度為0.1~4.0 g/100 mL時與峰面積呈良好線性,相關系數R2為0.999 8~0.999 9。
2.4 精密度試驗
對海藻糖標準品所配溶液連續進樣6次,測定其峰面積,結果見表2。
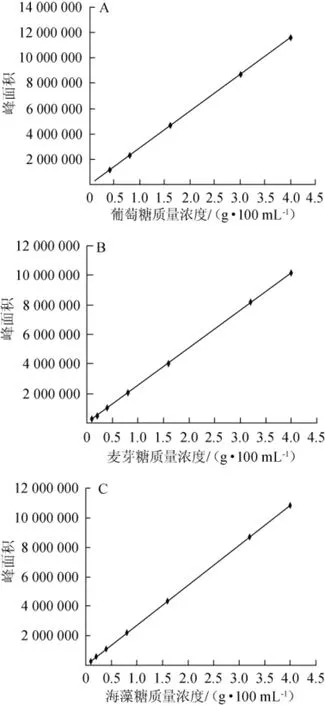
圖2 葡萄糖(A)、麥芽糖(B)及海藻糖(C)的HPLC標準曲線Fig.2 Standard curve for HPLC analysis of glucose(A),maltose(B) and trehalose(C)

表1 相關系數與線性方程Table 1 Correlation coefficient and linear equation

表2 精密度試驗結果Table 2 Results of precision test
由表2可知,相對標準偏差(relative standard deviation,RSD)為1.60%,在5.0%誤差范圍內,說明該方法精密度良好。
2.5 回收率試驗
取三份樣品分別加葡萄糖、麥芽糖、海藻糖標準品,回收率結果見表3。
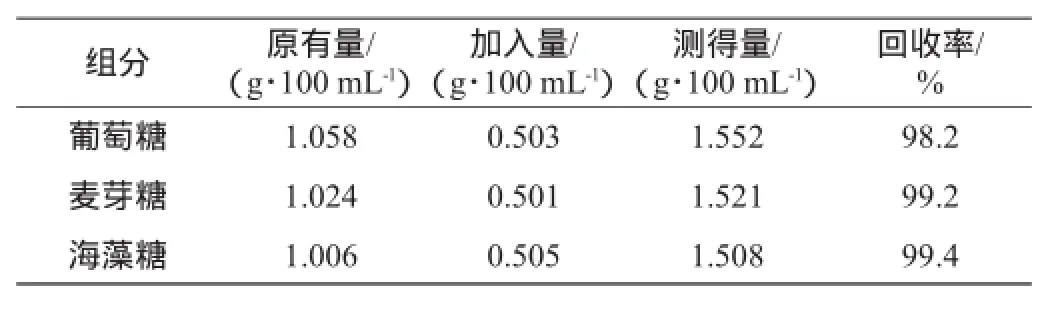
表3 回收率試驗結果Table 3 Results of recovery test
由表3可知,這三種糖的回收率為98.2%~99.4%,符合回收率在95%~105%的標準,說明該方法具有較好的準確度。
3 結論
本試驗建立了用Xbridge-NH2色譜柱測定海藻糖的HPLC方法,同時摸索出使葡萄糖、麥芽糖、海藻糖三種混合物完全分離的測定方法,相關系數R2為0.999 8~0.999 9,相對標準偏差(RSD)為1.60%,回收率為98.2%~99.4%。該法簡單快捷、靈敏度高、重現性好,可用于研究或生產海藻糖的含量測定。
[1]PENNA M,FERMANDES R.Stabilization against thermal nactivation promoted by sugars on enzymes tructure and function:why is trehalose more effective than other sugars[J].Arch Biochem Biophys,1998,360 (1):10-14.
[2]陳海健.海藻糖的提取方法和性質研究[J].廣東化工,2013,40(11):121-122.
[3]LUCERO P,PENALVER E,MORENO E,et al.Internal trehalose protects endocytosis from inhibition by ethanol in Saccharomyces cerevisiae [J].Appl Environ Microbiol,2000,66(10):4456-4461.
[4]PURVIS J E,YOMANO L P,ENHANCED L O.Trehalose production improves growth of Escherichia coli under osmotic stress[J].Appl Environ Microbiol,2005,71(7):3761-3769.
[5]徐娟,袁衛濤,楊海軍.海藻糖的生產及市場應用[J].添加劑與營養,2012(1):52-53.
[6]楊平,李敏惠,潘克儉.等.海藻糖的生物合成與分解途經及其生物學功能[J].生命的化學,2006,26(3):233-236.
[7]馬鶯,劉巧紅.海藻糖的生物合成及相關酶系[J].中國甜菜糖業,2005(1):24-28.
[8]劉建龍,王瑞明,楊連生.海藻糖的生產方法[J].現代化工,2005,25(1):23-29.
[9]蒙健宗,陳發忠,王青艷,等.重組海藻糖合成酶工程菌的pH-stat高密度發酵工藝研究[J].食品工業科技,2006,27(8):125-128.
[10]劉建龍,譚海剛,王瑞明,等.麥芽糖生物合成海藻糖的途徑及合成條件的研究[J].食品添加劑,2006,27(5):161-163.
[11]戴秀玉,吳大鵬,周堅.大腸桿菌海藻糖合成酶基因的克隆和表達[J].遺傳學報,2000,27(2):158-164.
[12]韋航,馬少敏,張云光.等.海藻糖的酶轉化法生產技術[J].安徽農業科學,2010,38(22):12016-12018.
[13]NISHIMOTO T,NAKAON M,NAKADA T,et al.Purification and properties of a novel enzyme,trehalose synthase,from Pimelobacter sp. R48[J].Biosci Biotech Biochem,1996,60(4):640-644.
[14]王成君,林建平,岑沛霖.高效液相色譜法快速檢測海藻糖[J].江南大學學報,2005,4(5):522-525.
[15]廖靜.海藻糖分析方法的研究[J].微生物學通報,2004,31(5):96-100.
[16]甘賓賓.高效液相色譜法測定海藻糖[J].化工技術與開發,2003,32(1):22-23.
[17]何秀全,彭明,張家明.HPLC-ELSD法測定木薯葉片中海藻糖的含量[J].熱帶作物學報,2013,34(4):751-754.
[18]韓少卿,彭奇均.HPLC法測定酵母中海藻糖[J].中國食品添加劑,1996,19(4):107-106.
[19]榮紹豐,張海平,段作營.HPLC在研究微桿菌D-97胞內酶合成海藻糖機制中的應用[J].食品與發酵工業,1996,28(7):24-28.
[20]HERBRETEAU B,LAFOSSE M,MORIN-ALLORY L,et al.High performance liquid chromatography of raw sugars and polyols using bonded silica gels[J].Anal Chim Acta,1992,33(7):325-330.
[21]李艷玲,張顯忠,苗苗,等.蒽酮-硫酸法測定海藻糖含量顯色條件的改進[J].食品工業科技,2009,30(2):296-298.
[22]王蕾,鄭璞.DNS法定量測定海藻糖的研究[J].食品科技,2004(2):82-84.
[23]王俊峰,尹堯,王萍萍.高溫海藻糖合酶釋放處理條件及其酶學性質的研究[J].安徽農業科學,2010,38(2):11673-11675,11678.
Determination of trehalose by HPLC
ZHAO Wei,DUAN Yingying,ZHANG Yuehui*,CAO Dapeng,ZHOU Shengmin,FENG Wenhong
(Shangdong Fuyang Biotechnology Co.,Ltd.,Dezhou 253100,China)
A HPLC method for the detection of trehalose in the mix solution of glucose,maltose and trehalose was established.The sample was separated by Xbridge-NH2chromatographic column,using acetonitrile:water=4∶1 supplemented with 0.1%NH4OH as the mobile phase,the flow rate 1.0 ml/min,the column temperature 35℃.Under this condition,glucose,maltose,and trehalose were completely separated.When the concentration of glucose,maltose,trehalose was in the range of 0.1-4.0 g/100 ml,the concentration and the peak area had a good linear relationship,R2was 0.999 8-0.999 9,relative standard deviation was 1.60%,and the recovery rate was 98.2%-99.4%.
HPLC;detection;trehalose;mixed solution
O657.7
A
0254-5071(2014)10-0148-03
10.11882/j.issn.0254-5071.2014.10.036
2014-09-01
趙偉(1979-),女,工程師,碩士,研究方向為微生物發酵。
*通訊作者:張曰輝(1987-),女,工程師,碩士,研究方向為微生物與酶技術。

