堿性蛋白酶酶解提取羊血血紅素工藝條件優化
祝 霞,李 潁,付文力,杜 娜,習 京,韓舜愈,盛文軍,牛黎莉,楊學山,*
(1.甘肅農業大學食品科學與工程學院,甘肅蘭州730070;2.甘肅農業大學生命科學技術學院,甘肅蘭州730070)
堿性蛋白酶酶解提取羊血血紅素工藝條件優化
祝 霞1,李 潁1,付文力2,杜 娜1,習 京2,韓舜愈1,盛文軍1,牛黎莉1,楊學山2,*
(1.甘肅農業大學食品科學與工程學院,甘肅蘭州730070;2.甘肅農業大學生命科學技術學院,甘肅蘭州730070)
以羊血為試材,血紅素得率為指標,在加酶量、酶解pH、酶解溫度和酶解時間等單因素實驗基礎上,采用正交實驗優化工藝參數。結果表明最佳反應參數為堿性蛋白酶加酶量8000U/g血紅蛋白、酶解pH8.5、酶解溫度55℃、酶解時間4h,在此條件血紅素得率達到85.3%,即1L羊血可提取3.93g血紅素。該法所得產品的安全性高,適合工業化生產。
堿性蛋白酶,羊血,血紅素,工藝條件
血紅素又名高鐵血紅素、正鐵血紅素、羥基血紅素,主要存在于動物血液和肌肉組織中,具有重要的生理功能和使用價值[1]。在食品工業中,血紅素作為天然色素,可替代熟肉制品中危及人體健康的發色劑亞硝酸鹽及人工合成色素[2];在醫藥行業中,血紅素可用作易被人體直接吸收補鐵劑,治療缺鐵性貧血[3];此外血紅素還可用于制備抗癌藥物的卟啉前體[4]。
甘肅省是全國五大牧區之一,擁有豐富的牛羊血液資源,是開發血紅素的寶貴資源。但實際生產中利用率極低,甚至造成嚴重的環境污染,因此急需開展血紅素制備技術研究。以動物血液為原料制備血紅素的關鍵環節是血紅蛋白的水解,目前國內外常采用冰醋酸法[5]、酸性丙酮法[6]、醋酸鈉法[7]、蒸餾法[8]、鞣酸法[9]、羧甲基纖維素(CMC)[10]等法水解制備血紅素,存在產品純度低、生產周期長和溶劑回收困難等問題。生物酶解豬血、牛血血紅蛋白制備血紅素不僅可以避免酸、堿水解血紅蛋白時生產周期長、腐蝕設備、污染環境等缺陷,而且極大的提高了產品的安全性[11-13],但生物酶解羊血制備血紅素尚未見報道。本實驗以不同蛋白酶水解羊血紅蛋白效果比較為基礎,利用堿性蛋白酶水解羊血血紅蛋白,并采用正交實驗優化提取工藝,以期為羊血資源開發利用提供技術支持。
1 材料與方法
1.1 材料與儀器
新鮮羊血 購自甘肅蘭州小西湖屠宰場;血紅素標準品(純度98%)、堿性蛋白酶(20萬U/g)、中性蛋白酶(5萬U/g)、胰蛋白酶(100萬U/g) Sigma公司;氫氧化鈉、鹽酸、氯化鈉、檸檬酸鈉等 均為國產分析純。
SL-1001電子天平 上海民橋精密科學儀器有限公司;TDZ5-WS離心機 湘儀離心機儀器有限公司;HH-6數顯恒溫水浴鍋 國華電器有限公司;PHS-3C pH計 上海雷磁有限公司;808型紫外-可見分光光度計 日本日立公司。
1.2 實驗方法
1.2.1 水解酶選擇 分別按8000U/g(E/S)添加中性蛋白酶(pH 7.0、50℃)、堿性蛋白酶(pH 9.0、50℃)、胰蛋白酶(pH8.0、37℃),在各酶最適作用條件下水解等量溶血液10h,間隔1h取樣,加入等體積5%三氯乙酸,離心,取上清液測定A280。
1.2.2 堿性蛋白酶水解制備羊血血紅素技術路線 新鮮羊血→預處理→分離紅血球→溶血→酶解→離心去除沉淀→調節pH→離心→收集沉淀→離心→血紅素樣品→提取率計算。
1.2.3 操作要點 參照文獻[11-13]方法,并改進。
1.2.3.1 羊血預處理 將收集的新鮮羊血去除毛等雜質,加入10.0g/L檸檬酸三鈉抗凝。
1.2.3.2 分離紅血球 取新鮮抗凝羊血,以5000r/m in離心15min,收集紅血球沉淀;將紅血球加0.9g/100m L NaCl溶液,5000r/m in離心10m in,重復3次,得潔凈紅血球。
1.2.3.3 溶血 取潔凈紅血球100m L,加等量去離子水攪拌溶血。取樣測定血紅蛋白含量。
1.2.3.4 酶解 取溶血液50m L,調節pH 8.5,加入堿性蛋白酶(8000U/g血紅蛋白),放入恒溫水浴振蕩器(120r/m in),50℃酶解6h。冷卻后4000r/m in離心15m in,收集上清液。
1.2.3.5 調節pH 濃鹽酸調節上清液pH 4.5,4000r/m in離心15m in,將沉淀用蒸餾水溶解,烘干得血紅素樣品。稱重并測定A385,計算血紅素得率。
1.2.4 單因素實驗
1.2.4.1 加酶量對血紅素得率的影響 取羊血溶血液各50m L,分別加入6000、7000、8000、9000、10000U/g血紅蛋白的堿性蛋白酶,調節pH 8.5,50℃恒溫水浴酶解6h,離心收集上清液,濃鹽酸調節上清液pH 4.5,離心,沉淀用蒸餾水溶解,烘干得血紅素樣品。
1.2.4.2 酶解pH對血紅素得率的影響 取羊血溶血液各50m L,加入8000U/g血紅蛋白的堿性蛋白酶,調節pH分別為7.5、8.0、8.5、9.0和9.5,50℃恒溫水浴酶解6h,離心收集上清液,濃鹽酸調節上清液pH 4.5,離心,沉淀用蒸餾水溶解,烘干得血紅素樣品。
1.2.4.3 酶解溫度對血紅素得率的影響 取羊血溶血液各50m L,加入8000U/g血紅蛋白的堿性蛋白酶,調節pH 8.5,分別放入40、45、50、55、60℃恒溫水浴振蕩酶解6h,離心收集上清液,濃鹽酸調節上清液pH4.5,離心,沉淀用蒸餾水溶解,烘干得血紅素樣品。
1.2.4.4 酶解時間對血紅素得率的影響 取羊血溶血液各50m L,加入8000U/g血紅蛋白的堿性蛋白酶,調節pH8.5,放入恒溫水浴振蕩器,50℃分別酶解2、4、6、8、10h,離心收集上清液,濃鹽酸調節上清液pH 4.5,離心,沉淀用蒸餾水溶解,烘干得血紅素樣品。
1.2.5 正交實驗優化 根據單因素實驗結果確定正交實驗因素和水平,采用L9(34)正交實驗設計,優化堿性蛋白酶酶解提取羊血血紅素最優工藝,平行重復3次。正交實驗因素水平見表1。
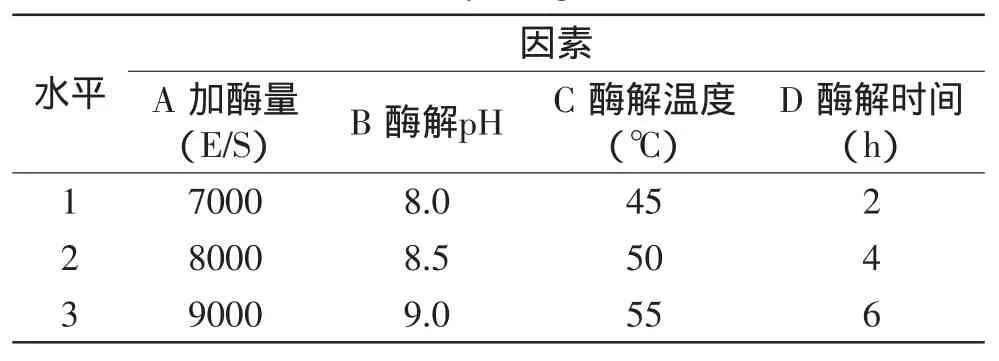
表1 L9(34)正交實驗因素水平表Table 1 Factors and their levels in L9(34)orthogonal array design
1.2.6 血紅蛋白定量測定 采用考馬斯亮藍法[14]。
1.2.7 血紅素定量測定 參照文獻[15]方法進行:以0.1mol/L NaOH溶解血紅素標準品,調整至適宜濃度,測定A385,建立標準曲線。稱取干燥至恒重的血紅素提取樣品20mg,定溶于50m L 0.1mol/L NaOH溶液,測定A385,代入回歸方程即可求得血紅素濃度。根據公式(1)、(2)、(3)計算血紅素含量、純度及收率。
血紅素含量(g)=血紅素濃度(μg/m L)×50m L×10-6式(1)
純度(%)=血紅素含量(g)/血紅素樣品質量(g)× 100 式(2)
血紅素得率(%)=血紅素樣品質量×血紅素樣品純度/總血量中含血紅素理論值×100 式(3)
注:血紅蛋白相對分子質量(64500)、血紅素相對分子質量(651.96)、血紅蛋白含量(128.48g/L),可得羊血中血紅素理論值為4.61g/L。
1.2.8 數據處理 本實驗數據采用SPSS 13.0軟件進行分析處理。
2 結果與分析
2.1 水解酶選擇
三氯乙酸可沉淀四肽以上的片段,其可溶性氮的多少直接反映蛋白酶的水解能力,因此測定酶解上清液的肽含量(A280)可顯示水解度大小[16]。三種不同蛋白酶酶解羊血血紅蛋白結果見圖1。
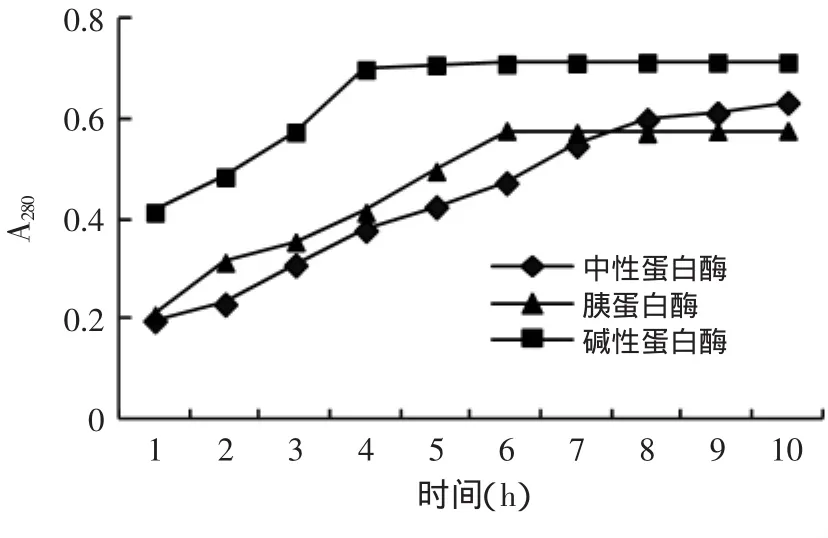
圖1 各種蛋白酶水解曲線Fig.1 Hydrolysis curves of differentenzymes
由圖1可知,在底物濃度、酶總活力相同,且在各酶最適溫度、pH下進行反應,隨著時間的延長,血紅蛋白的水解程度均不同程度增大,其中堿性蛋白酶水解能力最強。因此,實驗選擇堿性蛋白酶水解羊血溶血液制備血紅素。
2.2 血紅素標準曲線
血紅素標準曲線見圖2。由圖2可知,在2.0~ 12.0μg/m L范圍內血紅素的濃度與吸光度呈線性關系。標準曲線回歸方程為:y=0.0678x-0.0179,相關系數R2=0.9995。
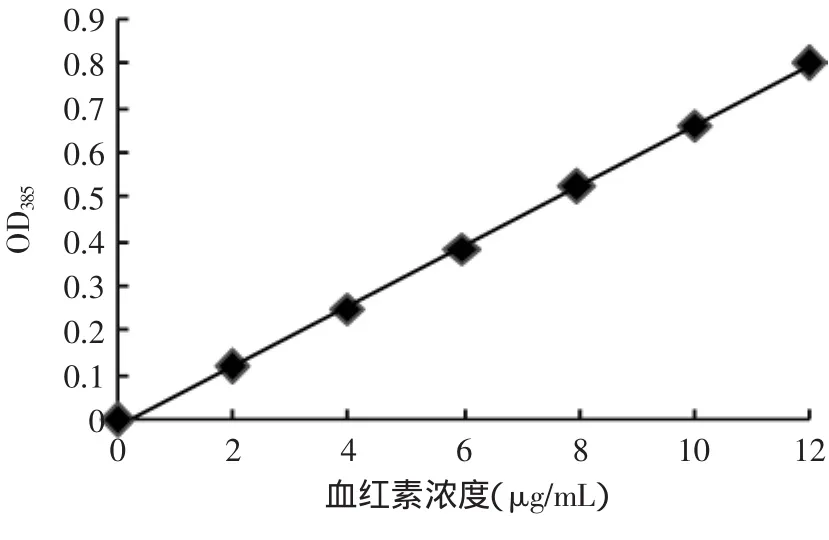
圖2 血紅素標準曲線Fig.2 Standard curve of hemin
2.3 單因素實驗
2.3.1 加酶量對血紅素得率的影響 由圖3可知,加酶量對水解反應有一定的影響,酶量越大,與底物作用的酶分子就越多,當酶分子將底物飽和之后,再增加酶量對酶解反應無促進作用。酶量增加,血紅素提取率呈現上升趨勢。在加酶量8000U/g血紅蛋白時,血紅素提取率達到最大值,此后幾乎不再增加。說明底物已經基本被酶飽和,增加酶量對反應貢獻不大。因此實驗選擇加酶量為8000U/g血紅蛋白。
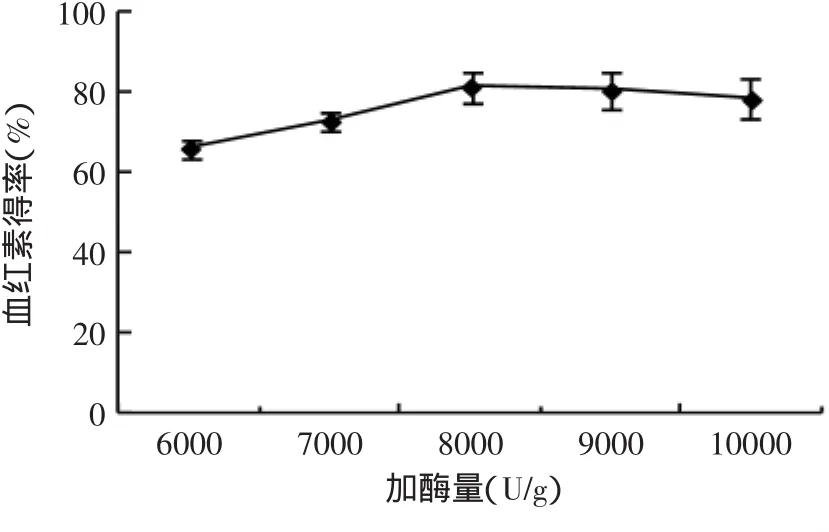
圖3 加酶量對血紅素得率的影響Fig.3 Effectof enzyme concentration on heme yield
2.3.2 酶解pH對血紅素得率的影響 酶作為一種特殊的蛋白質分子,其酶促催化反應的能力與環境pH密切相關。環境pH會影響酶分子的構象和酶分子及底物的解離狀態,從而影響酶的活性和酶促反應速度,pH過高、過低均對酶促反應不利。由圖4可知,當pH 8.5時血紅素得率達到最大值,為較佳酶解pH;pH低于或高于8.5,血紅素得率均呈下降趨勢。因為非最適pH抑制了酶活性,影響了酶解效率。
2.3.3 酶解溫度對血紅素得率的影響 由圖5可知,酶解溫度對血紅素得率有較大影響。血紅素得率在50℃左右時達到最大值;隨著溫度的繼續升高,血紅素得率呈下降趨勢。同時在55℃以上,羊血有凝固的趨勢,不利于進行后續實驗操作。因此,實驗酶解溫度選擇50℃為較佳酶解溫度。
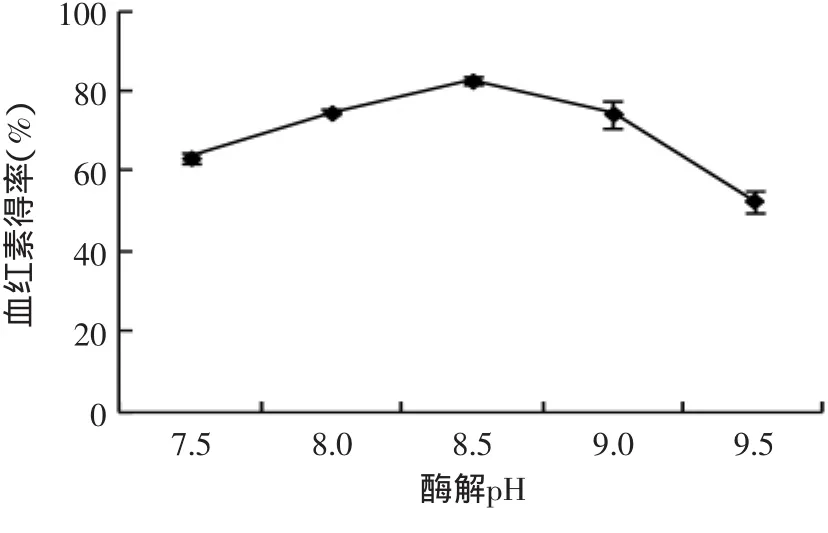
圖4 酶解pH對血紅素得率的影響Fig.4 Effectof enzyme pH on heme yield
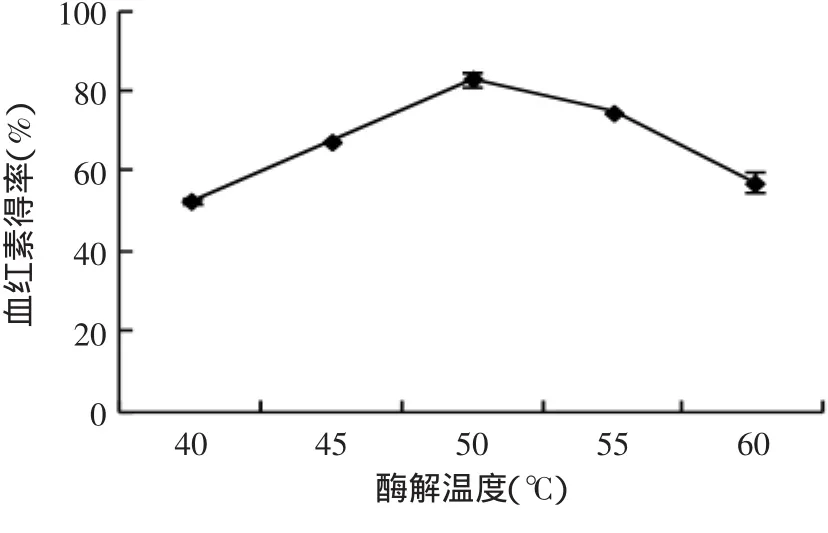
圖5 酶解溫度對血紅素得率的影響Fig.5 Effectof enzymatic hydrolysis temperature on heme yield
2.3.4 酶解時間對血紅素得率的影響 由圖6可知,酶解反應在4h后血紅素得率趨于緩慢下降。水解時間延長沒有進一步提高血紅素得率,說明反應已經基本達到平衡且隨時間延長,水解液發生了變質。考慮到生產過程中溶劑損失、電能消耗、生產周期、經濟效益及防止水解液變質等因素,實驗選擇酶解時間為4h。
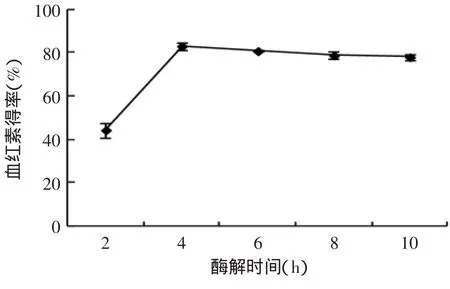
圖6 酶解時間對血紅素得率的影響Fig.6 Effectof enzyme digestion time on heme yield
2.4 正交實驗
根據單因素實驗結果,以血紅蛋白酶解后血紅素得率為指標,選取對血紅素得率有較大影響的加酶量(A)、酶解pH(B)、酶解溫度(C)和酶解時間(D)進行L9(34)正交實驗,結果見表2。通過實驗結果統計分析,得到最優組合并進行驗證實驗,確定堿性蛋白酶酶解提取羊血血紅素的最優工藝條件。
由表2可知:各因素對血紅素得率的影響大小依次為A>B>D>C,最佳工藝條件組合為A2B2C3D2,即加酶量8000U/g血紅蛋白、酶解pH8.5、酶解溫度55℃、酶解時間4h。
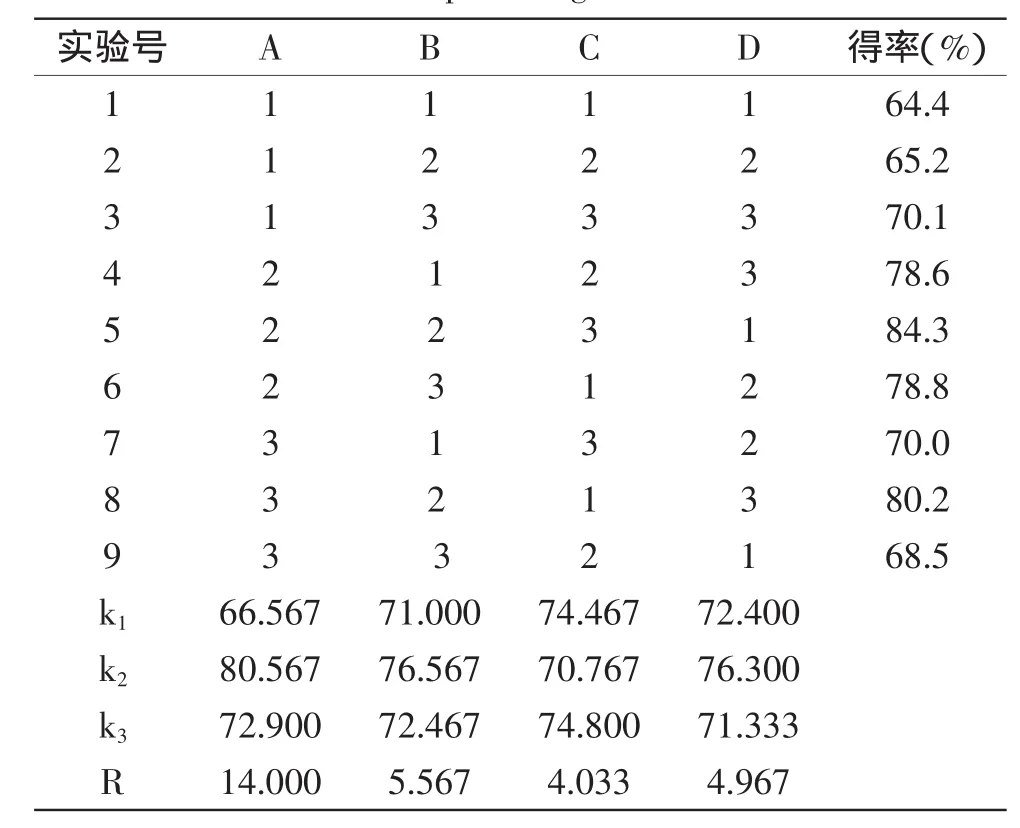
表2 堿性蛋白酶水解提取羊血血紅素正交實驗結果Table 2 Results of orthogonal testalkaline protease hydrolysis sheep haemoglobin
用SPSS 13.0統計軟件對實驗結果進行方差分析,其結果見表3。
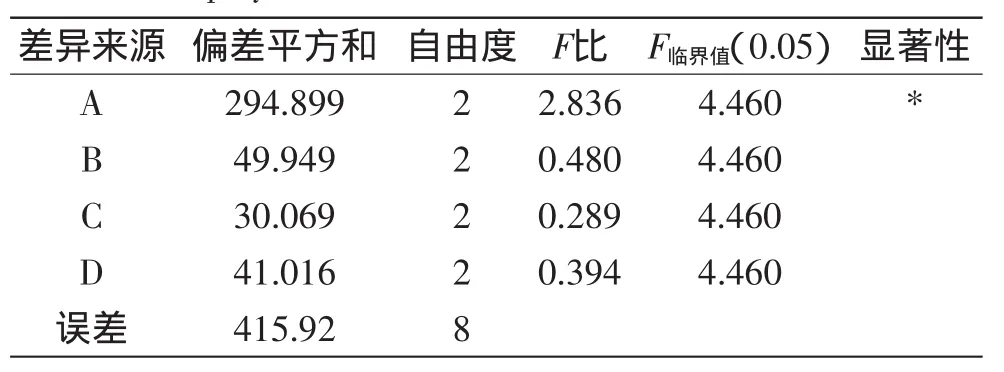
表3 正交實驗方差分析結果Table 3 Analysis of variances for extraction yield ofpolysaccharideswith various extraction
由表3可知,因素A顯著性p<0.05,差異顯著;因素B、C、D不顯著,表明堿性蛋白酶加酶量對本實驗影響較大。
2.5 驗證實驗
由于最優組合在L9(34)正交實驗設計中未出現,需對正交實驗得到的最優組合進行驗證實驗。在加酶量8000U/g血紅蛋白、酶解pH 8.5、酶解溫度55℃、酶解4h條件下分離提取血紅素,重復3次。血紅素平均得率為85.3%,比正交實驗中其他組合得率都高,可見其為正交實驗確定的最佳工藝參數。
3 結論
本實驗采用堿性蛋白酶從羊血中提取血紅素,在單因素實驗的基礎上,通過正交實驗,確定最佳工藝條件為加酶量8000U/g血紅蛋白、酶解pH8.5、酶解溫度55℃、酶解時間4h,在此條件下,血紅素得率達到85.3%,即1L羊血可提取3.93g血紅素,純度達到87.9%。該法綠色環保,所得產品的安全性高,具有較好的經濟效益和社會效益,市場前景較為樂觀。
[1]王君,康平利.超聲波法提取氯化血紅素的研究[J].藥物生物技術,2004,11(4):260-263.
[2]MAN JIN,HEE JEONG CHAE,OH NAM-SOON.Process development for heme-enrichedpeptide by enzymatic hydrolysis of hemoglobin[J].Bioresource Technology,2002,84(1):63-68.
[3]HUANGWEN,XUEAN,NIUHAI,etal.Optimised ultrasonicassisted extraction of flavonoids from Folium eucommiae and evaluation of antioxidant activity inmulti-test systems in vitro[J]. Food Chemistry,2009,114(3):1147-1154.
[4]NAMA N A,VRONIQUE D D,ADJE E Y,et al.Bovine hemoglobin:An attractive source of antibacterial peptides[J]. Peptides,2008,29(6):969-977.
[5]鐘耀廣.利用冰醋酸提取血紅素的研究[J].食品科學,2004,25(4):90-95.
[6]汪長國,戴亞,劉少民,等.超聲波酸性丙酮法制備氯化血紅素[J].食品科學,2010,31(6):109-112.
[7]李敏康,錢冬明,李紅心.提取氯化血紅素新工藝的研究[J].食品科技,2005(12):51-53.
[8]晨光,莊紅,呂學舉,等.動物血液血紅素鐵提取方法研究[J].食品工業科技,2008(1):308-310.
[9]CHAE H J,IN M J,KIM D H,et al.Rapid determination of degree of hydrolysis for hemoglobin by osmometry[J].Korean SOC Agric Chem Biotechnol,2001,44(3):143-147.
[10]李志釗,葉春華.血紅素制備方法及應用與生產技術研究進展[J].食品研究與開發,2010,31(5):12-14.
[11]吳保承,沈國強,楊春霞,等.酶法提取豬血中血紅素的工藝研究[J].化學與生物工程,2009,26(8):61-63.
[12]管剛,張俊,趙靜,等.應用堿性蛋白酶制取牦牛血紅素工藝的研究[J].食品科技,2009,34(10):133-136.
[13]楊萬根,王衛東,孫會剛,等.復合酶水解豬血紅蛋白制備富血紅素多肽[J].食品科學,2011,32(6):7-10.
[14]翟桂香,董明盛,黃耀江,等.不同蛋白酶水解豬血紅蛋白制備血紅素的對比研究[J].江西農業學報,2007,19(7):92-93.
[15]YU YING,GUWEIXIN,LIANG JIAPIN,et al.Optimization ofextraction processofheme from sheep blood by response surface methodology[J].Food Chemistry,2009,107(8):1639-1646.
[16]張華山.豬血蛋白的酶水解及氨基酸含量[J].氨基酸和生物資源,2006,27(3):54-56.
Process optim ization of the alkaline enzymatic extracting heme from sheep blood
ZHU Xia1,LIYing1,FUW en-li2,DU Na1,XI Jing2,HAN Shun-yu1,SHENG W en-jun1,NIU Li-li1,YANG Xue-shan2,*
(1.Colleage of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.College of Life Science&Technology,Gansu Agricultural University,Lanzhou 730070,China)
Sheep b lood as the research material and the yield of heme was measure ind icate.Orthogonal array design generated based on sing le-factor experiments was em p loyed to op tim ize cond itions.The extraction factors such as the amount of enzyme,pH,react tem perature and react time were investigated.The results showed that the op timal amount of enzyme was 8000U/g,pH8.5,react tem perature was 55℃,react time was 4h,under these op timal conditions,the yield of heme was 85.3%,that was equivalent to 3.93g heme of 1L sheep b lood.This method had higher safety than others,itwas suitab le for industrialized p roduction.
alkaline;sheep b lood;heme;p rocess condition
TS251.9
A
1002-0306(2014)18-0199-04
10.13386/j.issn1002-0306.2014.18.034
2014-01-14 *通訊聯系人
祝霞(1977-),女,碩士研究生,講師,主要從事農產品加工方面的研究。
甘肅省農業生物技術研究與應用開發項目(GNSW-2010-03);甘肅農業大學大學生科研訓練計劃項目(20130815)。

