藍(lán)莓花青素的酰化及其抗氧化性評(píng)價(jià)
李路寧,陳 威,趙立儀,孫愛東
(北京林業(yè)大學(xué)生物科學(xué)與技術(shù)學(xué)院,北京100083)
藍(lán)莓花青素的酰化及其抗氧化性評(píng)價(jià)
李路寧,陳 威,趙立儀,孫愛東*
(北京林業(yè)大學(xué)生物科學(xué)與技術(shù)學(xué)院,北京100083)
以三乙酰沒食子酰氯作為酰基化劑,對藍(lán)莓花青素提取物進(jìn)行酰基化反應(yīng),制得酰基化藍(lán)莓花青素產(chǎn)物沒食子酸酰化花青素(GAA)。薄層色譜追蹤反應(yīng)進(jìn)程、毛細(xì)管法測定熔點(diǎn)保證酰化劑合成純度。對原花青素提取物、酰化中間產(chǎn)物和酰化花青素進(jìn)行了紅外光譜掃描,對比三者譜圖,證實(shí)了酰基化實(shí)驗(yàn)的成功,并利用HPLC測定了酰化度。分別通過DPPH法、鄰苯三酚自氧化法、卵磷脂脂質(zhì)體法測定了酰化花色苷對于清除自由基、清除超氧陰離子和抑制脂質(zhì)體過氧化的能力,酰化花色苷對于以上3實(shí)驗(yàn)的IC50分別為26.8、17.5、171.7μg/mL;相比較,原藍(lán)莓花青素為39.8、27.0、219.7μg/mL;抗壞血酸為45.1、51.2、1084.8μg/mL。實(shí)驗(yàn)表明沒食子酸酰化花青素方法切實(shí)可行,產(chǎn)物沒食子酸酰化花青素的抗氧化性得到提升。
藍(lán)莓,花青素,沒食子酸,抗氧化
花青素是一類廣泛存在于植物中的水溶性色素,它不僅為植物提供了藍(lán)、紫和紅等鮮艷的顏色,還在植物的傳種授粉、抵御害蟲與紫外線傷害等方面起到重要作用[1]。近些年的研究發(fā)現(xiàn)花青素對人體具有多種生理功能,如清除自由基[2]、抗突變[3]、抗腫瘤[4]、抗炎癥[5]、抵御粥樣動(dòng)脈硬化和冠心病[6]、防護(hù)肝損傷[1]和增強(qiáng)視力[7]等。
花青素屬于黃酮類化合物,其骨架為2-苯基苯并吡喃環(huán)結(jié)構(gòu)[8](圖1)。絕大多數(shù)花青素在3-,5-,7-位具有羥基,且在C-3位以糖苷鍵形式與不同的糖結(jié)合。B環(huán)中R1和R2位置取代基的不同和C-3位結(jié)合糖的不同構(gòu)成了多種多樣不同結(jié)構(gòu)的花青素。同時(shí),花色苷分子和糖殘基上的羥基還可以進(jìn)一步與一些脂肪酸和芳香酸結(jié)合,形成酰基化的花青素。一些研究表明酰基化的花青素在穩(wěn)定性及抗氧化功能方面具有明顯的優(yōu)勢[9-10]。目前國內(nèi)外研究的酰化花青素主要為分離天然產(chǎn)物獲得,而應(yīng)用化學(xué)手段合成酰化花青素卻鮮有報(bào)道。本文通過化學(xué)合成方法將富含羥基的沒食子酸基團(tuán)引入藍(lán)莓花青素中,并對得到的沒食子酰化花青素進(jìn)行了體外抗氧化能力考察,為進(jìn)一步了解花青素抗氧化能力與結(jié)構(gòu)的關(guān)系及擴(kuò)大花青素的應(yīng)用提供理論依據(jù)。
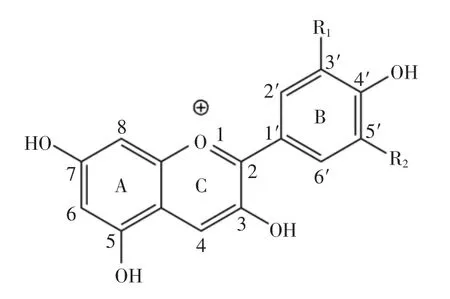
圖1 花青素基本結(jié)構(gòu)Fig.1 Basic structure of anthocyanins
1 材料與方法
1.1 材料與儀器
野生藍(lán)莓樣品 產(chǎn)于大興安嶺林區(qū),-80℃冷凍保存;沒食子酸標(biāo)準(zhǔn)品 由林業(yè)科學(xué)研究院提供;DPPH 購置于Sigma公司;色譜純甲醇 購置于Fisher公司;其他試劑 均為分析純。
UV-1200紫外可見分光光度計(jì) 上海美譜達(dá)儀器有限公司;NEXUS 670傅里葉變換近紅外光譜儀 美國熱電尼高力公司;1100高效液相色譜儀 美國安捷倫公司;Senco R-201旋轉(zhuǎn)蒸發(fā)儀 上海申順生物科技有限公司;FA1604N電子分析天平 上海精密儀器廠;JB-5定時(shí)雙向數(shù)顯恒溫磁力攪拌器 江蘇省金壇市榮華儀器制造有限公司;FD-18真空冷凍干燥機(jī) 北京德天佑科技有限公司。
1.2 實(shí)驗(yàn)方法
1.2.1 藍(lán)莓花青素提取 依照Fossen等[11]方法,有改動(dòng)。將-80℃下貯藏的藍(lán)莓鮮果在0℃下解凍24h,然后將藍(lán)莓研磨成漿,按照料液比1∶5比例加入含0.5%三氟乙酸(TFA)的甲醇溶液,在0℃下封口、遮光攪拌提取24h。將提取液離心,5000r/min,15min,收集上清液。將上清液用旋轉(zhuǎn)蒸發(fā)器濃縮,控制溫度在40℃以下,除去甲醇,得到濃縮液。
將濃縮液用1∶1(V∶V)乙酸乙酯萃洗,反復(fù)振蕩,除去上層脂類物質(zhì),將此操作反復(fù)3次。將除去脂類的濃縮液通入離子交換樹脂XAD-7柱,通入20倍柱體積含0.5%的三氟乙酸水溶液洗柱,除去非花青素化合物。然后通入含0.5%三氟乙酸甲醇溶液洗脫,收集洗脫液。將洗脫液于38℃下進(jìn)行真空濃縮,然后置于凍干機(jī)中真空干燥,得到花青素粉末。
1.2.2 酰基化試劑的制備 將沒食子酸置于120℃真空條件下烘干48h,充分除去水分,得到無水沒食子酸。將無水沒食子酸、無水乙酸酐、無水吡啶在0℃的條件下,按摩爾比3∶10∶10加入圓底燒瓶中,封口,在25℃的條件下攪拌反應(yīng)10h。若反應(yīng)不完全,可以適當(dāng)延長反應(yīng)時(shí)間。反應(yīng)過程中通過薄層色譜法追蹤反應(yīng)的進(jìn)度,當(dāng)檢測結(jié)果顯示混合體系中沒有沒食子酸殘余時(shí),反應(yīng)完成。
反應(yīng)結(jié)束后,向反應(yīng)系統(tǒng)中加入足量的10℃去離子水,攪拌。再利用HCl溶液調(diào)整混合體系pH為1,混合溶液中出現(xiàn)沉淀,靜止過夜。抽濾,收集沉淀產(chǎn)物。產(chǎn)物用少量冷水沖洗,在室溫下進(jìn)行真空干燥,得到白色粉末,即為三乙酰沒食子酸。用毛細(xì)管法測量其熔點(diǎn)。
按摩爾比1∶3將三乙酰沒食子酸和無水亞硫酰氯加入到圓底燒瓶中,80℃攪拌回流反應(yīng)4h,視情況可以適當(dāng)延長反應(yīng)時(shí)間,反應(yīng)過程中通過薄層色譜法追蹤反應(yīng)的進(jìn)度。反應(yīng)結(jié)束后,在體系中加入二氯甲烷,溶解反應(yīng)物,在50℃下通過多次旋蒸除去反應(yīng)體系中的多余的亞硫酰氯,晶體析出。收集析出的晶體,室溫下進(jìn)行真空干燥,得到干燥產(chǎn)物,即酰化劑三乙酰沒食子酰氯的白色粉末,并用毛細(xì)管法測量其熔點(diǎn)。三乙酰沒食子酰氯溶解于二氯甲烷中密封避光保存。
1.2.3 藍(lán)莓花青素酰基化 參考徐曼等[12]方法,有改動(dòng)。將制備得到的三乙酰沒食子酰氯、藍(lán)莓花青素提取樣品和吡啶以摩爾比5∶1∶5溶于二氧六環(huán)中,50℃回流反應(yīng)4h,反應(yīng)過程中需要不斷攪拌。反應(yīng)結(jié)束后,減壓蒸出二氧六環(huán)和吡啶,加適量水稀釋,得到產(chǎn)物晶體。過濾出產(chǎn)物,反復(fù)水洗,抽濾,晾干,真空干燥,得到酰化花青素的中間產(chǎn)物三乙酰沒食子酰化花青素。
將三乙酰沒食子酰化花青素溶于適量丙酮,在冰浴中降溫至0℃,攪拌滴加稀氫氧化鈉溶液,控制pH為8.5,于0℃靜置3h。然后再用鹽酸溶液酸化至pH為3,旋蒸除去丙酮,析出固形物,過濾后將固體產(chǎn)物溶于乙酸乙酯,酯層用水洗滌,旋蒸除去乙酸乙酯,得到?jīng)]食子酰化花青素。
1.2.4 紅外光譜掃描 通過KBr壓片法,運(yùn)用傅里葉變換紅外光譜儀對原花青素提取物、酰化中間產(chǎn)物和酰化花青素進(jìn)行紅外光譜掃描,波長范圍從4000~400cm-1,分辨率在2cm-1,將得到的譜圖進(jìn)行比較和鑒別。
1.2.5 HPLC測定酰化程度 將沒食子酸酰化花青素溶于質(zhì)量分?jǐn)?shù)10%的氫氧化鈉溶液中,完全水解后,用HPLC測定水解液中沒食子酸含量,并計(jì)算沒食子酰化程度。色譜柱ZORBAX Eclipse XDB-C18;柱溫30℃;檢測波長272nm;進(jìn)樣量10μL;流速0.6mL/min。洗脫條件:0min,3%A(甲醇),97%B(水,1.5%乙酸);線性變化至45min,57%A,43%B。
1.2.6 DPPH清除實(shí)驗(yàn) 參考Chu等[13]方法,有改動(dòng)。將DPPH(1,1-二苯基-2-苦基苯肼)配制成200μmol/L的乙醇溶液。原花青素和沒食子酸酰化花青素用乙醇配制成不同濃度梯度溶液待測。將2mL的DPPH溶液和2mL需測試的溶液加入到同一帶塞口的試管中,混勻,在暗處靜置30min,在517nm波長處通過分光光度計(jì)處測量DPPH的殘留量。抗壞血酸用作正相對照。DPPH清除率按計(jì)算式為:

式中,AS為樣品管在517nm下吸光值;A0為空白管在517nm下吸光值。
同時(shí)測定沒食子酰化酸花青素、花青素提取物及抗壞血酸清除DPPH自由基反應(yīng)前7min的反應(yīng)進(jìn)程。
1.2.7 超氧陰離子清除實(shí)驗(yàn) 參考Sun等[14]方法,有改動(dòng)。用10mmol/L鹽酸配制6mmol/L鄰苯三酚溶液。首先測定鄰苯三酚自氧化速率。將4.5mL 100mmol/L Tris-HCl與4.2mL去離子水混合,25℃水浴20min,加入0.3mL鄰苯三酚溶液。在325nm處測定反應(yīng)前4min的吸光值,半分鐘讀數(shù)一次。繪制時(shí)間-吸光值曲線,曲線為鄰苯三酚自氧化速率,即每分鐘吸光值改變量(ΔA/min)。然后測定酰化花青素和原花青素對鄰苯三酚自氧化的抑制率。其他條件不變,反應(yīng)體系中的2mL去離子水用不同濃度的樣品液代替。Tris-HCl溶液用作零點(diǎn)參比,同樣以抗壞血酸作為正相對照。超氧陰離子清除率計(jì)算式為:

式中,k0表示鄰苯三酚自氧化速率(ΔA/min);ki表示待測樣品存在時(shí)的氧化速率(ΔA/min)。
1.2.8 脂質(zhì)過氧化抑制實(shí)驗(yàn) 參考李衛(wèi)等[15]和Lo等[16]方法,有改動(dòng)。在冰浴超聲波振蕩環(huán)境下,用pH7.4的磷酸緩沖溶液配制10mg/mL卵磷脂溶液。配制TTH溶液:15g三氯乙酸,0.37g硫代巴比妥酸,2.1mL的12mol/L鹽酸一次加入100mL去離子水中。將1mL卵磷脂溶液和1mL 0.4mmol/L硫酸亞鐵溶液混合,再加入1mL不同濃度的待測溶液,將反應(yīng)管在37℃下避光保溫60min。隨后加入2mL TTH溶液,100℃加熱15min,終止反應(yīng)。將混合液離心3000r/min,15min,測定上清液在532nm下吸光值。磷酸緩沖液作參比,抗壞血酸作正相對照。脂質(zhì)過氧化抑制率的計(jì)算式為:

式中,AS為樣品管在532nm下吸光值;A0為空白管在532nm下吸光值。
2 結(jié)果與討論
2.1 酰化反應(yīng)
由于受到基團(tuán)活性及空間位阻的影響,需要先將沒食子酸制備成酰氯才能成功與花青素分子結(jié)合。在沒食子酰氯制備工程中,為避免沒食子酸分子的羥基在反應(yīng)中被破壞,采用先將其與保護(hù)基團(tuán)結(jié)合,反應(yīng)結(jié)束后再將保護(hù)基團(tuán)水解掉的方法。實(shí)驗(yàn)中先將沒食子酸與乙酸酐反應(yīng),將三個(gè)羥基用乙酰基保護(hù)起來,然后再制備酰氯,反應(yīng)路線如圖2所示,最后再將乙酰基在溫和條件下水解去除。

圖2 三乙酰沒食子酰氯合成路線Fig.2 Synthetic route of triacetyl gallic acid chloride
毛細(xì)管法測得三乙酰沒食子酸熔點(diǎn)168~171℃,三乙酰沒食子酸氯熔點(diǎn)105~107℃,與文獻(xiàn)資料[17]數(shù)據(jù)相符。在實(shí)驗(yàn)過程中,有以下幾點(diǎn)需要特別注意以保證實(shí)驗(yàn)成功:a.花青素層析柱純化洗脫后,應(yīng)充分除去花青素提取液中含有的殘余甲醇;b.在整個(gè)酰基化反應(yīng)過程中,應(yīng)保持反應(yīng)體系完全無水;c.若三乙酰沒食子酸熔點(diǎn)區(qū)間較大,可利用堿溶酸沉重結(jié)晶法進(jìn)一步純化,縮小三乙酰沒食子酸熔點(diǎn)區(qū)間,重復(fù)進(jìn)行熔點(diǎn)測定實(shí)驗(yàn)是核實(shí)重結(jié)晶是否成功的關(guān)鍵;d.二氧六環(huán)的選擇非常重要,它對于酰氯和花青素有合適的沸點(diǎn)和很好的溶解能力,可以作為酰基化反應(yīng)的溶劑。
2.2 紅外譜圖與酰化度

圖3 藍(lán)莓花青素(a)、沒食子酰化花青素(b)、三乙酰沒食子酰化花青素(c)的紅外光譜圖Fig.3 Infrared spectrum of blueberry anthocyanins(a),gallic acyl anthocyanins(b)and triacetyl gallic acyl anthocyanins(c)
藍(lán)莓花青素(a)、沒食子酸花青素(b)和三乙酰沒食子酸花青素(c)的紅外光譜圖如圖3所示。這三者的光譜圖顯示出一些共同點(diǎn):處于3400~3420cm-1范圍內(nèi)的又寬又強(qiáng)的峰對應(yīng)的是芳香環(huán)和糖基上面的羥基的伸縮振動(dòng);在2929cm-1處的信號(hào)峰表示的是亞甲基伸縮振動(dòng);苯環(huán)和雜環(huán)骨架結(jié)構(gòu)的伸縮振動(dòng)體現(xiàn)為在1620、1522、1447cm-1附近的信號(hào)峰。然而,在于三個(gè)光譜圖中可以看到一些明顯的不同信號(hào),在1700~1780cm-1處,沒食子酰化花青素和三乙酰沒食子酸花青素有吸收峰,但是原花青素的譜線在此處并沒有吸收峰,而這些信號(hào)正好證明酯羰基的存在,同時(shí),因?yàn)轷ヴ驶c苯環(huán)共軛,信號(hào)峰向低頻移動(dòng)。另外,沒食子酸花青素、三乙酰沒食子酸花青素在1322、1201、1184cm-1處的譜峰明顯比花青素要強(qiáng)。在1201、1184cm-1處的信號(hào)峰對應(yīng)著C-O-C基團(tuán)的對稱與反對稱伸縮振動(dòng),而這兩處的信號(hào)被稱為“酯譜帶”,可用以定性酯基基團(tuán)。一般來講,酯基的特征譜帶是C=O和C-OC基團(tuán)的伸縮振動(dòng)峰。對比b和c的譜圖,因?yàn)閎中的保護(hù)基團(tuán)被除去,所以在b的波譜圖中酯基的特征峰明顯地變?nèi)酢M瑫r(shí),在1433、1373cm-1處的甲基(與羰基相連接的)特征峰也以證明b中的保護(hù)基團(tuán)已經(jīng)被除去。
依據(jù)1.2.5步驟,通過高效液相色譜法測定了酰化花青素水解液中的沒食子酸含量。由結(jié)果計(jì)算得,每0.1g沒食子酸酰化花青素包含(0.26±0.05)mmol沒食子酸,大約1分子的花青素和2分子沒食子酸進(jìn)行了結(jié)合(以矢車菊素-3-O-葡萄糖苷分子量進(jìn)行計(jì)算)。
2.3 DPPH自由基清除實(shí)驗(yàn)
DPPH自由基是一類穩(wěn)定的有機(jī)氮自由基,其醇溶液呈現(xiàn)紫色,在517nm處有很強(qiáng)的吸收。DPPH法是由Gadow最先創(chuàng)建的,是目前公認(rèn)的評(píng)價(jià)植物化學(xué)物質(zhì)抗氧化性的方法,并且可以在短時(shí)間內(nèi)得出實(shí)驗(yàn)結(jié)果[18]。按1.2.6步驟,測定了原花青素和酰化花青素的自由基清除率,結(jié)果如圖4所示,三者對于清除DPPH自由基均具有明顯效果,清除率隨著濃度的升高均明顯增強(qiáng)。半抑制濃度(IC50)常被用來表示抗氧化劑清除自由基的能力,IC50數(shù)值越小,表明其抗氧化能力越強(qiáng)。藍(lán)莓花青素、沒食子酰化花青素和抗壞血酸的IC50分別為39.8、26.8、45.1μg/mL,對比而言,明顯可以看出沒食子酸酰化花青素清除自由基的能力最強(qiáng),藍(lán)莓花青素提取物的自由基清除能力比抗壞血酸稍強(qiáng)。在高濃度下,抗壞血酸清除自由基能力呈現(xiàn)出一定的線性關(guān)系,不同的是,沒食子酸酰化花青素和藍(lán)莓花青素提取物在濃度接近90%時(shí),自由基清除率上升較慢。

圖4 藍(lán)莓花青素、沒食子酸酰化花青素、抗壞血酸對DPPH自由基的清除率Fig.4 Scavenging activity on DPPH free radical of blueberry anthocyanin,gallic acyl anthocyanins and ascorbic acid

圖5 藍(lán)莓花青素、沒食子酸酰化花青素、抗壞血酸清除DPPH自由基的反應(yīng)進(jìn)度Fig.5 The reaction time course of scavenging on DPPH free radical by blueberry anthocyanins,gallic acyl anthocyanins(GAA)and ascorbic acid
測定了前7min內(nèi)DPPH自由基清除實(shí)驗(yàn)的反應(yīng)進(jìn)度,參與反應(yīng)各物質(zhì)加入體積和DPPH初始濃度保持與清除率實(shí)驗(yàn)一致,以藍(lán)莓花青素提取物、沒食子酸酰化花青素和抗壞血酸的IC50作為反應(yīng)濃度,結(jié)果如圖5所示。三者的反應(yīng)速率不同,抗壞血酸清除DPPH自由基的反應(yīng)時(shí)間較難確定,其反應(yīng)在很短時(shí)間內(nèi)就已經(jīng)完成。相比之下,藍(lán)莓花青素提取物和沒食子酸酰化花青素的反應(yīng)速率比較緩慢。對于藍(lán)莓花青素而言,反應(yīng)前4min吸光值持續(xù)明顯降低。而沒食子酰化花青素的反應(yīng)時(shí)間比藍(lán)莓花青素短,觀察可知,反應(yīng)3min時(shí)吸光值下降已趨于停止。綜上所述,通過酰基化反應(yīng)后,沒食子酰化花青素對DPPH自由基清除能力與清除速率均比藍(lán)莓花青素有所提高。
2.4 超氧陰離子清除實(shí)驗(yàn)
在堿性溶液中,鄰苯三酚可迅速發(fā)生自氧化鏈?zhǔn)椒磻?yīng),產(chǎn)生一系列中間產(chǎn)物和超氧陰離子但在反應(yīng)體系中存在清除劑的情況下,清除劑使生成的發(fā)生歧化反應(yīng)轉(zhuǎn)化為O2和H2O2,使鄰苯三酚自氧化速率降低。在本實(shí)驗(yàn)條件下鄰苯三酚自氧化速率為0.1524ΔA/min,其時(shí)間-吸光值曲線線性關(guān)系良好,R2=0.9984。如圖6所示,三者對于超氧陰離子有明顯清除作用,但在清除能力上顯示出明顯不同。藍(lán)莓花青素、沒食子酰化花青素和抗壞血酸清除超氧陰離子的IC50值分別為27.0、17.5、51.2μg/mL,清除超氧陰離子的能力依次為:沒食子酰化花青素>藍(lán)莓花青素>抗壞血酸。此外,對于沒食子酰化花青素(R2=0.9280,濃度低于60μg/mL時(shí))和抗壞血酸(R2= 0.9900)而言,濃度-清除率曲線線性關(guān)系較好,而藍(lán)莓花青素(R2=0.7319)線性趨勢較差。
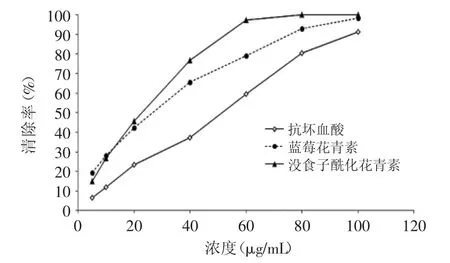
圖6 藍(lán)莓花青素、沒食子酸酰化花青素、抗壞血酸清除對的清除率
2.5 脂質(zhì)過氧氧化抑制實(shí)驗(yàn)

圖7 藍(lán)莓花青素、沒食子酸酰化花青素、抗壞血酸清除對脂質(zhì)過氧氧化的抑制作用Fig.7 Inhibition activity on lipid peroxidation of blueberry anthocyanin,gallic acyl anthocyanin and ascorbic acid
卵磷脂通常被用作細(xì)胞模型而進(jìn)行體外的脂質(zhì)過氧化的研究,卵磷脂所含的極低密度脂蛋白和低密度脂蛋白中的不飽和脂肪酸在鐵離子的催化作用下,能發(fā)生過氧化,由此建立的鐵離子誘導(dǎo)卵磷脂脂質(zhì)體過氧化模型,可用以評(píng)價(jià)花青素的抗氧化活性[19]。在卵磷脂脂質(zhì)體過氧化實(shí)驗(yàn)中,在532nm出檢測硫代巴比妥酸反應(yīng)物質(zhì)可以測定脂質(zhì)過氧化程度。如圖7所示,三者都顯示出對脂質(zhì)過氧化的抑制能力,但能力強(qiáng)弱明顯不同。藍(lán)莓花青素、沒食子酰化花青素和抗壞血酸抑制脂質(zhì)過氧化的IC50值分別219.7、171.7、1084.8μg/mL。抑制脂質(zhì)過氧化能力由強(qiáng)到弱同樣為:沒食子酰化花青素>藍(lán)莓花青素>抗壞血酸。由IC50值可知,沒食子酰花青素抑制能力大約為抗壞血酸的6.3倍,藍(lán)莓花青素抑制能力是抗壞血酸的將近5倍。在濃度為20μg/mL時(shí),沒食子酰花青素抑制能力比藍(lán)莓花青素和抗壞血酸分別高出26.8%和266%;在400μg/mL時(shí),分別高15.7%和149%。結(jié)果表明沒食子酰化花青素具有很強(qiáng)的抑制脂質(zhì)過氧化活性。
3 結(jié)論
原花青素的抗氧化性已經(jīng)得到了廣泛研究,然而對于化學(xué)修飾花青素的研究卻鮮有報(bào)道。本實(shí)驗(yàn)以三乙酰沒食子酰氯作為酰基化劑,對藍(lán)莓花青素提取物進(jìn)行酰基化反應(yīng),制得沒食子酰化花青素。對原花青素提取物、酰化中間產(chǎn)物和酰化花青素進(jìn)行了紅外光譜掃描,對比三者譜圖,證實(shí)了酰基化實(shí)驗(yàn)的成功,酰化程度為每0.1g沒食子酸酰化花青素包含0.26mmol沒食子酸。分別通過DPPH法、鄰苯三酚自氧化法、卵磷脂脂質(zhì)體法測定了酰化花色苷對于清除自由基、清除超氧陰離子和抑制脂質(zhì)體過氧氧化的能力,酰化花色苷對于以上3個(gè)實(shí)驗(yàn)的IC50分別為26.8、17.5、171.7μg/mL;藍(lán)莓花青素為39.8、27.0、219.7μg/mL;抗壞血酸為45.1、51.2、1084.8μg/mL。實(shí)驗(yàn)表明沒食子酸酰化花青素方法切實(shí)可行,產(chǎn)物沒食子酸酰化花青素的抗氧化性得到提升。
[1]Chen J,Sun H N,Sun A D,et al.Studies of the protective effect and antioxidant mechanism of blueberry anthocyanins in a CCl4-induced liver injury model in mice[J].Food and Agricultural Immunology,2012,23:352-362.
[2]Tsuda T,Watanabe M,Ohshima K,et al.Antioxidative activity of the anthocyanin pigments cyaniding 3-O-β-D-glucoside and cyanidin[J].Journal of Agricultural and Food Chemistry,1994,42:2407-2410.
[3]Aoki H,Wada K,Kuze N,et al.Inhibitory Effect of Anthocyanin Colors on Mutagenicity Induced by 2-Amino-1-Methyl-6-Phenylimidazo[4,5-b]Pyridine(PhlP)[J].Foods and Food Ingredients Journal of Japan,2004,209:240-246.
[4]Malik M,Zhao C,Schoene N,et al.Anthocyanin-Rich Extract From Aronia meloncarpa E.Induces a Cell Cycle Block in Colon Cancer but Not Normal Colonic Cells[J].Nutrition and Cancer,2003,46:186-196.
[5]Wang Q,Xia M,Liu C,Guo H,et al.Cyanidin-3-O-betaglucoside inhibits iNOS and COX-2 expression by inducing liver X receptor alpha activation in THP-1 macrophages[J].Life Sciences,2008,83:176-184.
[6]Xia M,Ling W H,Zhu H L,et al.Anthocyanin attenuates CD40-mediated endothelial cell activation and apoptosis by inhibiting CD40-induced MAPK activation[J].Atherosclerosis,2009,202:41-47.
[7]Ghosh D,Konishi T.Anthocyanins and anthocyanin-rich extracts:role in diabetes and eye function[J].Asia Pacific Journal of Clinical Nutrition,2007,16:200-208.
[8]Clifford M N.Anthocyanins-nature,occurrence,and dietary burden[J].Journal of the Science of Food and Agriculture,2000,80:1063-1072.
[9]Brouillard R,Mazza G,Saad Z,et al.The copigmentation reaction of anthocyanins:a microprobe for the structural study of aqueous solutions[J].Journal of American Chemical Society,1989,11:2604-2610.
[10]Azevedo J,Teixeira N,Oliveira J,et al.Effect of sugar acylation on the antioxidant properties of Vitis vinifera red grape malvidin-3-glucoside[J].International Journal of Food Science and Technology,2011,46:343-349.
[11]Fossen T,Cabrita L,Andersen O M.Colour and stability of pure anthoycanins influenced by pH including the alkaline region[J].Food Chemistry,1998,63:435-440.
[12]徐曼,陳笳鴻,汪詠梅,等.落葉松原花青素的沒食子酰化及其抗氧化活性增強(qiáng)效應(yīng)[J].林產(chǎn)化學(xué)與工業(yè),2010,30(6):55-60.
[13]Chu Y H,Chang C L,Hus H F.Flavonoid content of several vegetables and their antioxidant activity[J].Journal of the Science of Food and Agriculture,2000,80:561-566.
[14]Sun J,He H,Xie B J.Novel antioxidant peptides from fermented mushroom Ganoderma lucidum[J].Journal of Agricultural and Food Chemistry,2004,52:6646-6652.
[15]李衛(wèi),鄭成,寧正祥,等.酯化修飾對二氫楊梅素性能的影響[J].食品科學(xué),2011,32(1):66-69.
[16]Lo K M,Cheung C K.Antioxidant activity of extracts from the fruiting bodies of Agrocybe aegerita varalba[J].Food Chemistry,2005,89:533-539.
[17]Elsinghorst P W,Cieslik J S,Mohr K,et al.First gallaminetacrine hybird:Design and characterization at cholinesterases and the M2 muscarinic receptor[J].Journal of Medicinal Chemistry,2007,50:5685-5695.
[18]凌文華,郭紅輝.植物花色苷[M].北京:科學(xué)出版社,2009.
[19]姜平平,呂曉玲,朱惠麗.花色昔類物質(zhì)分離鑒定方法[J].中國食品添加劑,2003,24(4):108-111.
Acylation reaction of blueberry anthocyanins with gallic acid and evaluation of its antioxidant activities
LI Lu-ning,CHEN Wei,ZHAO Li-yi,SUN Ai-dong*
(College of Biological Sciences and Biotechnology,Beijing Forestry University,Beijing 100083,China)
Gallic acyl anthocyanin(GAA)was prepared by chemical acylation with blueberry anthocyanins and gallic acid,and triacetyl gallic acid chloride was synthetized as a relevant acylating agent.The reaction process was monitored by thin-layer chromatography,and purity of the product was determined by melting point measured with capillary tube method.The infrared spectra of GAA,triacetyl gallic acyl anthocyanins,and original anthocyanins were compared and the results proved synthesis successfully.Acylation degree was measured with HPLC.The antioxidant activity of GAA was tested through comparison with original blueberry anthocyanin extracts by using different techniques.The antiradical activity,reducing O2-·activity,and inhibition toward lipid peroxidation of GAA were measured by using 1,1-diphenyl-2-picrylhydrazyl,pyrogallot autoxidation,and lecithin liposome method,respectively.The IC50values of GAA for the aforementioned assays were 26.8,17.5,171.7μg/mL,respectively.The IC50values of the original anthocyanin extracts were 39.8,27.0,219.7μg/mL,respectively.The IC50values of ascorbic acid were 45.1,51.2,1084.8μg/mL,respectively. Results showed that the acylation method could increase the antioxidant activity of original anthocyanin extracts.
blueberry;anthocyanin;gallic acid;antioxidant
TS255.1
A
1002-0306(2014)06-0102-05
2013-06-20 *通訊聯(lián)系人
李路寧(1989-),男,碩士研究生,研究方向:天然產(chǎn)物開發(fā)與利用。
國家自然科學(xué)基金(31271981)。

