我院2012年1月– 2013年12月953例藥品不良反應報告分析
苗秋麗,閆薈羽,張四喜,宋燕青(吉林大學第一醫院藥劑科,吉林 長春 130021)
我院2012年1月– 2013年12月953例藥品不良反應報告分析
苗秋麗,閆薈羽,張四喜,宋燕青(吉林大學第一醫院藥劑科,吉林 長春 130021)
目的:了解我院藥品不良反應(ADR)發生的一般規律及特點,為臨床合理用藥提供參考。方法:采用回顧性分析方法,對我院2012年1月– 2013年12月上報的953例ADR報告從ADR發生的年齡與性別分布、給藥途徑、藥品種類、累及的系統/器官及臨床表現、ADR報告類型及ADR轉歸等方面進行統計分析。結果:953例ADR報告中,男性458例(48.06%),女性495例(51.94%);ADR在各年齡段均有分布,51 ~ 60歲者ADR發生率最高,有192例,占20.15%;引起ADR藥品以抗感染藥物居多,且主要為頭孢菌素類,其次為抗腫瘤藥物;引發ADR的給藥途徑以靜脈滴注為主,占71.14%;ADR最常累及系統/器官為消化系統,占40.20%;一般ADR占98.22%,大多好轉或治愈;新的ADR 2例;嚴重ADR 15例,其中11例留有后遺癥,拉莫三嗪片引起死亡1例。結論:臨床應高度重視ADR監測和報告工作,以減少或避免ADR重復發生,促進合理用藥。
藥品不良反應;報告;分析
藥品不良反應(ADR)是指按正常用法用量應用藥物進行預防、診斷或治療疾病過程中,發生與治療目的無關的有害反應[1]。ADR與醫療質量及醫療安全息息相關。2012年1月– 2013年12月我院共上報不良反應953例,且均經吉林省ADR監測中心評估認定上報至國家藥品不良反應監測系統。本文對953例ADR報告進行回顧性分析,以了解我院ADR發生規律及特點,為臨床安全合理用藥提供參考。
1 資料與方法
以我院2012年1月– 2013年12月上報的953例ADR為研究對象,從ADR發生的年齡與性別分布、給藥途徑、藥品種類[2]、累及系統/器官及臨床表現、ADR報告類型[3]及轉歸等方面進行統計分析。
2 結果
2.1 發生ADR患者的年齡與性別分布
ADR發生與患者性別無顯著相關性,953例ADR報告中,男性458例(48.06%),女性495例(51.94%)。患者年齡最小者3個月,最大者95歲。發生ADR的年齡與性別分布見表1。
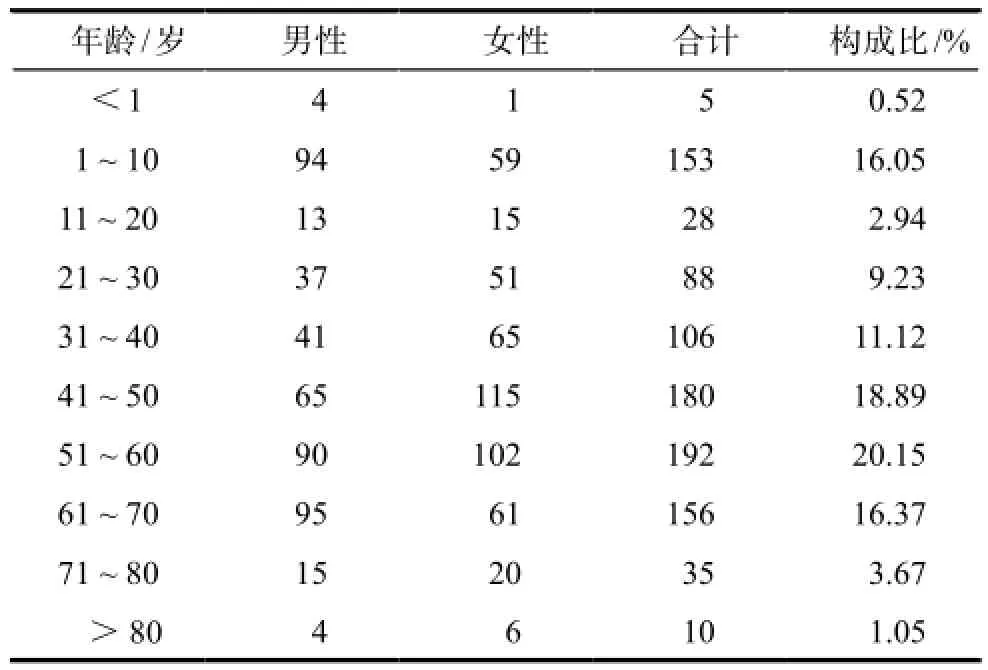
表1 發生ADR患者的年齡與性別分布Tab 1 Distribution of age and gender of patients in ADRs
2.2 引發ADR的給藥途徑分布
953例ADR報告中,靜脈滴注引發ADR病例最多,共678例(71.14%),其次為口服和靜脈推注,分別為115例(12.07%)和110例(11.54%)。通過局部外用、皮內注射、肌內注射、皮下注射、鼻飼、腔道給藥引發的ADR相對較少。
2.3 引發ADR的藥品種類分布
引發ADR藥品種類分布詳見表2。抗感染藥物引發ADR最多,為350例(36.73%),主要為頭孢菌素類,共計191例,占抗感染藥物總例數的54.57%,引起ADR抗感染藥物種類分布見表3。引發ADR藥品居第二位的為抗腫瘤藥物,共計228例(23.93%)。其中作用于DNA化學結構的藥物引起ADR最多,有128例,占抗腫瘤藥物總例數的56.14%,引起ADR抗腫瘤藥物種類分布見表4。

表2 引發ADR藥品種類分布Tab 2 Distribution of drug types in ADRs

表3 引起ADR抗感染藥物種類分布Tab 3 Distribution of anti-infectious drugs in ADRs

表4 引起ADR抗腫瘤藥物種類分布Tab 4 Distribution of anti-cancer drugs in ADRs
2.4 ADR累及系統/器官及臨床表現
ADR累及系統/器官中,以消化系統損害最多,主要表現為惡心、嘔吐、腹痛、腹脹、腹瀉、肝損傷等。其次為皮膚及其附件損害,主要表現為皮疹、皮膚瘙癢、皮炎、皮膚刺痛。詳見表5。

表5 ADR累及系統/器官及主要臨床表現Tab 5 Organs or systems involved in ADRs and main clinical manifestations
2.5 ADR報告類型及轉歸
953例ADR報告中,一般ADR 936例(98.22%);新的ADR 2例(0.21%);嚴重ADR 15例(1.57%),涉及7個藥品品種,941例患者達到臨床治愈或好轉,11例留有后遺癥,1例死亡。引發嚴重ADR的相關藥品、臨床表現及轉歸見表6。

表6 引發嚴重ADR相關藥品、臨床表現及轉歸Tab 6 Related drugs, clinical manifestation and outcome of severe ADRs
3 討論
3.1 性別及年齡對ADR的影響
通過對我院2012年1月– 2013年12月上報的ADR報告進行統計分析,結果顯示ADR發生與患者性別無顯著相關性,ADR可發生于各個年齡段。由于老年及兒童患者與正常成人體內代謝能力、血漿與藥物的結合能力以及機體對藥物的敏感程度不同,從而導致ADR的概率不同[4]。因此,老年及兒童患者用藥,應根據病情制定合理的用藥方案,確保用藥的安全性,以降低ADR發生率。
3.2 給藥途徑對ADR的影響
最易引發ADR的給藥途徑是靜脈注射,可能由于靜脈用藥時藥物直接進入血液循環,生物利用度高,起效快,因此更易導致ADR;口服及其他給藥途徑ADR發生率相對較低,可見臨床上選擇給藥途徑與ADR發生有顯著的相關性。臨床醫務人員應嚴格掌握臨床操作規程,注意藥物配伍禁忌,根據患者病情選擇最適宜的給藥途徑[5]。
3.3 涉及的藥品種類及品種分析
引發ADR藥品中,以抗感染及抗腫瘤藥物居多。頭孢菌素類由于抗菌譜廣,抗菌作用強,對厭氧菌有效,且耐酶、低毒,是臨床選用最多的抗感染藥物。喹諾酮類由于其抗菌譜廣,抗菌作用強,不易耐藥,不需做皮試等特點,在臨床上也廣泛應用。抗感染藥物所致ADR與藥物臨床使用頻率密切相關,因此醫院必須加強抗感染藥物管理,要求臨床醫生嚴格遵守《抗菌藥物臨床應用指導原則》[6],杜絕無指征應用抗感染藥物,減少ADR發生。
大多數抗腫瘤藥物均為細胞毒性藥物,且治療窗窄,治療過程中藥代學和藥效學很小的改變就會產生嚴重的臨床結果[7]。另外,腫瘤患者經常同時患有多種疾病,需聯合用藥,這也進一步增加了ADR的發生概率。發生ADR最多的抗腫瘤藥物為作用于DNA化學結構的藥物順鉑,其最嚴重不良反應為不可逆的腎功能障礙,嚴重時腎小管壞死導致無尿和尿毒癥;消化系統:包括惡心、嘔吐、食欲減退和腹瀉等,不良反應常在給藥后1 ~ 6 h內發生;造血系統:表現為白細胞和(或)血小板減少,一般與用藥劑量有關,骨髓抑制一般在3周左右達高峰。另外,作用于有絲分裂M期干擾微管蛋白合成的藥物紫杉醇ADR發生率也較高,這是由于紫杉醇的溶媒聚氧乙基蓖麻油輸入人體后,易導致組胺釋放,引起過敏反應。雖然臨床上在輸注紫杉醇前會進行預處理,但仍會出現過敏反應,所以使用時仍需密切監測患者情況。
3.4 ADR累及的系統/器官及主要臨床表現
ADR累及系統/器官主要為消化系統,其次為皮膚及其附件,可能是這些系統/器官的ADR較易識別,不易漏報。引起消化系統不良反應的藥物主要為抗腫瘤藥物,表現為惡心、嘔吐、腹痛、腹脹、腹瀉、肝損傷等,臨床通常給予患者保肝、保胃、止吐等對癥支持治療。引起皮膚及其附件不良反應的藥物大部分為頭孢菌素、青霉素等一些抗感染類藥物,輕微ADR在停藥一段時間后,癥狀均會自行消失。一些較重的癥狀,可適當用藥治療。
3.5 嚴重ADR分析
一般ADR可以預測和控制,但嚴重ADR可造成機體重度損害[8]。我院收集的不良反應中嚴重ADR有15例,其中卡馬西平片、奧卡西平口服液、替吉奧膠囊引起皮膚黏膜嚴重損害,同時出現血象異常,11例留有后遺癥包括:甲氨蝶呤注射液引起面部痤瘡1例,嚴重脫發2例;枸櫞酸他莫昔芬片引起子宮內膜增生、內膜息肉1例。他莫昔芬是一種非甾體類復合物,具有激動和拮抗雌激素的雙重作用,是絕經后婦女乳腺癌內分泌治療的首選藥物。根據乳腺癌患者的激素水平,他莫昔芬會導致患者子宮內膜發生不同的形態學變化,包括子宮內膜增生、息肉形成、子宮內膜萎縮、間質蛻膜化及子宮內膜癌等,因此,應用他莫昔芬時要嚴格監測子宮內膜厚度。替吉奧膠囊導致表皮壞死松解癥1例,色素沉著2例,其中表皮壞死松解癥患者起初表現為輕度皮炎,由于停藥不及時,很快發展為表皮壞死松解癥,皮膚大面積破潰壞死,經過10余天治療,慢慢恢復,但留下疤痕。因此在應用替吉奧膠囊時,一定要密切觀察患者皮膚改變狀況,一旦出現過敏跡象,要及時停藥并對癥處理,以免發生嚴重不良反應。注射用硼替佐米引起惡心、腹瀉、眩暈,手腳麻木伴燒灼感4例,硼替佐米是第一個進入臨床的可逆性蛋白酶體抑制劑,應用后引起周圍神經病變發生率高達50%,嚴重影響患者生存質量,其周圍神經毒性可能與其抗血管生成、增強神經末梢蛋白酶的抑制作用以及破壞神經細胞軸突內正常蛋白的轉運有關。目前有臨床數據顯示,阿米福汀對硼替佐米引起的毒副反應有一定的預防保護作用[9]。
拉莫三嗪片引起嚴重ADR導致患者死亡1例,患者在家中口服拉莫三嗪片,3 d后雙下肢出現紅斑,自行口服脫敏藥物,癥狀略好轉,后繼續服用拉莫三嗪,2 d后雙下肢再次出現紅斑、水皰,繼而水皰破潰、結痂、脫屑,并迅速累及全身,同時口腔黏膜破潰并伴發熱。入我院皮膚科后,詢問病史,考慮為對拉莫三嗪過敏所致,給予抗過敏、抗感染、抗炎、調節免疫及對癥支持治療。入院2 d后患者出現神志不清,轉入神經內科NCU。入院第4天上午患者前胸、腋下、頸部及外耳道出現黃色膿性分泌物,全院會診后考慮存在低血容量休克及感染性休克,給予補液抗休克等對癥支持治療。入院第7天出現呼吸淺快,面色發白,血壓及血氧飽和度下降,病情危重,于當日死亡。拉莫三嗪屬于苯三嗪類抗癲癇藥物,為電壓依賴性鈉離子通道阻滯劑,通過減少鈉離子內流穩定神經細胞膜,抑制谷氨酸(興奮性氨基酸)的釋放而發揮治療作用。拉莫三嗪常見的不良反應有:頭痛、頭暈、嗜睡、視物模糊、共濟失調和皮疹;其中皮疹發生率5% ~ 10%,多為輕度,但嚴重致命性皮疹偶有發生。該患者除剝脫性皮炎外,還出現了感染癥狀,考慮可能為高敏體質。拉莫三嗪作為抗癲癇治療的首選藥品廣泛應用于一線單藥治療,對于其嚴重皮膚反應臨床上應引起高度重視。
綜上所述,我院ADR發生率與患者年齡、患者自身體質、給藥途徑以及醫院合理用藥水平密切相關,醫院應進一步加強ADR監測和報告工作,盡量減少或避免ADR重復發生。
[1]衛生部.藥品不良反應報告和監測管理辦法[S].衛生部令[2011]81號.
[2]秦明明,陳奕,楊玲,等.某部隊醫院157例不良反應報告分析[J].西北藥學雜志,2012,27(6):595-597.
[3]閆薈羽,孫智輝,王繼萍,等.我院1557例藥品不良反應報告分析[J].中國藥房,2013,24(14):1310-1312.
[4]許江濤,蔡昭和.482例藥品不良反應報告相關因素分析與對策[J].中國醫院用藥評價與分析,2012,12(10):941-944.
[5]謝華,張桂林,王榮,等.2012年我院609例藥品不良反應報告分析[J].中國藥物應用與監測,2014,11(4):224-227.
[6]衛生部.抗菌藥物臨床應用指導原則[S].衛醫發[2004]285號.
[7]王曉輝,吳斌,趙東,等.肺癌化療出現嚴重藥品不良反應的用藥合理性分析[J].中國藥房,2011,22(18):1708-1711.
[8]廖慧.我院2006 – 2010年741例藥品不良反應報告分析[J].中國藥房,2011,22(46):4400-4402.
[9]張迎春,鄭智茵,陳均法,等.阿米福汀預防硼替佐米毒副作用的臨床觀察[J].浙江中醫藥大學學報,2013,37(4):407-409.
Analysis on 953 ADR reports of our hospital from January 2012 to December 2013
MIAO Qiu-li, YAN Hui-yu, ZHANG Si-xi, SONG Yan-qing(Department of Pharmacy, the First Hospital of Jilin University, Changchun 130021, China)
Objective:To investigate the feature and regularity of adverse drug reactions (ADRs) occurred in our hospital and provide reference for rational medication in clinic.Methods:A total of 953 ADR reports were collected and retrospectively analyzed from January 2012 to December 2013. The reports were classi fi ed and analyzed statistically in respect of the age and gender distribution of the patients, route of administration, the category of drugs, organs or systems involved in ADRs and main clinical manifestations, types and outcomes of ADRs, etc.Results:Among the 953 ADR cases, 458 cases (48.06%) were male and 495 cases (51.94%) were female. Totally 192 patients (20.15%) were 51 – 60 years old. Most of the ADRs were induced by anti-infective drugs (mainly in cephalosporins), and follwed by antitumor drugs; the main administration route was intravenous drip, accounting for 71.14%; most of ADRs commonly involved in digestive system, accounting for 40.20%. Moderate ADRs accounted for 98.22%, most of them were improved or cured. There were 2 new ADRs and 15 serious ADRs, including 11 cases of sequela, 1 case of lamotrigine-related death.Conclusion:Great importance should be attached to ADR monitoring and reporting, to reduce or avoid the occurrence of ADR, and promote rational drug use.
Adverse drug reaction; Report; Analysis
R969.3
A
1672 – 8157(2014)06 – 0372 – 04
2014-07-08
2014-09-26)
宋燕青,女,主管藥師,主要從事臨床藥學工作。E-mail:yaojikejdyy@163.com
苗秋麗,女,藥師,主要從事臨床藥學工作。E-mail:miaoql365@163.com

