產凝乳酶微生物的研究概況
李學朋,梁琪,師希雄,馮瑞章,張炎,文鵬程,張衛兵*
產凝乳酶微生物的研究概況
李學朋1,梁琪1,師希雄1,馮瑞章2,張炎1,文鵬程1,張衛兵1*
(1.甘肅農業大學食品科學與工程學院,甘肅蘭州730070;2.宜賓學院發酵資源與應用四川省高校重點實驗室,四川宜賓644000)
凝乳酶用途廣泛,其來源主要有動物凝乳酶、植物凝乳酶和微生物凝乳酶,微生物凝乳酶一直是凝乳酶研究的熱點。對近年來國內外產凝乳酶真菌、細菌和放線菌種類以及產凝乳酶微生物的選育的研究情況進行了綜述,以期為微生物凝乳酶的研究和開發提供參考。
凝乳酶;微生物;選育
凝乳酶是一種從未斷奶的小牛胃中發現的酸性蛋白酶,在食品、醫藥和飼料等方面都有應用[1]。凝乳酶的主要來源有動物源凝乳酶、植物源凝乳酶和微生物源凝乳酶。動物凝乳酶在干酪的生產中使用最早,應用最為廣泛,其中使用最廣泛的是小牛皺胃酶,用其生產干酪時凝乳效果好、出品率高,所產干酪硬度和彈性好、苦味少[2]。但由于原料缺乏,凝乳酶價格昂貴。植物凝乳酶凝乳作用強,脂肪損失少,收率較高,但制成的干酪帶有一定的苦味。微生物由于生長周期短,受氣候、地域、時間限制小,用其生產凝乳酶成本較低、提取方便、經濟效益高,可以節約動、植物資源,所以產凝乳酶微生物及其所產凝乳酶一直是人們研究的熱點,已經報道的產凝乳微生物包括真菌、細菌、放線菌等[3]。
1 產凝乳酶微生物種類
1.1 產凝乳酶真菌
20世紀60年代初人們開始研究微生物凝乳酶,已經發現產凝乳酶真菌有多種,其中主要包括米黑毛霉(Mucor miehei)、微小毛霉(Mucor pusillus)、栗疫菌(Endothia parasitica)、白腐菌(Trametes versicolor)、草酸青霉(Penicillium oxalicum)、米根霉(Rhizopus oryzae)、米曲霉(Aspergillus oryzae)等[4]。
1.1.1 米黑毛霉
米黑毛霉凝乳酶由于凝乳活力與蛋白水力的比值較高,廣泛應用于乳品工業[4]。已報道的產凝乳酶米黑毛霉有多種,包括米黑毛霉CBS 37065、米黑毛霉NRRL 3420、米黑毛霉NRRL 3169[5-8]等。STERNBERG M Z等[5]研究了產凝乳酶米黑毛霉NRRL 3420,結果表明,其分子質量為34~39ku,該酶為酸性蛋白酶,在酸性條件下穩定,不是金屬蛋白酶,硫酸鋁對酶有強烈抑制作用。LAGRANGE A等[6]純化并比較了米黑毛霉CBS 37065和米黑毛霉NRRL 3169凝乳酶的性質,兩者分子質量相同,但氨基酸序列不一致。SEKER S等[7]對米黑毛霉NRRL 3420連續發酵條件進行了研究,結果表明,連續發酵時需要每天補給D-葡萄糖0.625g、pH值不需要控制,轉速為400r/min,發酵液酶活可以達到1.24IU/mL。金娟男等[8]將經乙醇分步沉淀所制得的微小毛霉和米黑毛霉凝乳酶進行了比較,米黑毛霉凝乳酶的凝乳效果要好于微小毛霉凝乳酶,在高溫和酸性環境要比微小毛霉凝乳酶穩定。
1.1.2 微小毛霉
國內外對產凝乳酶微小毛霉的研究也較多。1968年,ARIMAK等[9]發現了產凝乳酶的微小毛霉(Mucorpusillus),并對微小毛霉凝乳酶的特性研究,發現其具有高活力,酶活可達到4650個酶活力單位。NOUANI A等[10]研究了溫度、pH值、CaCl2等因素對一株微小毛霉所產凝乳酶的影響,并與傳統動物源凝乳酶進行比較,結果表明,微小毛霉凝乳酶的分子質量為49ku,在65℃加熱30min后酶完全失活。最適作用溫度為50℃,高于傳統凝乳酶的42℃,其他特性與傳統動物源凝乳酶極為相似[11]。
矯慶華等[12]從19株真菌中篩出一株微小毛霉602,在含有50%~60%麩皮的半固體培養基中,起始pH 5.0~6.7,28℃培養96h,凝乳酶最高活力為17 000U/g麩皮。補加葡萄糖、蔗糖、硫酸銨、乳清粉均對酶的產生無顯著影響。酶的凝乳活力與蛋白水解活力作用的最適溫度均為65℃,此酶具有較高的凝乳活力對蛋白水解活力的比值,凝乳酶的pH值穩定范圍為4.0~8.0,凝乳酶在60℃保溫5min,活力完全喪失。微小毛霉凝乳酶經乙醇沉淀、CM-纖維素、DEAESephadex A25和Sepharose 2B柱層析純化后,酶的比活提高,蛋白質收率為17.9%。酶的分子質量為41.8ku,酶對血紅蛋白的米氏常數Km值為0.019mmol/L,酶的等電點為pH4.3。酶的化學修飾表明,酪氨酸、組氨酸、色氨酸、精氨酸以及巰基與酶的活性無關,天冬氨酸的羧基是酶的必需基團,故此酶是一種典型的天冬氨酸蛋白酶[12]。
1.1.3 栗疫菌
栗疫菌(Endothia parasitica)產凝乳酶研究相對較少。SARDINAS J L等[13]從381株細菌和540株真菌中篩選出了一株產凝乳酶的栗疫菌。栗疫菌凝乳酶分子質量為34~39ku;等電點為pH4.5;在60℃加熱5min后完全失活;在pH 5.0時最為穩定。在凝乳酶的蛋白水解作用中,栗疫菌凝乳酶能夠產生丙氨酸、精氨酸、谷氨酸、異亮氨酸、天冬氨酸等多種氨基酸,但不能產生色氨酸。HAGEMEYER K等[14]用2種方法對栗疫菌凝乳酶進行了純化,該酶在pH 4.0~5.0時很穩定,pH 7.0時不穩定,分子質量37.5ku,等電點為pH 4.6。LARSON M K等[15-16]研究了影響栗疫菌凝乳酶活力與穩定性的因素,包括pH值、溫度和底物濃度等。
1.1.4 根霉
產凝乳酶的根霉也是一個研究熱點。KUMAR S等[17]對一株米根霉的胞外凝乳酶進行了分離純化,并研究了其酶學特性。該酶經過硫酸銨鹽析、離子交換層析和凝膠層析之后,純化91倍,回收率為26%。酶的最適作用溫度為60℃,活化能為63.37J/mol,在30~45℃范圍內酶保持穩定;酶的最適作用pH為5.5,在pH 5.5~7.5范圍內凝乳酶保持了96%的活力。Ca2+的濃度和酶作用底物濃度與凝乳酶活力之間為雙曲線效應。以脫脂乳為反應底物時,酶的米氏常數Km為5mg/mL。該凝乳酶能夠被胃蛋白酶抑制劑抑制其凝乳酶活力,證明其為天門冬氨酸蛋白酶。吳進菊等[18]從中國曲中分離出產凝乳酶的根霉F34,進一步研究表明,根霉F34菌株凝乳酶最適作用溫度為50℃,最適作用pH值為5.5,Ca2+、Zn2+、Fe2+和Fe3+對凝乳活力有明顯促進作用,K+和Mg2+對凝乳活力促進作用不明顯,而Na+、Cu2+、Co2+和Li2+對凝乳活力有明顯抑制作用。經培養基和培養條件優化,確定了根霉F34產凝乳酶的最佳發酵培養基為米粉麩皮水解液4.5%,豆粉水解液4.0%,CaCl20.3%,KCl 0.5%;最適發酵條件:初始pH值為4.5,發酵溫度為34℃,培養時間為60h。滕國新等[19]采用體積分數60%和71%乙醇分級沉淀方法分離酒曲根霉(Rhizopussp.)052凝乳酶,酶蛋白總回收率可以達到51.9%。分別得到凝乳酶活力為14.55U/mg和18.44U/mg的兩種組分。進一步使用葡萄糖凝膠(Sephadex)G-100和DE-52提純凝乳酶,得到純酶蛋白根霉B4M2凝乳酶,分子質量為36.6ku。Edman降解法測定酶蛋白分子N-末端15個氨基酸為GTGSVPVTDYQNDVE。根霉B4M2凝乳酶在pH1~7范圍內、4℃條件下凝乳酶活力保持穩定。酶作用的最適溫度為40℃,55℃保持20min完全失去活性。根霉B4M2凝乳酶凝乳能力與小牛凝乳酶相近,蛋白水解能力介于小牛凝乳酶與蛋白酶之間。
1.1.5 其他
除了以上幾種研究較多的產凝乳酶真菌外,另外有報道某些米曲霉(Aspergillus oryzae)、黑曲霉(Aspergillus niger)、青霉(Penicillium)、白腐真菌(Trametes versicolor)、亞粘團串珠鐮刀(Fusarium subglutinans)、擔子菌(Basidiomycetes)、乳白耙菌(Irpex lacteus)、魯氏淀粉霉(Amylomyces rouxii)等也能產生凝乳酶[20-27]。
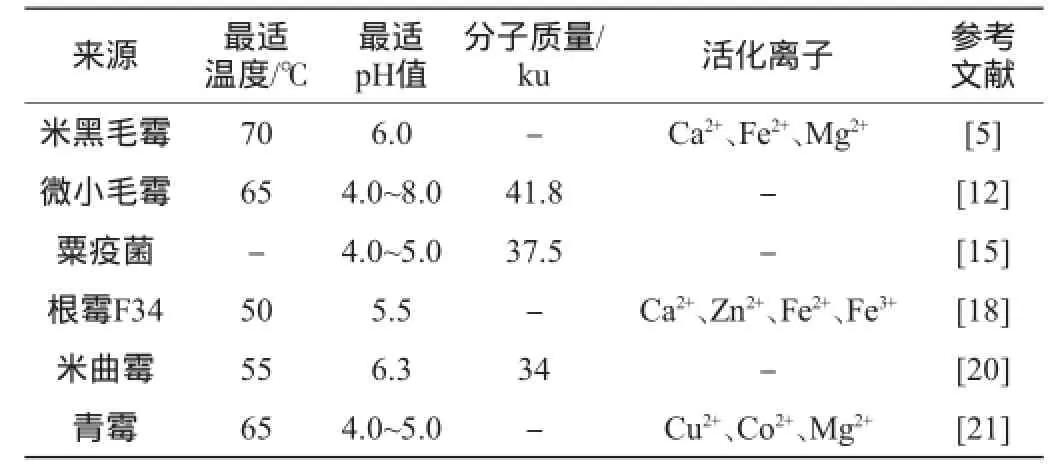
表1 不同真菌凝乳酶的特性Table 1 Characteristics of different fungi rennet
1.2 產凝乳酶細菌
國內外對產凝乳酶細菌的研究也比較早,主要集中在產凝乳酶細菌的分離、凝乳酶的酶學性質、分離純化和培養條件優化等。已報道的產凝乳細菌主要是芽孢桿菌屬的細菌。
1.2.1 多粘芽孢桿菌
最早報道的產凝乳酶細菌是多粘芽孢桿菌(Bacillus polymyxa),與小牛凝乳酶相比,多粘芽孢桿菌凝乳酶蛋白質水解程度大,乳清發生渾濁,干酪產生苦味。MATTA H等[28]報道了多粘芽孢桿菌(Bacillus polymyxa)B-17能夠產生胞外凝乳酶,且所產凝乳酶具有很好的耐熱性,最適作用溫度為50℃,最適pH為7.5,分子質量為30ku。
1.2.2 枯草芽孢桿菌
國內外報道較多的產凝乳酶細菌是枯草芽孢桿菌(Bacillus subtilis)。LAVU K R[29]通過凝膠過濾和離子交換層析將Bacillus subtilisK-26凝乳酶純化了24倍,經十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)凝膠電泳測定酶分子質量為27 000ku對κ-酪蛋白的Km為2.77mg/mL,酶最適作用pH 7.5,最適作用溫度60℃,60℃處理30min酶失活,乙二胺四乙酸二鈉(ethylene diamine tetraacetic acid,EDTA)可使酶不可逆失活,二異丙基氟磷酸(diisopropylfluorophosphate,DFP)對酶沒有影響,重金屬離子Hg2+和Pb2+可使酶失活。DUTT K等[30]從土壤中分離得到一株產凝乳酶枯草芽孢桿菌,具有較高的凝乳酶活力(milk-clotting activity,MCA)/蛋白水解酶活力(protease activity,PA)(MCA/PA)值。研究結果表明,酪蛋白對凝乳酶的產生具有誘導作用,果糖和硝酸銨能夠促進產酶。在培養基(4%果糖、0.75%酪蛋白、0.3%NH4NO3、10mmol CaCl2,pH 6.0)中接種4%(v/v)的種子液,37℃、200r/min培養72h時酶活達到最高,為571.43U/mL。對其發酵培養基進行優化后凝乳活力提高了6.67倍。
胡永金等[31]從采集自云南省的幾個奶牛場的土壤樣品篩選得到112株產凝乳酶微生物,其中細菌22株,一株枯草芽孢桿菌BB-23產凝乳酶活力高而蛋白水解活力低,該菌在麩皮培養基發酵72h后凝乳酶活力達73.80SU。劉河濤[32]從所采集的10種土壤和干酪樣品中分離純化出的34株微生物中,篩選出能產凝乳酶的枯草芽孢桿菌QL-2,其凝乳活力能達到62.83SU。
1.2.3 地衣芽孢桿菌
TREVOR M等[33]從生乳中分離得到一株產胞外凝乳酶的地衣芽孢桿菌(Bacillus licheniformis)。采用70%硫酸銨對該菌株所產凝乳酶進行了初步純化,進一步研究表明,最適作用溫度為65℃,最適pH為5.0~5.5,65℃作用3min后酶失活。AGEITOS J M等[34]純化并研究了地衣芽孢桿菌USC13凝乳酶的酶學性質。在LB培養基中培養地衣芽孢桿菌USC1能產生62ku的凝乳蛋白酶源,成熟后分子質量變為34ku。
宋曦等[35]利用改進的酪蛋白培養基分離得到的地衣芽孢桿菌D3.11在發酵72h時凝乳酶活力達89.56SU/mL,經優化后凝乳活力提高到134.72SU/mL[36]。
1.2.4 球形芽孢桿菌
EL-BENDARY MA等[37-38]采用丙酮分級沉淀、DEAESephadex A-25和Sephadex G-100將球形芽孢桿菌(Bacillus sphaericus)NRC24凝乳酶純化了48倍,活力達到648 148U/mg。該酶在pH5.7~7.5、溫度為55℃時達到最高。Zi2+對酶有激活作用,Ni2+和Hg2+對酶有抑制作用。CaCl2在一定濃度范圍內可以使酶激活,NaCl在5%~20%范圍內使酶抑制。
1.2.5 黃色粘球菌
CARIAS J R等[39]報道了一株黃色粘球菌(Myxococcus xanthus)DK101,該菌能產生內切蛋白酶,與凝乳酶一樣能特異性地水解Phe-Met之間的肽鍵,分子質量為45ku。PETIT F等[40]研究了黃色粘球菌DK1622產胞外凝乳酶的條件,結果表明,該菌在pH 6.0時酶活最高。在發酵時間接近9h時酶活達到最高,酶活與菌體量不呈正相關。POZA M等[41-42]從4株黃色粘球菌中篩選得到一株黃色粘球菌422,該菌產生的凝乳酶分子質量為40ku,等電點為5.0,最適pH為6.0,最適溫度為37℃,65℃處理12min后酶可完全失活。
1.2.6 糞腸球菌
SATO S等[43]從157株乳酸菌中篩選得到一株產凝乳酶的糞腸球菌(Enterococcus faecalis)TUA2495L,具有較高的MCA/PA值。所產凝乳酶分子質量為34~36ku,等電點為5.4,Km值為0.61%。最適作用溫度為70℃,在pH5.5~10.0的范圍內酶比較穩定,Fe2+、Cd2+、Ni2+、Cu2+、Al3+、SDS和EDTA對酶有抑制作用,Co2+、Mn2+和Zn2+對酶有激活作用。
1.2.7 蠟狀芽孢桿菌
周俊清[44]從采集自湖南農業大學奶牛場的牛棚中、養牛場院內、排水溝的土壤樣品中分離得到一株蠟狀芽孢桿菌(Bacillus cereus)BZ-17,對其進行了誘變選育、培養基和培養條件優化和酶學性質研究。

表2 不同細菌凝乳酶的特性Table 2 Characteristics of different bacteria rennet
1.3 產凝乳酶放線菌
產凝乳酶放線菌主要有嗜熱放線菌(Thermoactinomyces)、小單孢菌屬(Micromonospora)、擬諾卡氏菌屬(Nocardiopsissp.)等。
郭光遠等[45]在對云南不同地區放線菌區系及資源的考察過程中,對所分離到的2 127株放線菌中凝乳酶產生菌進行了篩選,產酶菌株有356株,占其中49株產酶活力較高。62%的高溫鏈霉菌菌株產生凝乳酶,產酶活力大于100U/mL的菌株占5.2%;中溫鏈霉菌有11.3%的菌株產生凝乳酶,活性較高的占2.2%。小單胞菌、諾卡氏菌、馬杜拉放線菌和高溫放線菌等也有產生凝乳酶活性較高的菌株。盡管水生放線菌產酶菌株的比例較高,但高活力的菌株多數來自土壤。
CAVALCANTI M T H等[46-47]研究了諾卡氏菌屬所產凝乳酶的部分純化和酶學特性。經過硫酸銨鹽析后,酶的純化倍數為7.2,產率為55.3%;經過DEAE-cellulose純化后得到4個活性部分(F4、F5、F6、F7),其中F5部分表現了最好的凝乳酶活性。酶的最適凝乳pH分別為11.0和7.5,最適凝乳溫度為55℃,在pH 4.5~11.0范圍內都比較穩定,在65℃和75℃加熱30min后失活。諾卡氏菌(Nocardiopsissp.)在含豆餅粉1%、不含葡萄糖的培養基中,培養40h時凝乳酶活力達到最高,為24.49 U/mg。
2 產凝乳酶微生物的誘變選育
目前關于高產凝乳酶微生物的誘變育種的研究大多集中在真菌如微小毛霉、黑曲霉、米黑毛霉等。誘變育種的所采用的方法主要有60Co-γ射線誘變、紫外線照射誘變、脫氧膽酸鈉誘變、常壓低溫等離子體誘變、微波輻照誘變和NTG誘變等。郭光遠等[45]以毛霉Y85-8512作為出發菌,經誘變選育得到酶活比值高且凝乳活力可達到5 000U/g的菌株。孫建等[48]從17株產凝乳酶的霉菌中通過放射誘變選出1株高產菌株,再進行60Co-γ射線誘變,得到的變異株R132的凝乳活力提高了80%,酶活比值提高了65%。廖亮等[49]以米黑毛霉和黑曲霉為出發菌株,分別進行紫外線照射誘變、脫氧膽酸鈉誘變和常壓低溫等離子體誘變,選育一株凝乳酶產量高,蛋白質水解活力小的黑曲霉L-2-12。邵淑娟等[50]采用微波輻照方法對產凝乳酶的黑曲霉JG進行誘變處理,選育出的突變株WB6-3、WB2-5,凝乳活力分別比出發菌株提高了35%和14%。
3 微生物凝乳酶的底物專一性和結構
不同來源的凝乳酶由于其對作用底物的專一性不同,在凝乳時對κ-酪蛋白的水解位點不同,其在酶解階段的凝乳機理也不相同。豬胃蛋白酶A和C凝乳酶與小牛皺胃酶相同,水解κ-酪蛋白的目標肽鍵均為Phe105~Met106[51]。萵苣凝乳酶水解κ-酪蛋白的靶位點為Arg97~His98、Lys111~Lys112或Lys112~Asn113的肽鍵[52],合歡凝乳酶則偏好水解Lys116~Thr117[53]。菜薊凝乳酶對牛和綿羊κ-酪蛋白的主要裂解位點是Phe105~Met106,但對山羊κ-酪蛋白的裂解位點是Lys116~Thr117[54]。在已報道的微生物凝乳酶中,栗疫菌(C.parasitica)蛋白酶水解κ-酪蛋白的目標肽鍵是Ser104~Phe105[55];米黑毛霉(R.miehei)凝乳酶水解κ-酪蛋白的目標肽鍵為Phe105~Met106[51]。
已報道的凝乳酶氨基酸序列和結構均有一定的差異。牛源凝乳酶為單鏈,有323個氨基酸殘基,而雪白毛霉(R.niveus)、高大毛霉(M.mucedo)、佐氏曲霉(A.saitoi)、米黑毛霉(R.miehei)、微小毛霉(R.pusillus)、栗疫菌(C.parasitica)凝乳酶分別含有391、400、394、430、427、419個氨基酸殘基。牛源凝乳酶二級結構中主要包含β-折疊和一些小的α-螺旋片,由N端區域和C端區域以雙葉折疊的方式形成了帶有活性位點Asp32和Asp215的分裂溝。菜薊凝乳酶的C端區域中含有“Asp-Thr-Ser”模體,酵母菌凝乳酶的C端區域中也含有“Asp-Thr-Ser”模體,這與其他真菌源凝乳酶中含有的“Asp-Thr-Gly”模體不同[56-57]。
4 結論與展望
凝乳酶用途廣泛,目前對凝乳酶的需求越來越大,對凝乳酶的研究及開發刻不容緩。微生物源凝乳酶研究,受到了廣泛的重視。微生物凝乳酶的研究基礎是獲得大量高產優良凝乳酶的微生物菌株,雖然關于產凝乳酶微生物資源的研究已取得了一定的成果,但這方面的研究仍需進一步加強和深化。將來產凝乳酶微生物的研究應從以下幾方面進一步深化。
(1)篩選更多優良菌種,優良菌株所產的凝乳酶應凝乳活力高而水解活力低,易于生產,成本低,用其生產的干酪質地和風味易被消費者接受。
(2)應用誘變選育技術對產酶菌種進行改良,提高單位產量,降低單位成本,使之更適于工業化生產。
(3)以現有的微生物凝乳酶基因資源為基礎,應用基因工程技術提高其表達率,獲得更高的產量。
(4)以現有的微生物凝乳酶為基礎,應用蛋白質工程技術提高活性。
[1]MANDY J,DORIS J,HARALD R.Recent advances in milk clotting enzymes[J].Int J Dairy Technol,2010,64(1):14-33.
[2]劉文宗,蔣敏,何曉霞,等.干酪凝乳酶代用品研究[J].四川畜牧獸醫學院學報,2001,15(2):23-27.
[3]張富新,顧熟琴.不同凝乳酶在干酪生產中應用效果的研究[J].食品工業科技,2003,24(7):20-22.
[4]GARG S K,JOHRI B N.Rennet:current trends and future research[J]. Food Rev Int,1994,10(3):313-355.
[5]STERNBERG M Z.Crystalline milk-clotting protease fromMucor mieheiand some of its properties[J].J Dairy Sci,1971,54(2):159-167.
[6]LAGRANGE A,PAQUET D,ALAIS C.Comparative study of twoMucor mieheiacid proteinases.purification and some molecular properties [J].Int J Biochem,1980,11(5):347-352.
[7]SEKER S,BEYENALH,AYHAN F,et al.Production of microbial rennin fromMucor mieheiin a continuously fed fermenter[J].Enzyme Microb Tech,1998(23):469-474.
[8]金娟男,張蘭威.微小毛霉與米黑毛霉凝乳酶的制備及其凝乳質構特性研究[J].中國釀造,2007,26(11):17-20.
[9]ARIMA K,YU J,IWASAKI S.Milk-clotting enzyme from microorganisms V.purification and crystallization ofMucorrennin fromMucor pusillusvar.Lindt.[J].Appl Environ Microb,1968,16(11):1727-1733.
[10]NOUANI A,BELHAMICHE N,SLAMANI R,et al.Extracellular protease fromMucor pusillus:purification and characterization[J].Int J Dairy Technol,2009,62(1):112-117.
[11]錢世均,張純青,矯慶華,等.微小毛霉凝乳酶的純化和性質[J].微生物學報,1989,29(4):272-277.
[12]矯慶華,錢世鈞.微小毛霉凝乳酶的生物合成和性質的研究[J].微生物學報,1992,32(1):30-35.
[13]SARDINAS J L.Rennin enzyme ofEndothia parasitica[J].Appl Environ Microb,1968,16(2):248-255.
[14]KRIS H,ISSAM F,JOHN R.Whitaker.Purification of protease from the fungusEndothia parasiticaz[J].J Dairy Sci,1968,51(12):1916-1922.
[15]MERLE K L,JOHN R W.Parameters affecting activity of the rennin-like enzyme[J].J Dairy Sci,1970,53(3):253-261.
[16]MERLE K.LARSON,JOHN R.et al.Parameters affecting stability of the rennin-like enzyme[J].J Dairy Sci,1970,53(3):262-269.
[17]KUMAR S,SHARMA N S,SAHARAN M R,et al.Extracellular acid protease fromRhizopus oryzae:purification and characterization[J]. Process Biochem,2005,40(5):1701-1705.
[18]吳進菊,徐爾尼,陳衛平,等.酒曲根霉F34菌株凝乳酶的初步純化及部分酶學性質的研[J].食品工業科技,2008,29(9):135-137.
[19]滕國新,李里特.Rhizopussp.052凝乳酶的純化[J].食品工業科技,2005,26(9):52-54.
[20]VISHWANATHA K S,APPURAO A G,SINGH S A.Production and characterization of a milk-clotting enzyme fromAspergillus oryzae MTCC 5341[J].Appl Microbiol Biot,2010,85(6):1849-1859.
[21]CHANNE P S,SHEWALE J G.Influence of culture conditions on the formation of milk-clotting protease byAspergillus nigerMC4[J].World J Microb Biot,1998,14(1):11-15.
[22]HASHEM A M.Purification and properties of a milk-clotting enzyme produced byPenicillium oxalicum[J].Bioresource Technol,2000,75 (3):219-222.
[23]MOHARIB S A.Proteolytic activity of proteases produced from white rot fungus[J].Adv Food Sci,2007,29(1):6-11.
[24]GHAREIB M,HAMD H S,KHALIL A A.Production of intracellular milk-clotting enzyme in submerged cultures ofFusarium subglutinans [J].Acta Microbiol Pol,2001,50(2):139-147.
[25]KOBAYASHI H,KIM H,ITOH T,et al.Screening for milk clotting enzyme frombasidiomycetes[J].Agr Biol Chem,1994,58(2):440-441.
[26]KOBAYASHI H,KUSAKABE I,MURAKAMI K.Purication and characterization of twomilkclottingenzymesfromIrpexlacteus[J].Agr Biol Chem,1983,47(3):551-558.
[27]YU P J,CHOU C C.Factors affecting the growth and production of milk-clotting enzyme byAmylomyces rouxiiin rice liquid medium[J]. Food Technol Biotech,2005,43(3):283-288.
[28]MATTA H,PUNJ V.Isolation and partial characterization of a thermostable extracellular protease ofBacillus polymyxaB-17[J].Int J Food Microbiol,1998,42(3):139-145.
[29]LAVU K R,MATHUR D K.Purification and properties of milk-clotting enzyme fromBacillus subtilisK-26[J].Biotechnol Bioeng,1979,21(4): 535-549.
[30]DUTT K,GUPTA P,SARAN S,et al.Production of milk-clotting protease fromBacillus subtilis[J].Appl Biochem Biotech,2009,158(3): 761-772.
[31]胡永金,石振興,朱仁俊,等.一株產凝乳酶細菌的分離與鑒定[J].中國釀造,2010,29(5):81-84.
[32]劉和濤.一株產凝乳酶枯草芽抱桿菌的篩選、鑒定及其酶活性質的研究[D].蘭州:蘭州大學碩士論文,2008.
[33]TREVOR M D S,LANCELOT P.Production and immobilization of a bacterialmilk-clottingenzyme[J].J Dairy Sci,1982,65(11):2074-2081.
[34]AGEITOS J M,VALLEJO J A,SESTELO A B F,et al.Purification and characterization of a milk-clotting protease fromBacillus licheniformis strain USC13[J].J Appl Microbiol,2007,103(6):2205-2213.
[35]宋曦,甘伯中,賀曉玲,等.天祝放牧牦牛生活環境土壤中一株產凝乳酶細菌[J].食品科學,2009,30(11):158-162.
[36]張衛兵,宋曦,賀曉玲,等.Bacillus licheniformis產凝乳酶培養基的優化[J].中國釀造,2011,30(2):70-73.
[37]EL-BENDARY M A.Formation and properties of serine protease enzyme with milk-clotting activity fromBacillus sphaericus[J].Egypt J Appl Sci,2004,19:68-91.
[38]EL-BENDARY M A,MAYSA E M,THANAA H A.Purification and characterization of milk clotting enzyme produced byBacillus sphaericus[J].J Appl Sci Res,2007,3(8):695-699.
[39]CARIAS J R,RAUBGEAUD J,MAZAUD C,et al.A chymosin-like extracellular acidic endoprotease fromMyxococcus xanthusDK101[J]. FEBS Lett,1990,262(1):97-100.
[40]PETIT F,GUESPIN J F.Production of an extracellular milk-clotting activity duringdevelopmentinMyxococcusxanthus[J].J Bacteriol,1992, 174(15):5136-5140.
[41]POZA M,PRIETO-ALCEDO M,SIEIRO C,et al.Cloning and expression of genes encoding milk-clotting proteases fromMyxococcus xanthus422[J].Appl Environ Microbiol,2004,70(10):6337-6341.
[42]POZA M,SIEIRO C,CARREIRA L,et al.Production and characterization of the milk-clotting protease ofMyxococcus xanthusstrain 422[J]. J Ind Microbiol Biot,2003,30(12):691-698.
[43]SATO S,TOKUDA H,KOIZUMI T,et al.Purification and characterization of an extracellular protease having milk-clotting activity from Enterococcus faecalisTUA2495L[J].Food Sci Technol Res,2004,10 (1):44-50.
[44]周俊清.凝乳酶優良菌株的選育及酶活特性的研究[D].長沙:湖南農業大學碩士論文,2005.
[45]郭光遠,姜成林.微生物凝乳酶的研究Ⅰ.菌株的篩選,發酵,制備及毒性[J].微生物學通報,1988,15(5):207-210.
[46]CAVALCANTI M T H,TEIXEIRA M F S,FILHO J L L,et al.Partial purification of new milk-clotting enzyme produced byNocardiopsissp. [J].Bioresource Technol,2004,93(1):29-35.
[47]CAVALCANTI M T H,MARTINEZ C R,FURTADO V C,et al.Milk clotting protease production byNocardiopsissp.in an inexpensive medium[J].World J Microb Biot,2005,21(2):151-154.
[48]孫健,宋曉紅.總狀毛霉凝乳酶的研制及初步應用[J].微生物學通報,1994,21(1):5-10.
[49]邵淑娟,李鐵柱,李倬林,等.產凝乳酶黑曲霉JG的微波誘變育種研究[J].中國釀造,2010,29(7):47-50.
[50]廖亮.凝乳酶高產菌株的選育及其發酵條件、酶學活性的相關研究[D].北京:北京化工大學碩士論文,2010.
[51]HORNE D S,BANKS J M.Rennet-induced coagulation of milk[M]// FOX P F,MCSWEENEY P L H,COGAN T M.et al.Cheese:chemistry,physics and microbiology.London:Chapman and Hall,2004.
[52]LO PIERO A R,PUGLISI I,PETRONE G.Characterization of“Lettucine”,a serine-like protease fromLactuca sativaleaves,as a novel enzyme for milk clotting[J].J Agr Food Chem,2002,50(8):2439-2443.
[53]EGITO A S,GIRARDET J M,LAGUNAL E,et al.Milk-clotting activity of enzyme extracts from sunflower andalbiziaseeds and specific hydrolysis of bovine-casein[J].Int Dairy J,2007,17(7):816-825.
[54]MACEDO I Q,FARO C J,PIRES E V.Specificity and kinetics of the milk-clotting enzyme from cardoon(Cynara cardunculusL.)toward bovine-casein[J].J Agr Food Chem,1993,41(10):1537-1540.
[55]DROHASE H B,FOLTMANN B.Specificity of milk-clotting enzymes towards bovineκ-casein[J].Biochim Biophys Acta,1989,995(3):221-224.
[56]SIRMA Y,PETER D.Progress in the field of aspartic proteinases in cheese manufacturing:structures,functions,catalytic mechanism,inhibition,and engineering[J].Dairy Sci Technol,2013,93(6):565-594.
[57]SUPANNEE C,JAMES M.Chymosin and aspartic proteinases[J].Food Chem,1998,61(4):395-418.
Summary on rennet producing microorganisms
LI Xuepeng1,LIANG Qi1,SHI Xixiong1,FENG Ruizhang2,ZHANG Yan1,WEN Pengcheng1,ZHANG Weibing1*
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China; 2.Key Laboratory of Fermentation Resources and Application at Universities of Sichuan Province,Yibin University,Yibin 644000,China)
Rennet is widely used in many aspects,it occurs in animal,plants and microorganisms.The variety of rennet-producing fungi,bacteria,actinomycetes,and the breeding situation of rennet producing microorganism were summarized,in order to provide reference for research and development of microbial rennet.
rennet;microorganisms;breeding
Q556
A
0254-5071(2014)04-0013-06
10.3969/j.issn.0254-5071.2014.04.004
2014-03-14
發酵資源與應用四川省高校重點實驗室開放基金項目(2011KFJ005);甘肅省自然科學基金項目(1308RJZA260);十二五"農村領域國家科技計劃項目(2011AA100903)
李學朋(1988-),女,碩士研究生,研究方向為乳品微生物。
*通訊作者:張衛兵(1974-),男,副教授,博士,研究方向為應用微生物。

