柱前衍生化反相高效液相色譜法測定大鼠血漿中牛磺酸的含量及其藥動學研究
岳山嵐,王 維,帥淑平,王 靜,王吉琳,趙一凡,楊俊毅
(四川大學華西藥學院,四川 成都 610041)
柱前衍生化反相高效液相色譜法測定大鼠血漿中牛磺酸的含量及其藥動學研究
岳山嵐,王 維,帥淑平,王 靜,王吉琳,趙一凡,楊俊毅
(四川大學華西藥學院,四川 成都 610041)
建立一種測定大鼠血漿中牛磺酸含量的柱前衍生化-高效液相色譜法,并將其應用于牛磺酸在大鼠體內的藥動學研究。采用柱前衍生化高效液相色譜法,以2,4-二硝基氟苯(DNFB)為衍生化試劑,以KH2PO3緩沖液(pH 7.0):乙腈∶水(70∶15∶15,v/v)為流動相,經C18色譜柱(250mm×4.6mm×5μm)分離,柱溫30℃,流速1.0mL/min,進樣量為20μL,牛磺酸衍生物的紫外檢測波長為360nm,并以DAS2.0計算其藥動學參數。大鼠血漿中牛磺酸在1.29~1 287.5 μg/mL質量濃度范圍內線性關系良好,r=0.999 9,最低定量限1.29 μg/mL,主要藥動學參數t1/2為(3.747±1.430)h,Cmax為(949.573±192.967)μg/mL,Tmax為(1.000±0.000)h,AUC0-t為(2862.168±565.917)(mg/L)/h。該法簡單、經濟、靈敏,適用于牛磺酸血藥濃度測定及藥動學研究。
牛磺酸;高效液相色譜法;柱前衍生化;藥動學
0 引 言
牛磺酸(taurine)又名牛膽堿、牛膽素,是存在于人及動物體內的一種非蛋白游離氨基酸[1]。牛磺酸具有廣泛的生理藥理作用[2-3],臨床上用于治療支氣管炎,急慢性肝炎,高血壓等疾病,大多為口服制劑[4]。牛磺酸本身沒有紫外吸收,因此無法使用常規的高效液相色譜法(HPLC)對其濃度進行檢測。國內外文獻中關于牛磺酸濃度的測定方法主要有氨基酸自動分析儀法[5]、液相色譜-質譜聯用法(LCMS)[6]、柱后衍生化法[7]、柱前衍生化法[8]、薄層掃描法[9]等。其中,LCMS法、柱后衍生化法、氨基酸自動分析儀法存在對檢測儀器要求較高,且檢測費用昂貴,不適用于大批量樣品檢測分析的缺陷;而薄層掃描法在操作過程中影響因素太多。柱前衍生化為將樣品在進樣前進行衍生化反應,可以相對自由地選擇反應條件,不存在反應動力學的限制;衍生化的副產物可進行預處理以降低或消除其干擾;允許多步反應的進行,有較多的衍生化試劑可選擇。2,4-二硝基氟苯(DNFB)作為一種衍生化試劑,與牛磺酸在堿性條件下發生衍生化反應:

生成的牛磺酸衍生物具有紫外吸收,可用于檢測分析。本研究旨在建立一種簡單、經濟且具有足夠靈敏度的柱前衍生化-高效液相色譜法,以測定生物樣品中牛磺酸的濃度,并應用于牛磺酸的臨床前藥動學研究。
1 材 料
1)儀器。LC-10AT高效液相-泵(SHIMAZU,日本);CTO-10Asvp高效液相-柱溫箱(SHIMAZU,日本);B-220恒溫水浴鍋(上海雅榮生化儀器設備有限公司);ZP-200振蕩器(江蘇太倉市實驗設備廠);TGL-16高速離心機(上海安亭科學儀器廠);SIMENS低溫冰箱(美國Thermo公司);AUW 120D電子天平(SHIMAZU,日本);DW-FL 270低溫冰箱(中科美菱)。
2)藥物和試劑。牛磺酸(潛江永安藥業股份有限公司,批號:20110424,純度:99%);牛磺酸對照品(純度>99%,Sigma公司);2,4-二硝基氟苯(DNFB)(日本東京化成工業株式會社);磷酸二氫鉀、氫氧化鈉、碳酸氫鈉為分析純;乙腈為色譜純,水為超純水。
3)實驗動物。健康SD大鼠,雌雄各半,四川大學動物實驗中心提供,許可證號:SCXK(川)2009-09。
2 方法與結果
2.1 色譜條件
Kromasil C18色譜柱(250mm×4.6mm×5μm),流動相為KH2PO3緩沖液(pH 7.0)∶乙腈∶水(70∶15∶15,v/v),流速1.0 mL/min,柱溫30℃,檢測波長360nm,進樣量20μL。
2.2 牛磺酸標準溶液的配制
取牛磺酸對照品約1g,精密稱定,置于100 mL容量瓶中,加純水溶解并稀釋至刻度,混勻,得質量濃度為0.010 3 g/mL的牛磺酸儲備液。精密吸取儲備液適量,用水稀釋,得質量濃度分別為2.575,5.15,25.75,103,257.5,1030,2060,2575μg/mL的牛磺酸系列標準溶液。
2.3 血漿的制備
取SD大鼠5只,實驗前禁食12h,按0.9g/kg劑量單次口服灌胃牛磺酸,在給藥過程中保證SD大鼠服藥完全,分別于給藥前和給藥后0.033,0.083,0.25,0.5,1,2,3,5,7,9,12,24h尾靜脈采血0.5 mL,血樣置肝素化采血管中,8 000 r/min離心5min,分離血漿,于-40℃冰箱儲存待測。
2.4 血漿樣品的處理
取200μL血漿樣品,加純水100 μL,渦旋混合30 s,加乙腈500 μL,渦旋3 min,12 000 r/min離心5min,取上清液500μL于5mL容量瓶中,加NaHCO3溶液(0.5 mol/L,pH9.0)500 μL,再加入1.0%(v/v)的2,4-二硝基氟苯乙腈溶液100μL,避光80℃水浴加熱1h,取出,用KH2PO3緩沖液(pH7.0)稀釋至刻度,取20μL進樣。
2.5 方法學驗證
2.5.1 方法的專屬性
在本實驗所采用的HPLC條件下,2,4-二硝基氟苯的出峰時間在7.6 min,牛磺酸衍生物的出峰時間在13.5 min,峰形良好,與衍生化試劑分離良好,空白血漿樣品無明顯內源性雜質峰干擾測定;本方法具有較高的特異性,能準確測定血漿中的牛磺酸的質量濃度,靈敏度較高,如圖1所示。
2.5.2 標準曲線制備
精密吸取空白SD大鼠血漿200μL,置于1.5mL離心管中,分別加2.2的牛磺酸系列標準溶液100μL,得到牛磺酸質量濃度分別為1.29,2.58,12.88,51.5,128.75,515,1030,1287.5μg/mL的標準血漿樣品,除不加純水100μL外,其余按2.4方法操作,記錄色譜圖。計算牛磺酸衍生物峰面積ATau和空白血漿中牛磺酸衍生物峰面積AKB的差值y,采用SPSS 13.0統計學軟件,以y值對血藥濃度C作加權直線回歸計算,得線性回歸方程y=2 218.381×C+7 653.674,r=0.9999,在1.29~1287.5μg/mL質量濃度范圍內線性關系良好,結果見圖2。
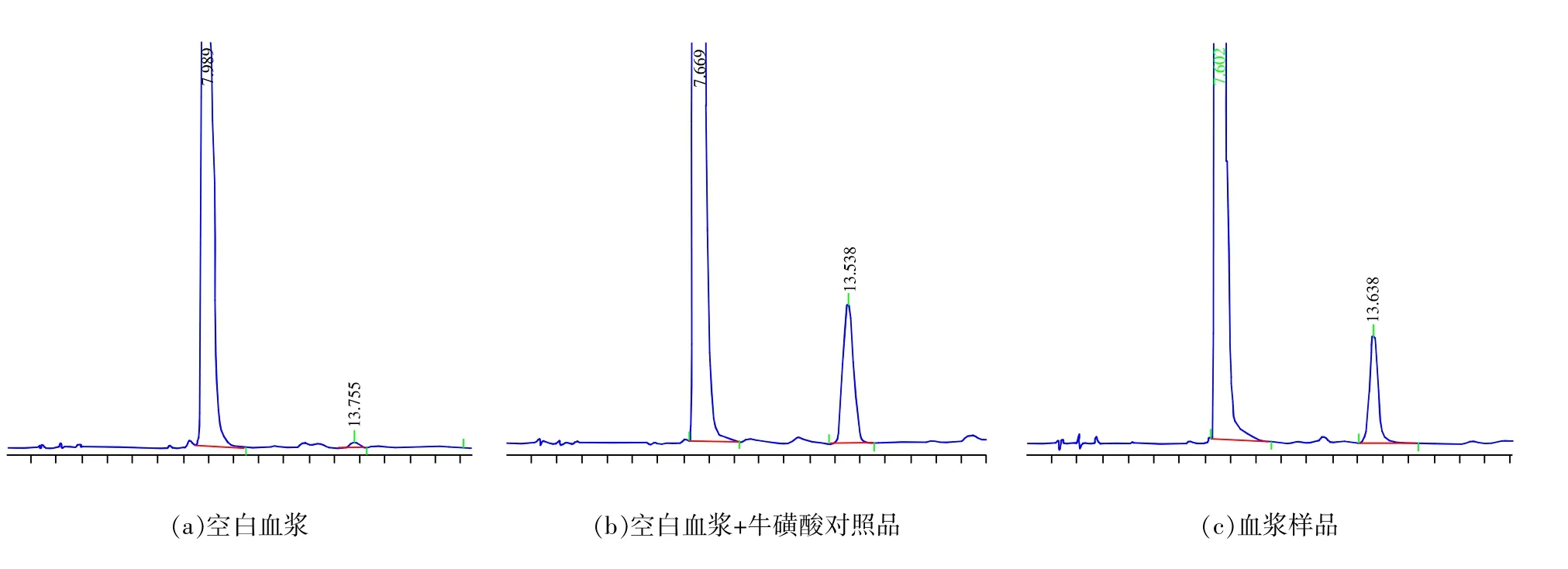
圖1 牛磺酸衍生物與衍生化試劑色譜圖
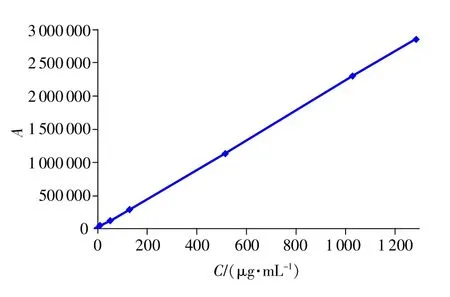
圖2 牛磺酸血漿樣品標準曲線
2.5.3 定量下線的確定
取空白血漿200 μL,制備含牛磺酸質量濃度為1.29 μg/mL的標準血漿樣品(n=5),除不加純水100μL外,其余按2.4方法操作。記錄色譜圖,計算牛磺酸衍生物峰面積ATau和空白血漿中牛磺酸衍生物峰面積AKB的差值y,根據標準曲線計算實測質量濃度,得其回收率為108.38%±7.24%。按上述條件測得牛磺酸在血漿中的定量下限為1.29μg/mL。
2.5.4 準確度和精密度試驗
取空白血漿200μL,制備低、中、高濃度分別為2.58,128.75,1 030 μg/mL的含藥血漿樣品(n=5),除不加純水100μL外,其余按2.4方法操作。連續制備3個分析樣品,記錄色譜圖,計算牛磺酸衍生物峰面積ATau和空白血漿中牛磺酸衍生物峰面積AKB的差值y,根據標準曲線計算實測質量濃度及準確度、批內和批間精密度。結果低、中、高3種濃度樣品回收率在98.45%~109.27%之間,批內及批間RSD均≤5.0%。
2.5.5 樣品穩定性考察
取空白血漿200μL,制備濃度分別為2.58,128.75, 1030μg/mL的含藥血漿樣品(n=5),按2.4方法操作后,室溫放置0,10,24h后再測定,記錄樣品峰面積,計算實測質量濃度,并與0h測定結果進行比較。結果表明,牛磺酸血漿樣品在處理后室溫放置至少能穩定24h。
2.6 藥動學研究
取SD大鼠5只,實驗前禁食12h,按0.9g/kg劑量單次口服灌胃給予牛磺酸,在給藥過程中保證SD大鼠服藥完全,分別于給藥前和給藥后0.033,0.083,0.25,0.5,1,2,3,5,7,9,12和24 h尾靜脈采血0.5 mL,血樣置肝素化采血管中,8000r/min離心5min,分離血漿,于-40℃冰箱儲存。按2.4方法操作后,在本實驗條件下測定。根據測定結果繪制牛磺酸的平均血藥濃度-時間曲線,見圖3。
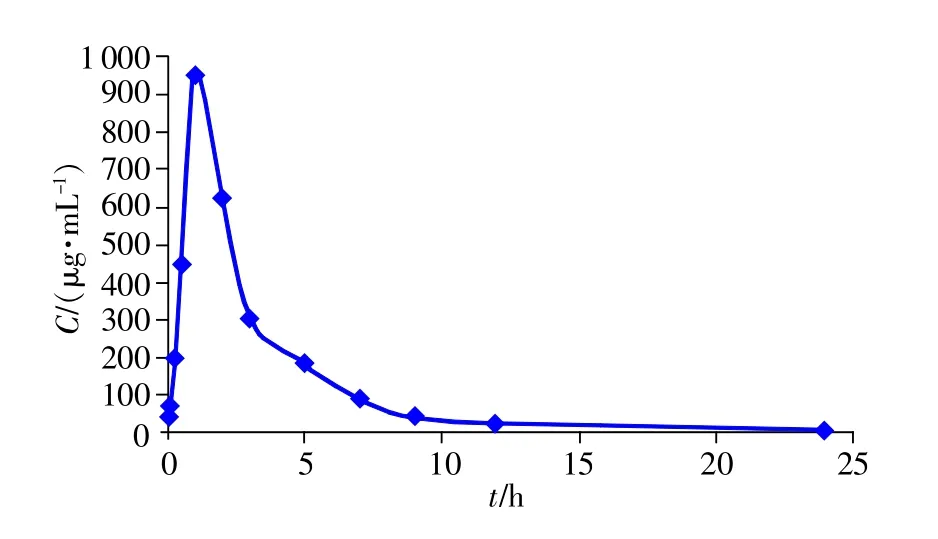
圖3 牛磺酸平均血藥濃度-時間曲線
采用藥動學軟件DAS 2.0計算主要藥動學參數,根據二室模型依賴性參數估算方法,計算SD大鼠口服牛磺酸后的藥動學主要參數,AUC0-t為(2862.168± 565.917)(mg/L)/h,Cmax為(949.573±192.967)μg/mL,Tmax為(1.000±0.000)h,t1/2為(3.747±1.430)h,結果見表1。
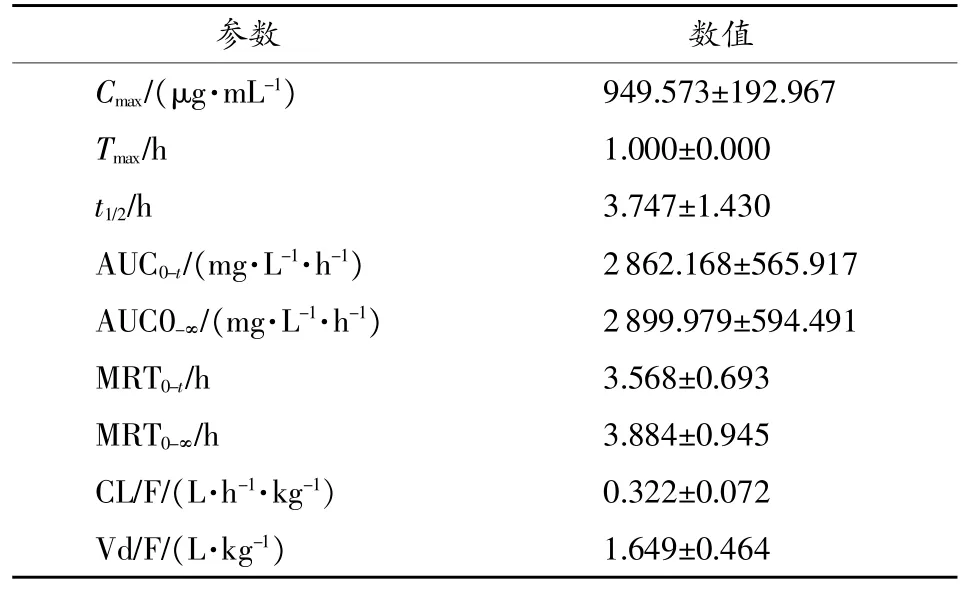
表1 牛磺酸藥動學參數
3 討 論
牛磺酸本身沒有紫外吸收,須經衍生化后方能通過紫外檢測進行含量測定。因此衍生化試劑的選擇尤其重要,常用的衍生化試劑有鄰苯二甲醛(o-phthaldialdehyde,OPA),丹磺酰氯(dansylchloride)和2,4-二硝基氟苯(2,4-dinitrofluorobenzen,DNFB)等,用鄰苯二甲醛配制的OPA試液可使牛磺酸在短時間內衍生化,但衍生化產物穩定性差,要求檢測迅速,故更適用于柱后衍生化檢測,且因其不穩定性對操作要求較高。而丹磺酰氯做衍生試劑易產生副產物,干擾測定。本實驗選用DNFB作為衍生化試劑,以桑格反應(Sanger reaction)為基礎,在弱堿性,避光,80℃條件下,DNFB與牛磺酸的α-氨基發生反應,生成黃色的2,4-二硝基苯牛磺酸,這種衍生化產物結構穩定,不易水解,且過量的DNFB的色譜峰對牛磺酸含量測定無干擾,衍生化及HPLC檢測過程操作簡單,快速,重現性好;另本方法的定量下限為1.29μg/mL,小于最新報道的使用相同衍生化方法后檢測所得的定量下限值3.00μg/mL[10]。且與報道中的梯度洗脫法相比,在兩法均能使牛磺酸衍生物與其他物質有效分離的前提下,本方法中使用的等度洗脫具有重現性好、精密度高的優點,可廣泛應用于牛磺酸生物樣本的分析。
本研究考察了衍生化試劑(DNFB)的用量(100,200μL)、衍生化反應時間(35,40,45,50,55,60min)及反應溫度(60,70,80℃)。結果表明當衍生化試劑(DNFB)用量為100μL,在避光條件下80℃反應1h后衍生化效率最高。在此條件下,DNFB與牛磺酸生成的衍生物室溫下放置24h仍然穩定。
4 結束語
本實驗選用2,4-二硝基氟苯(2,4-dinitrofluorobenzen,DNFB)作衍生化試劑建立的柱前衍生化-高效液相色譜法操作簡單,經濟成本低,重復性好,可成功地用于大鼠血漿中牛磺酸的含量測定。將其應用于牛磺酸在大鼠體內的藥動學研究后得到的主要藥動學參數Cmax為(949.573±192.967)μg/mL,Tmax為(1.000±0.000)h,t1/2為(3.747±1.430)h,AUC0-t為(2862.168±565.917)(mg/L)/h。本研究結果可為牛磺酸的進一步藥動學研究提供參考。
[1]Musio R,Sciacovelli O.Detection of taurine in biological tissues by 33S NMR spectroscopy[J].Journal of Magnetic Resonance,2001,153(2):259-261.
[2]Parildar K H,Mehmetcik G,?zdemirler E G,et al. Effect of taurine treatment on pro-oxidant-antioxidant balance in livers and brains ofold rats[J].Pharmacological Reports,2008(60):673-678.
[3]Militante J D,Lombardini J B.Treatment of hypertension with oral taurine:experimental and clinical studies[J]. Amino Acids,2002,23(4):381-393.
[4]王文樂,趙小燕,聶秀芹,等.牛磺酸的臨床應用[J].現代醫藥衛生,2005,21(23):3332-3333.
[5]王洪健,周興起,馮志強,等.氨基酸自動分析儀測定食品中牛磺酸的方法建立[J].現代食品科技,2012,28(3):348-350.
[6]Yu Y,Zheng X,Bian T,et al.Development and application of a LC-MS/MS assay for the simultaneous quantification of edaravone and taurine in beagle plasma[J]. Journal of Separation Science,2013,36(24):3837-3844.
[7]張彤,山廣志,余立.柱后衍生HPLC法測定牛磺酸顆粒的含量[J].中國新藥雜志,2010(4):340-342.
[8]蒲秋易,張一竹,張二云,等.柱前衍生化高效液相色譜法測定全蝎中游離牛磺酸的含量[J].中國新藥雜志,2013,22(2):230-234.
[9]郭麗儀.薄層掃描法測定人體血液中牛磺酸的含量[J].中草藥,2001,32(3):217-218.
[10]趙宏濤,黎云燕.牛磺酸在大鼠體內的藥代動力學[J].天津醫科大學學報,2013,19(4):341-344.
Determination of taurine in rat plasma by RP-HPLC with pre-column derivatization and its pharmacokinetic study
YUE Shan-lan,WANG Wei,SHUAI Shu-ping,WANG Jing,WANG Ji-lin,ZHAO Yi-fan,YANG Jun-yi
(School of Pharmacy,Sichuan University,Chengdu 610041,China)
To develop a HPLC method with pre-column derivatization for the determination of taurine in rat plasma and its application to the pharmacokinetic study after oral administration of taurine.The concentration of taurine in plasma was determined by a HPLC method with precolumn derivatization,and 2,4-dinitrofluorobenzene(DNFB)was used as a derivatization reagent. Chromatographic separation was performed on an C18 column(250 mm×4.6 mm×5μm),the mobile phase was consisted of KH2PO3buffer solution∶acetonitrile∶water(70∶15∶15,v/v)at a flow rate of 1.0 mL/min,the column temperature was at 30℃ and injection volume was 20 μL.The taurine derivative wasdetected by measuring the UV absorbance at360 nm.The pharmacokinetic parameters were calculated with the DAS2.0 software.Results:the calibration curve of taurine was linear(r=0.999 9)in the range of 1.29~1287.5 μg/mL.The limit of quantitation was 1.29 μg/mL,and the key pharmacokinetic parameters were t1/2(3.747±1.430)h,Cmax(949.573±192.967)μg/mL,Tmax(1.000±0.000)h,AUC0-t(2 862.168±565.917)(mg/L)/h.The method is simple,economic and sensitive,which can be successfully applied for the determination of taurine in plasma and its pharmacokinetic studies in rats.
taurine;HPLC;pre-column derivatization;pharmacokinetics
R914;TQ460.7+2;O657.7+2;O623.84
:A
:1674-5124(2014)06-0056-04
10.11857/j.issn.1674-5124.2014.06.015
2013-12-01;
:2014-01-24
岳山嵐(1988-),女,四川閬中市人,碩士研究生,專業方向為臨床用藥的藥動學基礎研究。

