微波輔助合成半乳聚糖及其結(jié)構(gòu)分析
王海松,施用暉,2,樂(lè)國(guó)偉,2,*
(1.江南大學(xué)食品學(xué)院,食品營(yíng)養(yǎng)與功能因子研究中心,江蘇 無(wú)錫 214122;2.江南大學(xué) 食品科學(xué)與技術(shù)國(guó)家重點(diǎn)實(shí)驗(yàn)室,江蘇 無(wú)錫 214122)
微波輔助合成半乳聚糖及其結(jié)構(gòu)分析
王海松1,施用暉1,2,樂(lè)國(guó)偉1,2,*
(1.江南大學(xué)食品學(xué)院,食品營(yíng)養(yǎng)與功能因子研究中心,江蘇 無(wú)錫 214122;2.江南大學(xué) 食品科學(xué)與技術(shù)國(guó)家重點(diǎn)實(shí)驗(yàn)室,江蘇 無(wú)錫 214122)
目的:研究半乳聚糖的快速、高效制備方法,并對(duì)產(chǎn)物進(jìn)行結(jié)構(gòu)分析。方法:在微波輻照下,以半乳糖為底物,氯化鈉溶液為引發(fā)劑,雜多酸為反應(yīng)催化劑,催化底物脫水縮合生成半乳聚糖,并通過(guò)乙醇沉淀去除催化劑和引發(fā)劑,Sephadex G-25葡聚糖凝膠柱分級(jí)純化,高效凝膠滲透色譜分析半乳聚糖的純度及聚合度,高效陰離子交換色譜分析單糖組成,最后通過(guò)紅外光譜分析半乳聚糖的構(gòu)型。結(jié)果:半乳聚糖的最優(yōu)合成條件為引發(fā)劑濃度0.25 mol/L、催化劑添加量1.1%、反應(yīng)溫度130 ℃、微波輻照4.5 min,半乳糖轉(zhuǎn)化率為97.22%。半乳聚糖的平均分子質(zhì)量為2.853 kD,平均聚合度為17。單糖組成為半乳糖及微量葡萄糖。紅外光譜及氫核磁共振波譜(1H-nuclear magnetic resonance,1H-NMR)分析表明半乳聚糖殘基以β-構(gòu)型為主。結(jié)論:可以通過(guò)微波輻照雜多酸催化的方法快速、高效制備半乳聚糖。
微波;半乳聚糖;結(jié)構(gòu)分析
半乳聚糖是指由半乳糖構(gòu)成或以半乳糖為主、其他單糖為輔構(gòu)成的直連或支鏈聚合物及其衍生物的統(tǒng)稱[1]。半乳聚糖具有免疫活性[2]、抗病毒活性[3-4]、抗凝血活性[5]以及抑制腫瘤轉(zhuǎn)移[6]等功能,并且可作為膳食纖維用于食品加工[7]。
目前,半乳聚糖主要是通過(guò)海洋藻類(如紅藻、褐藻、角叉菜膠等)或陸生植物(如刺槐、馬尾松、蒼術(shù)、當(dāng)歸)及動(dòng)物組織提取,然后通過(guò)水解及衍生化等方法獲得[1],制備工藝繁瑣、復(fù)雜。因此,快速、有效的制備方法為人們所期待。微波在多糖提取方面多有應(yīng)用[8],其是否可用于多糖的合成,尚待研究。微波輔助有機(jī)合成作為一種快速、有效的合成手段已有廣泛研究[9]。王海松等[10]曾報(bào)道了微波輔助快速合成低聚糖的方法。基于糖在酸催化作用下加熱可脫水形成聚合物[11-12],若能夠控制產(chǎn)物的聚合度,那么,采用微波輔助合成多糖將成為可能。
本實(shí)驗(yàn)在微波輔助合成低聚糖的基礎(chǔ)上,改進(jìn)合成條件,以半乳糖為原料,對(duì)微波輔助合成半乳聚糖的條件進(jìn)行探索,并對(duì)產(chǎn)物結(jié)構(gòu)進(jìn)行解析。
1 材料與方法
1.1 材料與試劑
D-半乳糖(Gal)、氯化鈉(NaCl)、三氟乙酸、無(wú)水乙醇(99%) 國(guó)藥集團(tuán)化學(xué)試劑有限公司;雜多酸江南大學(xué)食品營(yíng)養(yǎng)與功能因子研究中心;Sephadex G-25葡聚糖凝膠 北京索萊寶科技有限公司。
1.2 儀器與設(shè)備
XH-200A型電腦微波固液相合成/萃取工作站 北京祥鵠科技發(fā)展有限公司;BSZ-100型自動(dòng)部分收集器 上海青浦滬西儀器廠;1260型高效液相色譜儀(配Shodex RI-101視差檢測(cè)器) 美國(guó)Agilent公司;ICS-5000型離子色譜儀器 美國(guó)Dionex公司;600型高效凝膠滲透色譜儀(配2410視差檢測(cè)器) 美國(guó)Waters公司;560傅里葉變換紅外光譜儀 美國(guó)Nicolet公司;Avance III-400MHz核磁共振儀 德國(guó)Bruker公司。
1.3 方法
1.3.1 半乳聚糖合成的單因素試驗(yàn)
燒杯中加入25 g半乳糖,然后添加1.1%雜多酸作為催化劑,3.75 mL 0.3 mol/L氯化鈉溶液作為反應(yīng)引發(fā)劑,三者充分?jǐn)嚢瑁靹蚝笏腿胛⒉ǚ磻?yīng)器,并固定燒杯。設(shè)定微波功率800 W、反應(yīng)溫度130 ℃、反應(yīng)時(shí)間5 min,開啟攪拌器120 r/min,并開啟微波合成儀,反應(yīng)結(jié)束后,測(cè)定半乳糖的轉(zhuǎn)化率。固定底物添加量,引發(fā)劑添加量及微波功率,分別考察反應(yīng)溫度(100~150 ℃)、催化劑添加量(0.5%~1.5%)、微波輻照時(shí)間(4~6 min)、引發(fā)劑濃度(0.1~0.35 mol/L)對(duì)半乳糖轉(zhuǎn)化率的影響。
1.3.2 正交試驗(yàn)設(shè)計(jì)
以半乳糖的轉(zhuǎn)化率為指標(biāo),以反應(yīng)溫度、微波輻照時(shí)間、引發(fā)劑濃度、催化劑添加量為影響因素,根據(jù)單因素試驗(yàn)結(jié)果,選取適宜的因素水平進(jìn)行L16(44)正交試驗(yàn),確定最佳合成工藝條件。
1.3.3 高效液相色譜分析
色譜柱:Waters SugarPak I;流動(dòng)相:超純水;流速0.4 mL/min;柱溫85 ℃;進(jìn)樣量10 μL。
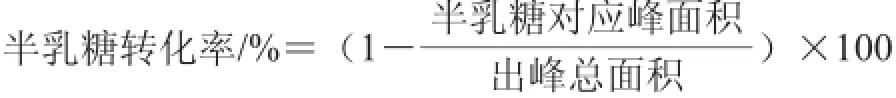
1.3.4 分離、純化
將所得半乳聚糖粗產(chǎn)品用去離子水溶解,然后在溶解液中緩慢加入5 倍去離子水體積的無(wú)水乙醇(99%),并不斷攪拌,離心,棄上清液,得半乳聚糖沉淀。然后將沉淀用少量去離子水溶解后冷凍干燥,得不含半乳糖、催化劑及引發(fā)劑的半乳聚糖。
乙醇沉淀后的半乳聚糖用去離子水溶解,然后用Sephadex G-25葡聚糖凝膠色譜柱分離,以去離子水作洗脫劑,流速0.5 mL/min,用部分收集器收集洗脫液,每管收集量為3 mL,時(shí)間間隔6 min。收集液中的糖組分采用硫酸-苯酚法測(cè)定[13],檢測(cè)波長(zhǎng)為490 nm,以吸光度為縱坐標(biāo),繪制洗脫曲線。收集各管洗脫液,旋轉(zhuǎn)蒸發(fā)濃縮后,凍干得白色粉末狀樣品。
1.3.5 純度和分子質(zhì)量
參照呂志華等[14]報(bào)道的方法進(jìn)行測(cè)定。
1.3.6 單糖組成分析
純化后的半乳聚糖用三氟乙酸水解,方法參照Wang Hui等[15]的報(bào)道。水解液去除三氟乙酸后,采用高效陰離子交換色譜(high performance anion exchange chromatography,HPAEC)法分析單糖組成。方法參照朱松等[16]的報(bào)道。
1.3.7 紅外光譜測(cè)定
參照張匯等[17]采用的方法進(jìn)行測(cè)定。
1.3.8 氫核磁共振波譜(1H-nuclear magnetic resonance,1H-NMR)測(cè)定
參照劉小如等[18]采用的方法進(jìn)行測(cè)定。
2 結(jié)果與分析
2.1 反應(yīng)溫度、微波輻照時(shí)間、引發(fā)劑濃度、催化劑添加量對(duì)半乳糖轉(zhuǎn)化率的影響
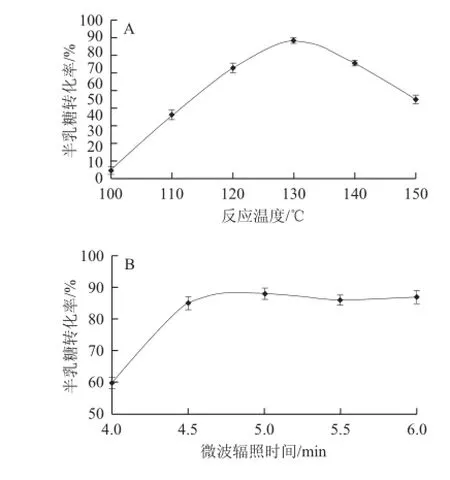
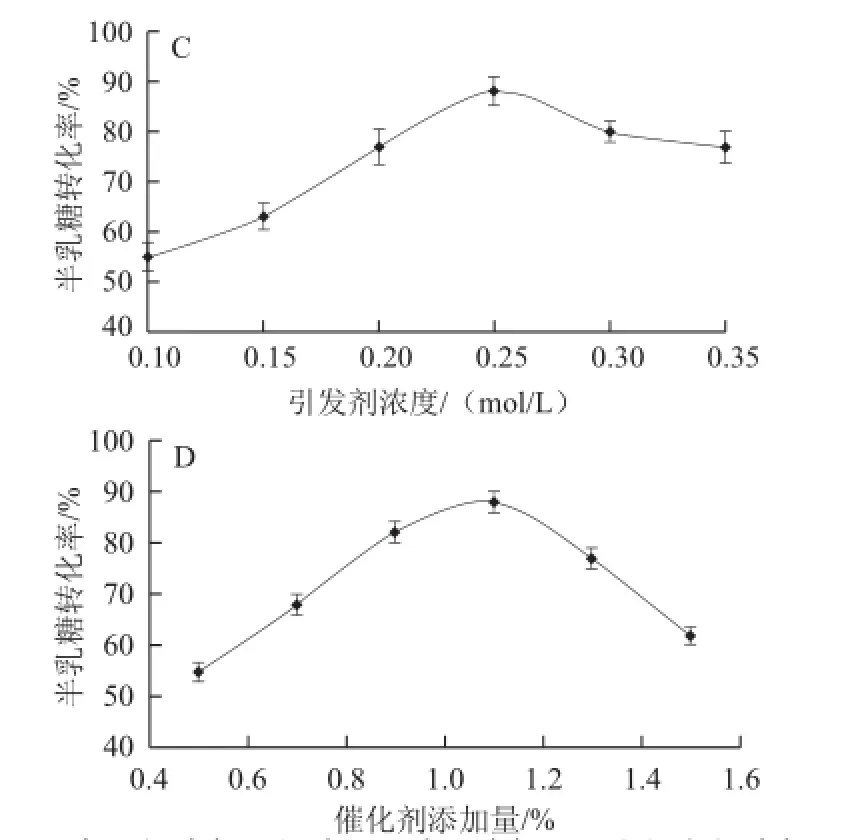
圖1 反應(yīng)溫度(A)、微波輻照時(shí)間(B)、引發(fā)劑濃度(C)以及催化劑添加量(D)對(duì)半乳糖轉(zhuǎn)化率的影響Fig.1 Effects of reaction temperature (A), microwave irradiation time (B), initiator concentration (C) and catalyst doage (D) on galactose conversion rate
糖在酸的催化作用下加熱可脫水縮合生成聚糖[19]。溫度在此縮合反應(yīng)中起著重要作用,本實(shí)驗(yàn)采用微波提供能量,由于微波具有一定的穿透能力,并可直接對(duì)物料進(jìn)行加熱,相比于傳統(tǒng)的間接加熱方式,微波輻照可使物料受熱均勻,從而產(chǎn)生均一的化學(xué)反應(yīng)。圖1A為引發(fā)劑濃度0.3 mol/L、催化劑添加量1.1%、微波輻照5 min條件下溫度變化對(duì)半乳聚糖合成的影響,由圖1A可見(jiàn),反應(yīng)溫度為130 ℃時(shí),半乳糖轉(zhuǎn)化率可達(dá)到91%。
反應(yīng)時(shí)間是半乳聚糖制備過(guò)程中的一個(gè)重要影響因素,本實(shí)驗(yàn)考察反應(yīng)溫度130 ℃,引發(fā)劑濃度0.3 mol/L,催化劑添加量1.1%時(shí),時(shí)間變化對(duì)半乳聚糖合成的影響,由圖1B可見(jiàn),半乳糖的轉(zhuǎn)化率隨反應(yīng)時(shí)間的延長(zhǎng)而提高,當(dāng)反應(yīng)時(shí)間為4.5 min時(shí),轉(zhuǎn)化率達(dá)到最高,隨著反應(yīng)時(shí)間的延長(zhǎng),半乳糖的轉(zhuǎn)化率保持平穩(wěn),可能是反應(yīng)后期,隨著體系中水分的蒸發(fā),酸濃度提高,產(chǎn)物半乳聚糖的酸水解反應(yīng)和原料半乳糖的酸催化縮合反應(yīng)達(dá)到平衡。
微波發(fā)出能量的快速、有效吸收,對(duì)于加速、提高半乳糖的縮合反應(yīng)速率至關(guān)重要。在本實(shí)驗(yàn)的反應(yīng)體系中,由于底物半乳糖為固態(tài),不能吸收微波能量,雜多酸催化劑雖為液態(tài)并且具有極性,但為微量添加,不能很好的吸收微波能量,啟動(dòng)縮合反應(yīng),因此,縮合反應(yīng)需要能夠有效吸收微波能量的引發(fā)劑。氯化鈉溶液作為引發(fā)劑使用具有快速吸收微波能量,迅速提高反應(yīng)體系溫度,以及不影響縮合反應(yīng)進(jìn)行等優(yōu)點(diǎn)。本實(shí)驗(yàn)研究了引發(fā)劑氯化鈉溶液的濃度變化對(duì)半乳糖轉(zhuǎn)化率的影響。結(jié)果表明,在反應(yīng)溫度130 ℃、催化劑添加量1.1%、反應(yīng)時(shí)間5 min、引發(fā)劑濃度0.3 mol/L時(shí),縮合反應(yīng)轉(zhuǎn)化率達(dá)到最大值,如圖1C所示。隨引發(fā)劑濃度的增加,半乳糖轉(zhuǎn)化率降低,原因可能是一定反應(yīng)時(shí)間下,高濃度引發(fā)劑快速吸收能量,使反應(yīng)達(dá)到半乳糖縮合與半乳聚糖水解的平衡點(diǎn),但隨著反應(yīng)時(shí)間的延長(zhǎng),半乳聚糖的水解占優(yōu)勢(shì),因此半乳糖的轉(zhuǎn)化率降低。
雜多酸作為催化劑來(lái)加速半乳糖的縮合反應(yīng),首先在酸催化作用下半乳糖質(zhì)子化成為糖基供體,未質(zhì)子化的半乳糖作為糖基供體,二者在特定反應(yīng)溫度條件下脫水縮合形成半乳糖聚合物。中間產(chǎn)物水作為極性溶劑,可輔助引發(fā)劑吸收微波能量,但由于反應(yīng)溫度(130 ℃)高于水的沸點(diǎn),因此水分蒸發(fā)。當(dāng)催化劑添加量增加時(shí),在特定反應(yīng)時(shí)間(5 min)條件下,酸水解半乳聚糖反應(yīng)速率高于酸催化半乳糖的縮合反應(yīng),因此當(dāng)催化劑添加量高于1.1%時(shí),半乳糖的轉(zhuǎn)化率降低,如圖1D所示。
2.2 正交試驗(yàn)結(jié)果
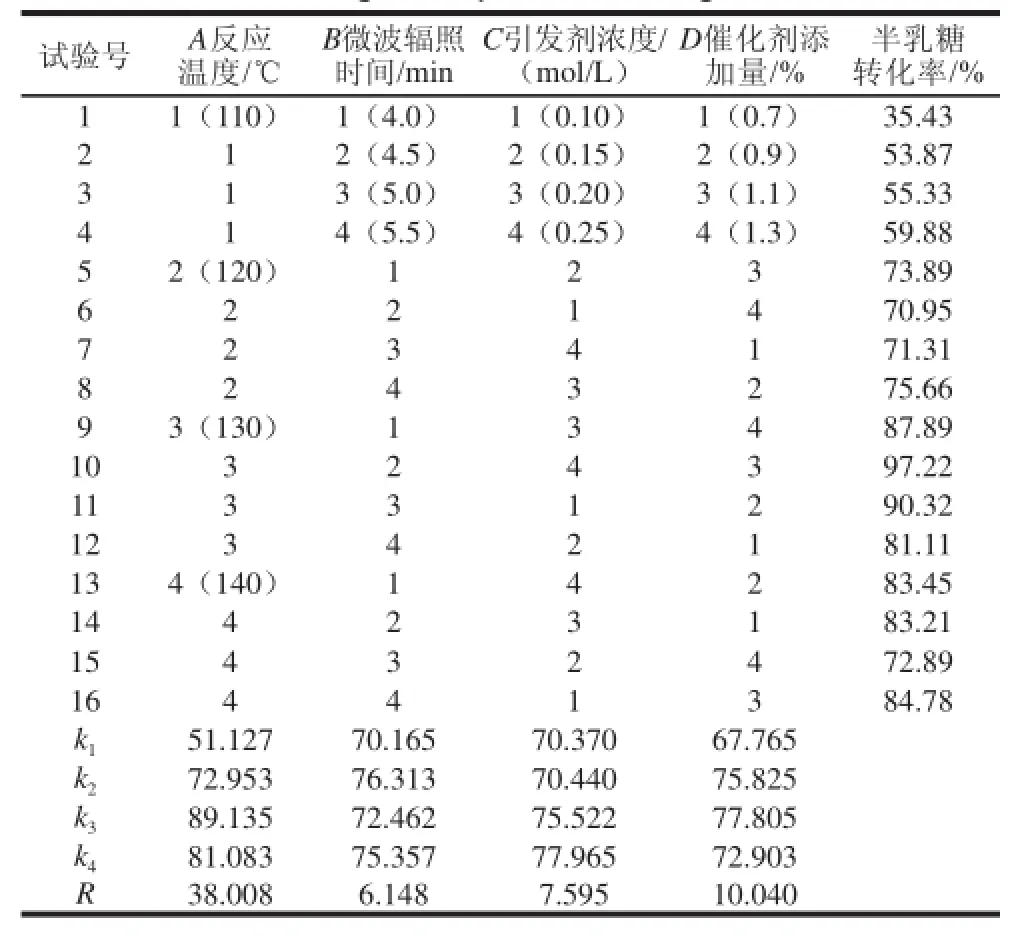
表1 正交試驗(yàn)設(shè)計(jì)及結(jié)果Table 1 Orthogonal experimental design and results
由表1可知,極差R的大小為A>D>C>B,A對(duì)試驗(yàn)結(jié)果影響最大,B影響最小。通過(guò)正交試驗(yàn)得最佳合成條件為A3B2C4D3,在反應(yīng)溫度130 ℃、微波輻照4.5 min、引發(fā)劑濃度0.25 mol/L、催化劑添加量1.1%時(shí),半乳糖轉(zhuǎn)化率最高為97.22%。
2.3 合成產(chǎn)物高效液相色譜分析
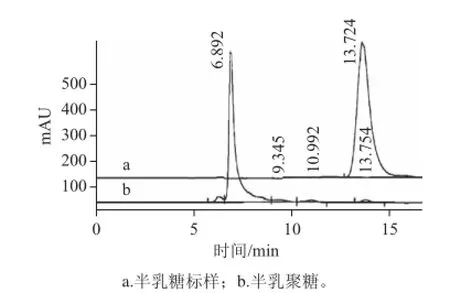
圖2 合成產(chǎn)物高效液相色譜圖Fig.2 HPLC of synthetic products
如圖2所示,微波輔助合成半乳聚糖產(chǎn)物中,半乳聚糖約占92.23%,低聚半乳糖約占4.99%,半乳糖占2.78%(保留時(shí)間13.724 min)。半乳糖轉(zhuǎn)化率為97.22%。
2.4 合成產(chǎn)物的分離、純化
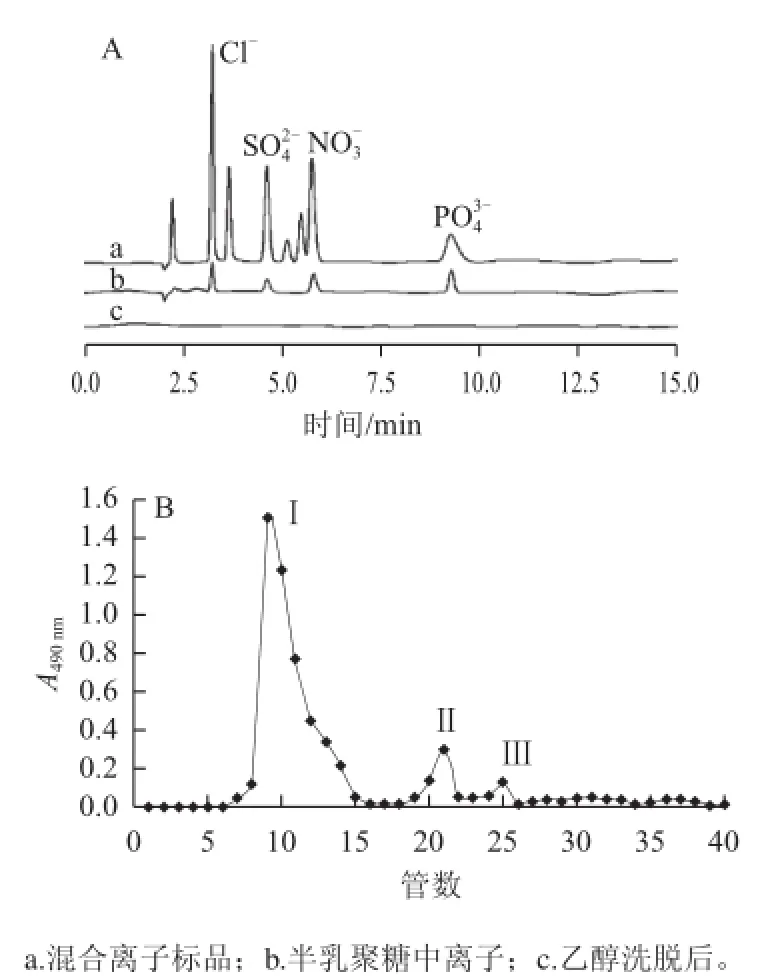
圖3 合成產(chǎn)物乙醇沉淀后的HPAEC圖(A)以及乙醇沉淀后半乳聚糖的Sephadex G-25洗脫曲線(B)Fig.3 HPAEC of synthetic products after ethanol precipitation (A) and Sephadex G-25 elution curve of galactan precipitated by ethanol (B)
微波輔助合成的半乳聚糖產(chǎn)物中含有催化劑及引發(fā)劑,乙醇洗脫可以將其有效去除。如圖3A所示,經(jīng)乙醇洗脫后,半乳聚糖產(chǎn)物中的雜多酸得到有效去除。乙醇洗脫后濃縮干燥的半乳糖經(jīng)Sephadex G-25葡聚糖凝膠柱分析,如圖3B所示,得3 個(gè)洗脫峰,將峰Ⅰ對(duì)應(yīng)洗脫液收集并濃縮干燥,得半乳聚糖葡聚糖凝膠柱分離樣品。
2.5 分子質(zhì)量測(cè)定
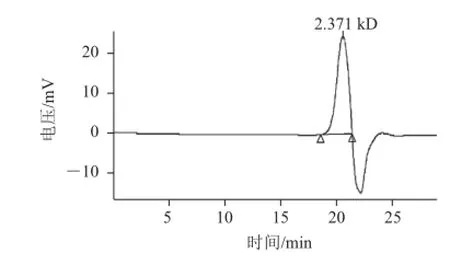
圖4 半乳聚糖的高效凝膠滲透色譜圖Fig.4 HPGPC of galactan
高效凝膠過(guò)濾色譜分析葡聚糖凝膠柱分離的半乳聚糖樣品,得到單一、狹窄、對(duì)稱的色譜峰,表明收集到的半乳聚糖為均一組分。如圖4所示,半乳聚糖的重均分子質(zhì)量(Mw)為2.853 kD,數(shù)均分子質(zhì)量(Mn)為2.347 kD,峰位分子質(zhì)量(Mp)為2.371 kD,分子質(zhì)量分布系數(shù)(HI=Mw/Mn)為1.21,平均聚合度為17。HI表明分離純化后的半乳聚糖分子質(zhì)量的多分散程度小,微波輔助合成的主要產(chǎn)物(半乳聚糖)分子質(zhì)量分布均一。
2.6 單糖組成分析
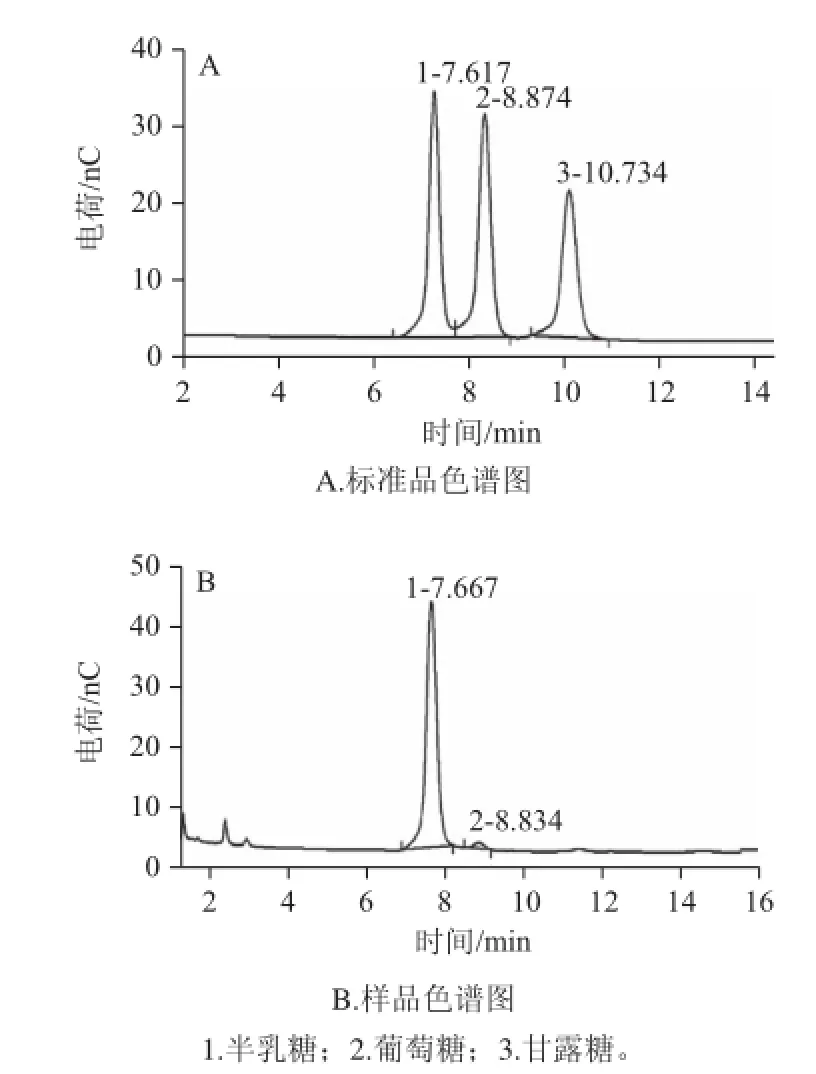
圖5 半乳聚糖三氟乙酸水解物的HPAECC分析Fig.5 HPAEC analysis of galactan hydrolyzed by TFA
半乳聚糖經(jīng)三氟乙酸水解,HPAEC分析表明,如圖5所示,半乳聚糖水解物由半乳糖(保留時(shí)間7.667 min)和微量葡萄糖(保留時(shí)間8.834 min)組成。此結(jié)果表明半乳糖在雜多酸催化下微波輻照脫水縮合生成了半乳聚糖。三氟乙酸水解后產(chǎn)生微量葡萄糖的原因是由于酸的作用使少量半乳糖分子異構(gòu)化為葡萄糖,因此HPAEC圖譜上顯示有微量葡萄糖峰。
2.7 紅外光譜分析
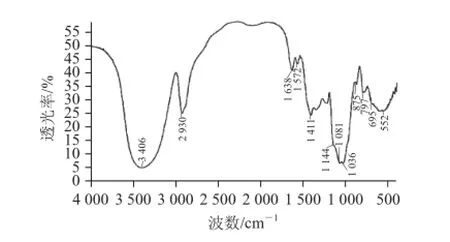
圖6 半乳聚糖的紅外光譜圖Fig.6 IR spectrum of galactan
由圖6可見(jiàn),3 000~3 700 cm-1處有強(qiáng)且寬的吸收峰,是由O—H的伸縮振動(dòng)產(chǎn)生。3 406 cm-1和2930 cm-1處的吸收峰分別由羥基(—OH)和C—H的伸縮振動(dòng)產(chǎn)生[20], 1638、1572 cm-1處為—C=O的吸收峰,1 411 cm-1處的吸收峰為—C—O振動(dòng)產(chǎn)生[21]。1 144、1 081、1 036 cm-1處為半乳聚糖的特征吸收峰,875 cm-1和797 cm-1處的吸收峰表明半乳聚糖中存在α-和β-構(gòu)型,695 cm-1處的小峰為半乳糖的特征吸收峰。
2.81H-NMR光譜分析
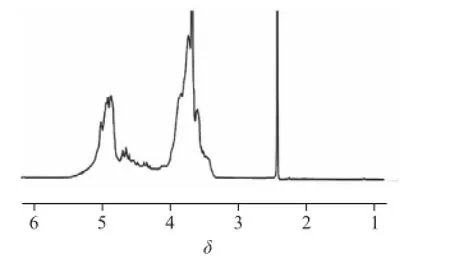
圖7 半乳聚糖的1H-NMR(400 MHz、255 ℃)Fig.7 400 MHz1H-NMR spectrum of galactan recorded at 25 ℃
1H-NMR能夠提供糖的α-或β-異頭碳的構(gòu)型信息,對(duì)于兩種構(gòu)型的端基質(zhì)子,大多數(shù)的α-端基質(zhì)子化學(xué)位移出現(xiàn)在δ 5~6之間,而大多數(shù)β-端基質(zhì)子化學(xué)位移出現(xiàn)在δ 4~5之間,H-2到H-6信號(hào)出現(xiàn)在δ 3.2~4.5之間[22]。如圖7所示,半乳聚糖絕大多數(shù)端基質(zhì)子的信號(hào)出現(xiàn)在δ 4~5之間,少部分端基質(zhì)子信號(hào)出現(xiàn)在δ 5~6之間,表明半乳聚糖以β-構(gòu)型為主,同時(shí)有少部分的α-構(gòu)型,與紅外光譜分析結(jié)果相符。
3 結(jié) 論
采用微波輔助酸催化的方法能夠快速、高效的合成半乳聚糖。合成條件為引發(fā)劑濃度0.25 mol/L、催化劑添加量1.1%、反應(yīng)溫度130 ℃、微波輻照4.5 min,半乳糖轉(zhuǎn)化率為97.22%。合成產(chǎn)物經(jīng)乙醇沉淀脫離子,及葡聚糖凝膠色譜柱分離得到平均分子質(zhì)量為2.853 kD,平均聚合度為17的聚半乳糖,離子交換色譜分析聚半乳糖的單糖組成為半乳糖及微量葡萄糖。紅外光譜及1H-NMR分析表明,半乳聚糖具有多糖的結(jié)構(gòu)特征,并且以β-構(gòu)型為主。本研究可為多糖的快速合成及其衍生物的制備提供新的研究思路。
[1] DELATTRE C, FENORADOSOA T A, MICHAUD P. Galactans: an overview of their most important sourcing and applications as natural polysaccharides[J]. Brazilian Archives of Biology and Technology, 2011, 54(6): 1075-1092.
[2] GRIESHOP C M, FLICKINGER E A, FAHEY G C Jr.,. Oral administration of arabinogalactan affects immune status and fecal microbial populations in dogs[J]. Nutrition, 2002, 132(3): 478-482.
[3] CARLUCCI M J, SCOLARO L A, ERREA M I, et al. Antiviral activity of natural sul phated galactans on herpes virus multiplication in cell culture[J]. Planta Medicine, 1997, 63(5): 429-432.
[4] CHATTOPADHYAY K, MATEU C G, MANDAL P, et al. Galactan sulfate of Grateloupia indica: isolation, structural features and antiviral activity[J]. Phytochemistry, 2007, 68(10): 1428-1435.
[5] FARIAS W R L, VALWNT A P, PEREIRA M S, et al. Structure and anticoagulant activity of sulphated galactans: isolation of a unique sulphated galactan from the red algae Botryocladia occidentalis and comparison of its anticoagulant action with that of sulphated galactans from invertebrates[J]. Journal of Bological Chemistry, 2000, 275(38): 299-307.
[6] COOMBE D R, PARISH C R, RAMSHAW I A, et al. Analysis of the inhibition of tumour metastasis by sulphated polysaccharides[J]. International Journal of Cancer, 1987, 39(1): 82-88.
[7] FALSHAW R, BIXLER H J, JOHNDRO K. Structure and performance of commercial-2 carrageenan extracts. Part Ⅲ. Structure analysis and performance in two dairy applications of extracts from the New Zealand red seaweed, Gigartina atropurpurea[J]. Food Hydrocolloids, 2003, 17(2): 129-139 .
[8] 唐仕榮, 劉全德, 苗敬芝, 等. 兩種微波輔助萃取法萃取牛蒡多糖[J].食品科學(xué), 2009, 30(18): 102-105.
[9] 曹崇江, 鞠興榮, 劉曉庚. 微波協(xié)同固體超強(qiáng)酸合成肉桂酸異丙酯[J].食品科學(xué), 2013, 34(24): 1-5.
[10] 王海松, 樂(lè)國(guó)偉, 丁蘇, 等. 微波固相合成葡-半乳低聚糖的工藝研究[J].食品工業(yè)科技, 2008, 29(5): 182-184.
[11] GEORGE C. Chemistry of foods and beverages: recent developments[M]//ALLINGHAM R P. Polydextrose-a new food ingredient: technical aspects. Elsevier Inc., 1982: 293-303.
[12] BAKER C W. Production of sucrose-based carbohydrates for the food industry[J]. Food Technology, 1993, 47: 149-150.
[13] 郭金龍, 陳有君, 孫國(guó)琴, 等. 苯酚-硫酸法測(cè)定杏鮑菇多糖方法的研究[J]. 食品科學(xué), 2008, 29(12): 555-558.
[14] 呂志華, 于廣利, 趙峽, 等. 不同標(biāo)準(zhǔn)品對(duì)HPGPC法測(cè)定多糖相對(duì)分子質(zhì)量的影響[J]. 中國(guó)新藥雜志, 2002, 11(3): 220-221.
[15] WANG Hui, LIU Gang, ZHOU Benhong, et al. Monosaccharide compositional analysis of purified polysaccharide from Tricholoma matsutake by capillary gas chromatography[J]. Journal of Medicinal Plants Research, 2012, 6(10): 1935-1940.
[16] 朱松, 戴軍, 陳尚衛(wèi), 等. 高效陰離子交換色譜法檢測(cè)醬油中的單糖及雙糖[J]. 分析測(cè)試學(xué)報(bào), 2012, 31(11): 1411-1415.
[17] 張匯, 王君巧, 聶少平, 等. 黑靈芝葡聚糖高活性硫酸化產(chǎn)物的制備及分離純化[J]. 食品科學(xué), 2013, 34(23): 128-132.
[18] 劉小如, 張美麗, 胡蔣寧, 等. 油茶粕多糖的分級(jí)純化及結(jié)構(gòu)研究[J].食品科學(xué), 2013, 34(23): 96-102.
[19] MANLEY-HARRIS M, RICHARDS G N. A novel fructoglucan from the thermal polymerization of sucrose[J]. Carbohydrate Research, 1993, 240(40): 183-196.
[20] LIU Chunhui, LIN Qinxiong, GAO Yi, et al. Characterization and antitumor activity of a polysaccharide from Strongylocentrotus nudus eggs[J]. Carbohydrate Polymers, 2006, 67(3): 313-318.
[21] F ENG Hao, LI Jian, WANG Lijuan. Preparation of biodegradable flax shive cellulose-ba sed superabsorbent polymer under microwave irradiation[J]. BioResources, 2010, 5(3): 1484-1495.
[22] CUI S W. Food carbohydrates chemistry, physical properties, and applications[M]. CRC Press: Taylor & Fra ncis Group, 2005: 154-155.
Microwave-Assisted Synthesis and Structural Analysis of Galactan
WANG Hai-song1, SHI Yong-hui1,2, LE Guo-wei1,2,*
(1. Research Center of Food Nutrition and Functional Factors, School of Food Science and Technology, Jiangnan University, Wuxi 214122, China; 2. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Purpose: To develop a rapid and effi cient method to synthesize galactan and analyze the structure of the synthetic product. Methods: For preparation of galactan, gal actose was allowed to undergo a dehydration-condensation reaction initiated by sodium chloride solution and catalyzed by heteropolyacid under m icrowave irradiation. The synthetic product was preci pitated by addition of anhydrous ethanol and purified/fractionated by Sepherdex G-25 column chromatography. The purity and degree of polymerization (DP) were analyzed by high performance gel permeation chromatography (HPGPC), the monosaccharide composition by high performance anion exchange chromatography (HPAEC), and the structure by IR and NMR spectroscopy. Results: The optimal conditions for synthesizing galactan were determined as follows: initiator concentration 0.25 mol/L, catalyst dosage 1.1%, reaction temperature 130 ℃ and microwave irradiation time 4.5 min. Under these conditions, the conversion rate of galactose was 97.22%, and the synthesized product had an average molecular weight of 2.853 kD and a degree of polymerization of 17 and was composed of monosaccharide components such as galactose and trace glucose. IR and1H-NMR analysis showed that the sugar residues in the galactan were dominated by β-confi guration. Conclusion: Galactan can be rapidly and effi ciently synthesized by microwave irradiation under the catalysis of heteropolyacid.
microwave; galactan; structural analyses
TS202.3
A
1002-6630(2014)24-0035-05
10.7506/spkx1002-6630-201424007
2014-03-17
“十二五”國(guó)家科技支撐計(jì)劃項(xiàng)目(2012BAD33B05)
王海松(1981—),男,博士研究生,研究方向?yàn)槭称窢I(yíng)養(yǎng)與功能因子。E-mail:hswang201166@gmail.com
*通信作者:樂(lè)國(guó)偉(1956—),男,教授,博士,研究方向?yàn)槭称窢I(yíng)養(yǎng)與功能因子。E-mail:lgw@jiangnan.edu.cn

