北極王灣海域浮游植物對光照和鹽度變化的適應性研究
崔世開 何劍鋒 何培民 張芳 林凌 馬玉欣
0 引言
坐落于斯匹次卑爾根群島上的新奧爾松地區,受大西洋暖流影響,是北極最溫暖的地區之一。該地區氣候溫和,即使在冬季期間,氣溫也會達到0℃以上。有監測數據顯示:新奧爾松地區氣溫較其他北極高緯地區增溫更快,平均每10年增加0.68℃[1]。它已成為國際上研究北極氣候變化的一個常規監測點。
王灣位于斯匹次卑爾根群島西海岸,是一個半開放性的海灣。它受到了北大西洋暖水團、北極冷水團,及陸地冰川融水的交互影響。夏季,冰川融水伴隨著大量的泥沙等顆粒物注入到灣內,從而降低了該海域的真光層深度[2]。冰川融水的注入在一定范圍內(距離冰川前沿45 km)改變了表層海水(30 m以淺)的鹽度分布[3-5]。另外,大西洋暖流輸送的高溫、高鹽(>34.7)海水也對王灣產生了重要影響。Wang等[6]認為,大西洋暖流在很大程度上影響了灣外40 m以淺的表層海水的理化特性,從而在很大程度上影響了浮游植物的生長以及該地區浮游生物的群落結構。
光照是影響浮游植物生長的一個關鍵性因子,而北極浮游植物對光的適應性十分特殊。現有研究表明:某些浮游植物類群在北極寒冷、黑暗的冬季具備生存下來的能力[7-9]。近幾年,國際上對環境變化中的北極浮游植物已做了相關研究。海水鹽度的下降和泥沙的注入是影響北極近岸表層水微型浮游生物群落組成和多樣性的決定性因素[10]。Li等[11]認為,隨著北冰洋海水鹽度的降低,粒徑<2μm的微微型浮游植物可能會大量繁殖,并占據優勢地位。如果這些變化持續下去,這些微微型的浮游生物將會加速“微型生物食物環”的進程[12],從而改變北冰洋食物鏈的結構。國內陸續有研究人員對北冰洋海域和中心區進行了浮游植物類群改變和環境變化的相關性分析[13-15]。然而,有關浮游植物對北極環境及其變化的適應性研究很少,且沒有王灣相關的記錄。
綜上所述,本研究于現場實驗的基礎上評估王灣浮游植物對光照和鹽度變化的適應性,藉此弄清兩個問題:(1)浮游植物是否能夠適應黑暗環境;(2)冰川融水的注入,對浮游植物生長有何影響。
1 材料和方法
1.1 環境數據和樣品采集
2006年8月初,在斯匹次卑爾根群島新奧爾松地區的王灣海域確定了由5個站位組成的一條斷面(圖1)。利用經校正的SEB 19 plus CTD測定了站位的鹽度、光合有效輻射(photosynthetically active radiation,PAR)和葉綠素a濃度剖面。用2.5 L的Niskin采樣瓶采集5 m水層的水樣。水樣運回新奧爾松海洋實驗室,并立即做實驗處理。用于鹽度實驗的冰川融水采集于新奧爾松機場附近的融水溪流;為了去除大量的泥沙等顆粒物,將采集到的融水靜置于實驗室外的平臺1天時間。開始實驗前,各實驗分別取500 mL水樣用于葉綠素a濃度本底的測定。
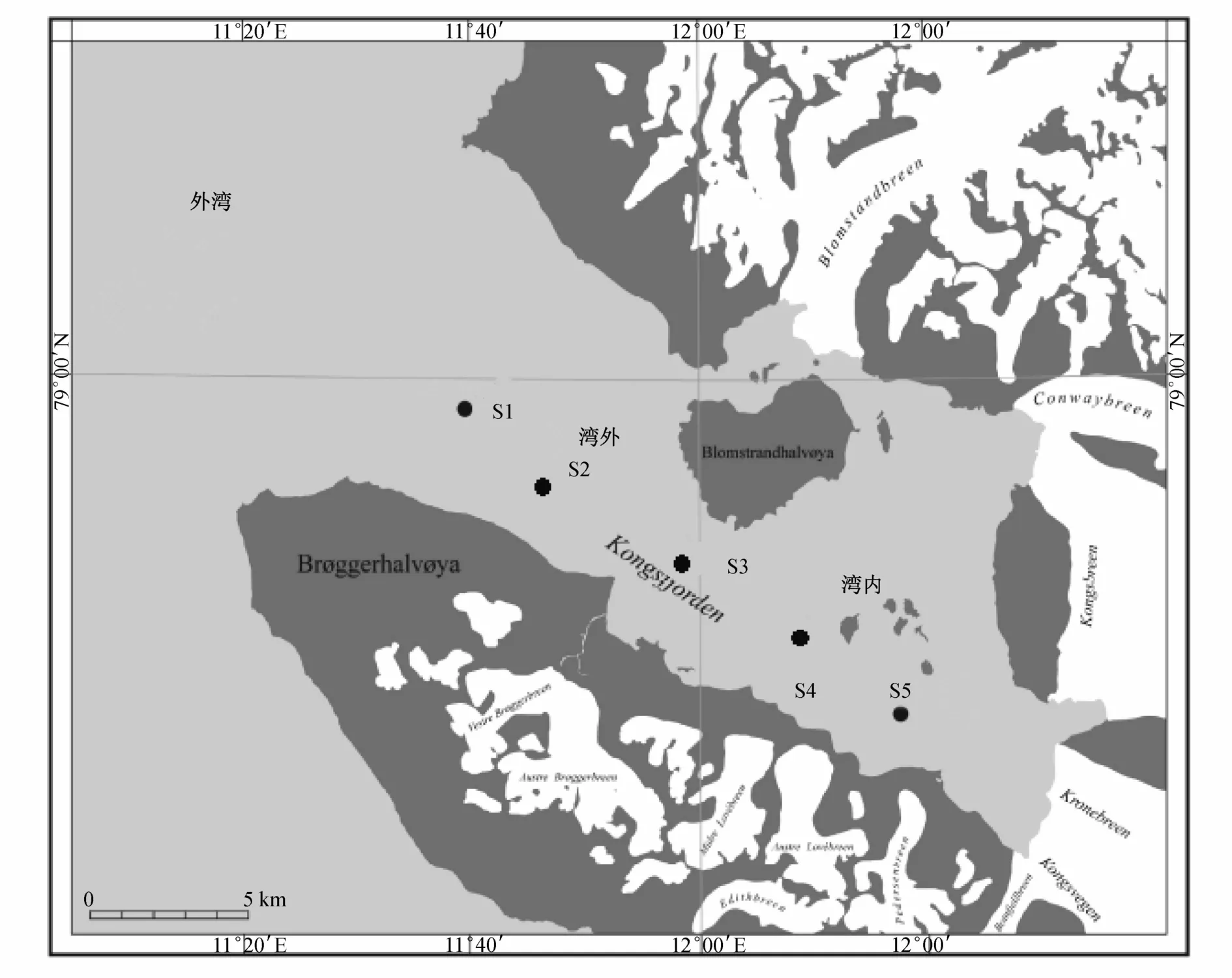
圖1 北極高緯度王灣海域站位分布Fig.1.Sampling sites in Kongsfjorden,high Arctic
1.2 暗適應實驗
1.2.1 培養周期1天
將水樣轉移到5個容積為500 mL、經稀鹽酸浸泡晾干的Nelgene培養瓶中,其中3個培養瓶用鋁箔包裹以保持黑暗的培養環境,另外2個暴露于自然光照條件下。培養實驗在碼頭附近的一個“實驗區”進行,培養1天后將每個培養瓶搖勻,各取200 mL用于葉綠素a濃度的測定。
1.2.2 培養周期10天
實驗采用兩個平行樣。在第一階段,將浮游植物樣品瓶放置于海洋實驗室的培養槽中,并保持完全的黑暗環境。為了保持培養環境的溫度和實際環境中的溫度基本一致,培養中循環水為實驗室內的采水系統于海灣中70 m深采集的連續供應海水。培養瓶每天1次進行搖勻。培養7天后,混合均勻并取100mL水樣用于葉綠素a濃度的測定。而后將培養實驗移到碼頭附近的實驗區,繼續在自然光照下培養3天;培養1天和培養結束時,分別取100 mL和200mL樣品用于葉綠素a濃度的測定。
1.3 鹽度實驗
實驗水樣采集于S2站和S4站。針對每個站位的樣品,各設置6個不同鹽度梯度,海水和冰川融水的混合體積比分別為 100∶0、90∶10、80∶20、60∶40、40∶60和20∶80。每個培養實驗設置3個平行樣。在碼頭附近實驗區培養1天后,每個培養瓶各取200 mL樣品用于葉綠素a濃度的測定。
1.4 葉綠素a濃度的測定
水樣用 GF/F濾膜(Ф47 mm,孔寬0.7μm)過濾,收集濾膜并在低溫環境中(0—4℃)用90%的丙酮溶液萃取24 h,按 Parsons等[16]的方法,利用唐納熒光儀(TURNER10-AU型)測定葉綠素a濃度。
1.5 浮游植物生長率的計算
浮游植物生長速率的計算公式如下:
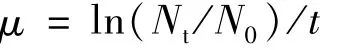
其中,μ是指浮游植物生長速率,Nt是培養后浮游植物生物量(葉綠素a濃度代替),N0是開始培養之前浮游植物生物量(葉綠素a濃度代替),t是培養時間(單位:d)。
2 結果
2.1 研究區域的環境特征
圖2所示為采樣站位上層海水(50 m以淺)鹽度、光合有效輻射(PAR)、葉綠素a濃度的分布情況。受到冰川融水的影響,表層鹽度較低,且隨著水深的增加而升高,并且出現了明顯的鹽度躍層。在5 m層,鹽度從灣外到灣內呈現降低的趨勢,但最低值出現在S2站(31.43)。S1站、S2站,PAR隨水深的增加而快速減弱,水深10 m處的PAR值低于表層的10%。
灣內海水的渾濁度較灣外高。真光層深度從灣外到灣內呈降低的趨勢,其深度在25—30 m之間。除了在灣外S1站,葉綠素a最大值出現在水深20 m處,其他站位葉綠素a濃度的最高值均出現在10—15 m的水層。
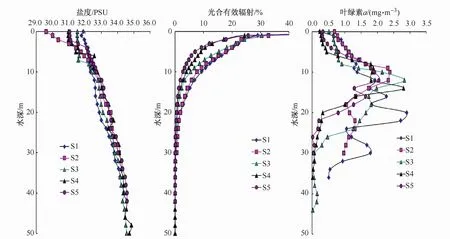
圖2 各采樣站位上層海水(50m以淺)鹽度、光合有效輻射和葉綠素a濃度的垂直分布Fig.2.Profiles of salinity,PAR and Chlorophyll a concentrations in the upper 50 m of the water column
2.2 暗適應實驗
在光照和黑暗條件下培養1天后,葉綠素a平均濃度(3個平行樣)沒有出現明顯的差異,說明浮游植物群落在黑暗條件下仍可以生存。采集于灣外S1站和S2站的水樣,光照條件下培養的浮游植物生長速率分別為-0.04和0.03,而在黑暗條件下,其生長速率分別為-0.31和 -0.1(表1),可見,黑暗條件下培養對浮游植物生長的影響更為明顯。灣內采集的浮游植物群落在黑暗和光照條件下培養,其生長速率沒有明顯差異。圖3顯示了不同站位采集的浮游植物群落在光照和黑暗環境下培養1天后的葉綠素a濃度之比,從灣外到灣內,比率呈現明顯下降的趨勢,表明黑暗環境對灣外浮游植物群落生長的影響更為明顯。
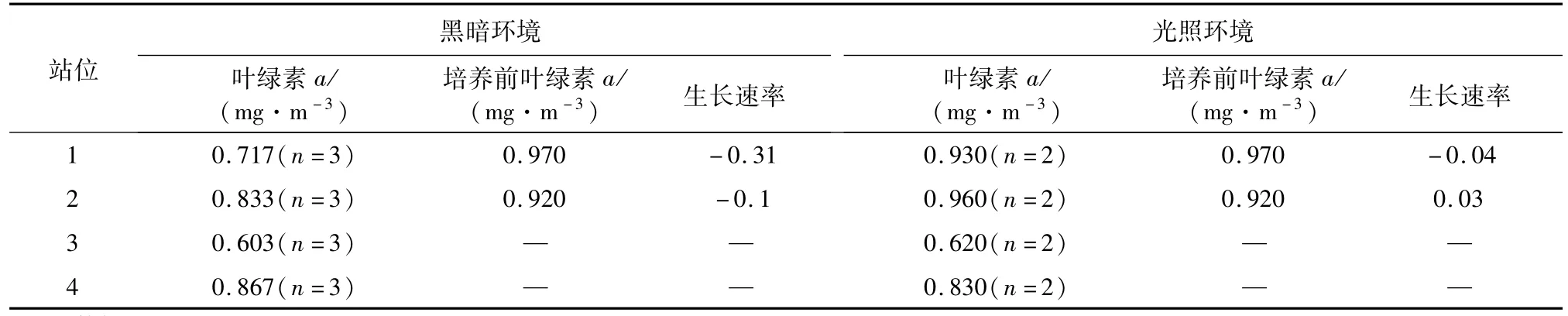
表1 光照和黑暗環境下培養1天后浮游植物生長狀況比較Table 1.Comparison of phytoplankton growth in light and darkness(n=number of samples)after one day incubation
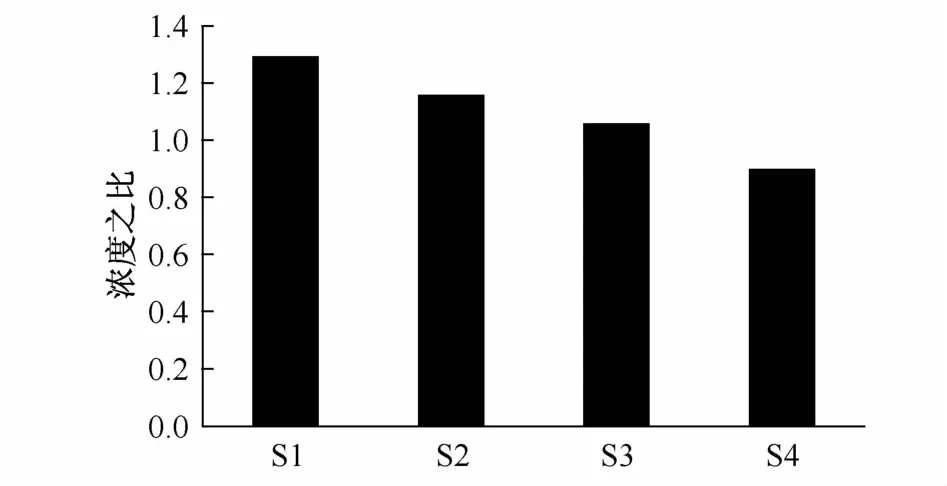
圖3 不同采樣站位的浮游植物在光照和黑暗條件下培養1天后的葉綠素a濃度之比Fig.3.Ratios of Chlorophyll a concentrations in light and darkness after one-day incubation at various stations
在黑暗環境下經過7天的培養后,葉綠素a濃度沒有出現較大的變化。將培養實驗移到自然光照條件下培養1天后,葉綠素a濃度出現明顯下降,而后又開始快速增長。在S2站,在整個培養周期內,浮游植物群落生長速率由0.029下降到-0.126,培養結束后,生長速率又增加到0.088 5。然而,在S4站,生長速率由-0.003下降到 -0.042,在培養結束時增加到 0.163。
圖4所示的結果表明,與S4站比較,采自于灣外S2站的浮游植物表現出更好的對黑暗環境的適應能力。這有可能歸因于兩個站區的浮游植物群落組成和生物量不同。Wang等[6]研究指出,灣內和灣外表層海水存在不同的環境水平和生物類群組成,微型的異養鞭毛蟲生物量在灣外表層水中較高。硅藻對灣外浮游植物生物量的貢獻最大,然而在灣內,自養腰鞭毛藻豐度和多樣性較高[17-18]。2006年8月,灣內的浮游植物有可能受到大量冰川融水注入的影響,導致真光層深度變淺(圖2),從而抑制了其生長。大量的泥沙等顆粒物的注入導致灣內的浮游植物受到了弱光照的影響[19],這可能導致灣內的浮 游 植 物 生 物 量 (1.6 mg·m-3)較 灣 外 的 低(1.8 mg·m-3)。
另外,在黑暗環境中經過7天培養后,當將培養暴露于自然光下后,浮游植物生物量出現急劇的下降,這表明強光照對浮游植物群落中部分“暗適應”能力較強的生物類群的生長產生了抑制作用。
2.3 鹽度實驗
圖5顯示在模擬海水溫度和自然光照下,浮游植物群落在不同的鹽度環境中,其生長速率隨鹽度的變化曲線。當稀釋比例(冰川融水和海水的混合體積比)為10∶90時,浮游植物群落生長速率最高,當稀釋比例增加或降低而使鹽度值減少或增加時,浮游植物生長速率隨之減低。稀釋比例為0時,浮游植物生長速率較稀釋比例為20∶80的高;稀釋比例為80∶20時,所觀察到的生長速率最低。在S2站,當稀釋比例達60∶40時,浮游植物群落生長速率和未作稀釋的培養樣中的生長速率接近;而在S4站,出現相似情況時,只需要稀釋比例達20∶80即可。這也反映出灣內的浮游植物群落在鹽度實驗前就已受到冰川融水更為顯著的影響。
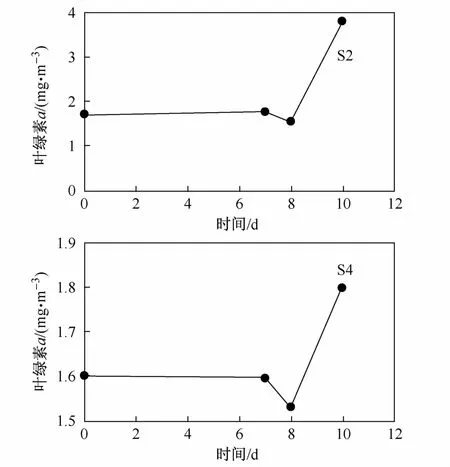
圖4 在黑暗/光照環境下浮游植物葉綠素a濃度的變化Fig.4.Temporal variation in Chlorophyll a concentration in light-dark conversion experiment
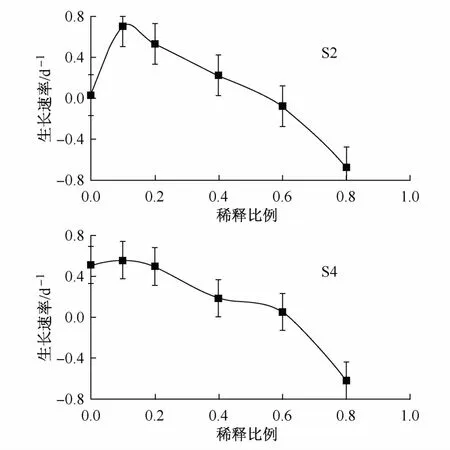
圖5 不同鹽度條件下的浮游植物生長速率Fig.5.Growth rate of phytoplankton under different dilutions in salinity experiments
3 討論
3.1 浮游植物對黑暗環境的適應能力
有報道指出,高緯海域的浮游植物對暗環境具有一定適應能力[7]。本研究的結論也佐證了前人的研究,說明高緯海域浮游植物群落能在黑暗環境中生存。利用熒光顯微分析對冬季(極夜)北冰洋中心區調查研究顯示:粒徑在2μm左右的浮游植物類群大量存在,并且在之后的春季浮冰冰下水華浮游植物群落中占據較大的比重[8]。連續的季節性觀測顯示:浮游植物某些類群能在冬季極夜條件下生存,能夠在較低濃度下保持自身色素的完整性,以便在晚冬或早春當太陽光出現時,浮游植物群落能夠生長、繁殖[9]。其中,混合營養型浮游植物具備兩種生活方式:既能進行光合自養,又能靠異養方式從外界獲取能量。這可能是該類浮游植物能在低光照強度的高緯度海域生存的原因之一。混合營養型在極地海洋或淡水環境中普遍存在,多數研究認為該類群在極區非常重要[17-18]。定鞭藻類[7]或者其他冰下微藻具備葉綠體,可能都是屬于混合營養型浮游植物[19],其營養方式可能包括“滲透營養型”和“吞噬營養型”。能夠適應低光照強度的嗜冷性浮游植物存在于極地海洋中[20-24],觀測指出,當將嗜冷性浮游植物從低光照強度轉到高光照強度的環境中后,會導致其光合效率下降[19]。
3.2 鹽度變化對浮游植物生長的影響
Fredersdorf等[25]指出,一種北冰洋褐藻 Alaria esculenta能夠適應和忍受一定范圍內的鹽度變化。研究表明,鹽度變化對南北極冰藻的生長及浮游植物群落組成都具有很大程度的影響[26-27]。在一定程度上,冰藻能適應鹽度的降低,然而,北冰洋浮游植物群落能否適應較低的鹽度值得進一步研究。在灣內和灣外的不同站位之間,浮游植物群落生長速率不同;我們認為可能是因為不同站位間,浮游植物群落組成有差異,盡管沒能夠研究該海灣浮游植物群落組成,以及在不同鹽度下,培養前后的浮游植物組成變化情況。王灣是一個小海灣,其中一面是開闊海域。在海灣中部形成一海底山脊,并將海灣分成了兩部分,其中,灣外主要受到斯匹次卑爾根暖流的影響,而灣內主要受到冰川融水的影響[4]。灣內復雜水團的交匯作用是導致浮游植物群落組成變化的主要因素。硅藻是對浮游植物生物量貢獻最大的類群,特別是在灣外海域。然而,自養腰鞭毛藻是灣內浮游植物生物量最主要的貢獻者[28-29]。研究表明:在表層水中,腰鞭毛藻和金藻Dinobryon balticum占主導地位,而硅藻和定鞭藻Phaecystis pouchetii的豐度則會隨水深的增加而增加[30]。顯微鏡和分子生物學技術分析顯示:2006年度夏期間,王灣腰鞭毛藻多樣性較高[31]。
如圖5所示,在較低的稀釋比例下,采自S4站的浮游植物生長速率較S2站的穩定。這反映出受冰川融水的影響,從灣外到灣內的鹽度逐漸降低。和灣內比較,灣外的浮游植物群落對淡水輸入所導致的鹽度變化更敏感。Wang等[6]研究指出,整個灣表層水的鹽度值較低(31.5),受冰川融水的影響,灣內的鹽度值更低。隨著所添加冰川融水量的不同,浮游植物生長速率也會不同,該現象可能由兩方面原因導致。
(1)有利方面冰川融水的添加減少了浮游動物對浮游植物的攝食壓力[32],從而促進了浮游植物的生長。另外,鹽度變化會影響浮游動物的存活率,也將減少浮游動物的攝食壓力。同時,不同量融水的添加,改變了各組樣品中營養鹽含量的水平。融水的添加,使得浮游植物可吸收的營養鹽含量增加。然而,本研究的培養時間較短、浮游植物的生長速率也不是很高,營養鹽不應成為浮游植物生長的限制因子。
(2)不利方面由于培養樣品受到融水的稀釋,自然光照強度減弱,鹽度降低,這對浮游植物的生長起了抑制作用。由本研究的暗實驗結果可見,浮游植物群落具有一定的暗環境適應能力。而鹽度實驗顯示,當融水和海水的混合比例增加到80∶20時,浮游植物的生長速率減小到最低值,這表明鹽度是影響浮游植物生長的一個關鍵因子。大量融水的輸入降低了表層海水鹽度、溫度,融水成為其他微型生物、污染物和有機碳的來源之一[33-36],對浮游植物影響過程可能極為復雜。本研究的模擬實驗是基于王灣海域夏季受大量冰川融水注入的實際而制定的,若要深入了解冰川融水注入對浮游植物群落的影響,應在群落結構變化等方面開展更為深入的研究。
4 結論
通過模擬實驗揭示,采自于王灣的浮游植物群落在暗光條件下仍能夠生存,從側面反映出該浮游植物群落具備一定的暗適應能力,另外,適量的冰川融水所導致的鹽度變化能夠促進浮游植物的生長,但是更低的鹽度則會抑制浮游植物的正常生長,暗示了北極持續變暖所導致冰川融水的大量注入可能會對浮游植物生長不利。由于現場條件的限制,初次模擬實驗中,本研究只分析了浮游植物葉綠素a的變化情況,未來開展實驗時,將會著重分析初級生產力、浮游植物組成及其數量的變化,并以此來評估北極環境變化對浮游植物的影響。
1 Deng H B,Lu L H,Bian L G.Short-term climate characteristics at Ny-?lesund over the Arctic Tundra Area.Chinese Journal of Polar Science,2005,16(2):109—120.
2 Somerfield P J,Cochrane S J,Dahle S,etal.Free-living nematodes and macrobenthos in a high-latitude glacial fjord.Journal of ExperimentalMarine Biology and Ecology,2006,330(1):284—296.
3 Keck A,Wiktor J,Hapter R,et al.Phytoplankton assemblages related to physical gradients in an arctic,glacier-fed fjord in summer.Ices Journal of Marine Science,2001,56:203—214.
4 Hop H,Falk-Peterson S,Svendsen H,et al.Physical and biological characteristics of the pelagic system across Fram Strait to Kongsfjorden.Progress in Oceanography,2006,71(2-4):182—231.
5 Svendsen H,Beszczynska-M?ller A,Hagen JO,et al.The physical environment of Kongsfjorden-Krossfjorden,an arctic fjord system in Svalbard.Polar Research,2002,21(1):133—166.
6 Wang G,Guo C,LuoW,etal.The distribution of picoplankton and nanoplankton in Kongsfjorden,Svalbard during late summer2006.Polar Biology,2009,32(8):1233—1238.
7 Ban A,Aikawa S,Hattori H,et al.Comparative analysis of photosynthetic properties in ice algae and phytoplankton inhabiting Franklin Bay,the Canadian Arctic,with those in mesophilic diatoms during CASES(2003—3004).Polar Bioscience,2006,19:11—28.
8 Sherr E B,Sherr B F,Wheeler PA,etal.Temporal and spatial variation in stocksof autotrophic and heterotrophicmicrobes in the upperwater column of the central Arctic Ocean.Deep-Sea Research PartⅠ:Oceanographic Research Papers,2003,50(5):557—571.
9 Lovejoy C,VincentW F,Bonilla S,etal.Distribution,phylogeny,and growth of cold-adapted picoprasinophytes in Arctic Seas.Journal of Phycology,2007,43(1):78—89.
10 Piquet M T,Scheepen JF,Bolhuis H,et al.Variability of protistan and bacterial communities in two Arctic fjords(Spitsbergen).Polar Biology,2010,33(11):1521—1536.
11 LiW KW,Mclaughlin F A,Lovejoy C,et al.Smallest algae thrive as the Arctic Ocean freshens.Science,2009,326(5952):539.
12 VincentW F.Microbial ecosystem responses to rapid climate change in the Arctic.The ISME Journal,2010,4(9):1087—1090.
13 張芳,何劍鋒,郭超穎,等.夏季北冰洋楚科奇海微微型、微型浮游植物和細菌的豐度分布特征及其與水團的關系.極地研究,2012,24(3):238—246.
14 莊燕培,金海燕,陳建芳,等.北冰洋中心區表層海水營養鹽及浮游植物群落對快速融冰的響應.極地研究,2012,24(2):151—158.
15 石涵琨,羅瑋,高穎,等.夏季北極斯瓦爾巴群島周邊海域微型浮游生物群落分布特征及環境影響初探.海洋開發與管理,2013,1:39—45.
16 Parsons T R,Maita Y,Lalli C M.A Manual of Chemical and Biological Methods for Seawater Analysis.Oxford:Pergamon Press,1984.
17 Horner R,Alexander V.Algal populations in Arctic sea ice:an investigation of heterotrophy.Limnol Oceanogr,1972,17(3):454—458.
18 Laybourn-Parry J,MarshallW A.Photosynthesis,mixotrophy andmicrobial plankton dynamics in two high Arctic lakes during summer.Polar Biology,2003,26(8):517—524.
19 Jones H L J,Leadbeater B SC,Green JC.Mixotrophy in haptophytes∥Green C,Leadbeater B SC.The Haptophyte Algae.Oxford:Clarendon Press,1994:247—263.
20 Wiktor J.Early springmicroplankton development under fast ice covered fjords of Svalbard,Arctic.Oceanologia,1999,41(1):51—72.
21 Ikeya T,Kashino Y,Kudoh S,et al.Acclimation of photosynthetic properties in psychrophilic diatom isolates under different light intensities.Polar Bioscience,2000,13:43—54.
22 Lizotte M P,Sullivan CW.Rates of photoadaptation in sea ice diatoms from McMurdo Sound,Antarctica.Journal of Phycology,1991,27(3):367—373.
23 McMinn A,Hegseth E N.Quantum yield and photosynthetic parameters ofmarinemicroalgae from the southern Arctic Ocean,Svalbard.Journal of the Marine Biological Association of the UK,2004,84(5):865—871.
24 Michel C,Legendre L,Demers S,et al.Photoadaptation of sea-icemicroalgae in springtime:photosynthesis and carboxylating enzymes.Marine E-cology Progress Series,1988,50:177—185.
25 Fredersdorf J,Mülle R,Becker S,et al.Interactive effects of radiation,temperature and salinity on different life history stages of the Arctic kelp Alaria esculenta(Phaeophyceae).Oecologia,2009,160(3):483—492.
26 Zhang Q,Gradinger R,Spindler M.Experimental study on the effectof salinity on growth rates of Arctic-sea-ice algae from the Greenland Sea.Boreal Environment Research,1999,4(1):1—8.
27 Ryan K G,Ralph P,McMinn A.Acclimation of Antarctic bottom-ice algal communities to lowered salinities duringmelting.Polar Biology,2004,27(11):679—686.
28 Piwosz K,WalkuszW,Hapter R,etal.Comparison of productivity and phytoplankton in awarm(Kongsfjorden)and a cold(Hornsund)Spitsbergen fjord in mid-summer 2002.Polar Biology,2009,32(4):549—559.
29 Okolodkov Y B,Hapter R,Semovski SV.Phytoplankton in Kongsfjorden,Spitsbergen,July 1996.Sarsia,2000,85(4):345—352.
30 Hasle GR,Heimdal B R.The netphytoplankton in Kongsfjorden,Svalbard,July 1988,with general remarks on species composition of arctic phytoplankton.Polar Research,1998,17(1):31—52.
31 Luo W,Dai C J,Li H R,et al.Phylogenetic diversity of dinoflagellates in polar regions.Advances in Polar Science,2011,22(1):35—41.
32 Landry M R,Hasset R P.Estimating the grazing impact ofmarinemicro-zooplankton.Marine Biology,1982,67(3):283—288.
33 Thomas D N,Dieckmann G S.Antarctic sea ice—a habitat for extremophiles.Science,2002,295(5555):641—644.
34 Pfirman S L,Eicken H,Bauch D,et al.The potential transport of pollutants by Arctic sea ice.Science of the Total Environment,1995,159(2-3):129—146.
35 Maranger R,Bird D F,Juniper SK.Viral and bacterial dynamics in Arctic sea ice during the spring algal bloom near Resolute,N.W.T.,Canada.Marine Ecology Progress Series,1994,111:121—127.
36 Krembs C,Eicken H,Junge K,et al.High concentrations of exopolymeric substances in Arctic winter sea ice:implications for the polar ocean carbon cycle and cryoprotection of diatoms.Deep-Sea Research PartⅠ:Oceanographic Research Papers,2002,49(12):2163—2181.

