二甲雙胍通過抑制MAPK信號通路增強卵巢癌細胞對順鉑的敏感性*
謝婭張穎史明星
二甲雙胍通過抑制MAPK信號通路增強卵巢癌細胞對順鉑的敏感性*
謝婭①張穎①史明星①
目的:探討二甲雙胍是否可以提高卵巢癌細胞對順鉑的敏感性及相關的作用機制。方法:BRDU ELISA方法檢測順鉑聯合或者不聯合二甲雙胍對SKOV3細胞增殖的影響;二甲雙胍聯合或者不聯合MAPK信號通路阻斷劑后BRDU ELISA方法檢測細胞增殖的變化。Western blotting檢測二甲雙胍作用下卵巢癌細胞系SKOV3的磷酸化AMPK/總AMPK水平和磷酸化p38 MAPK/總MAPK水平的變化。結果:(1)二甲雙胍不僅能抑制卵巢癌細胞系SKOV3細胞的增殖,而且能提高對順鉑的敏感性,并且這種作用是依賴于AMPK激活的;(2)p38 MAPK阻斷劑SB203580能夠抑制SKOV3的增殖,二甲雙胍能夠增強這種抑制作用。結論:二甲雙胍可增強順鉑對卵巢癌細胞的抑制作用,并且二甲雙胍可能通過激活AMPK信號通路進而抑制MAPK信號通路增加順鉑對卵巢癌細胞的抑制增殖作用。
二甲雙胍; 卵巢癌; AMPK; MAPK; 順鉑; 細胞增殖
卵巢癌是死亡率最高的一種婦科惡性腫瘤,大約70%的患者就診時已經是晚期(FIGO分期Ⅲ~Ⅳ期)。卵巢癌的標準治療是首次腫瘤細胞減滅術,接著每3周1次的鉑類和紫杉醇聯合化療。雖然卵巢癌手術和化療技術已經得到很大發展,但由于對化療不敏感和化療耐藥的發生,目前晚期卵巢癌5年生存率不到30%[1-3]。因此,急需找尋一種新的提高化療效果的治療方法以改善卵巢癌患者的預后。
MAPK信號通路在多種惡性腫瘤(包括卵巢癌)細胞的增殖、凋亡和化療藥物作用及化療藥物耐受發生中起重要作用[4-6]。MAPK家族包括p38 MAPK、細胞外信號調節蛋白激酶(ERK)、c-jun氨基末端激酶(JNK)等多個亞家族。這些亞族組成多條信號通路,其中最主要的有P38途徑、ERK1/2途徑和JNK途徑。MAPK家族成員被磷酸化激活后,將細胞外的各種刺激信號傳遞到細胞內,引起細胞內級聯反應,調節細胞的增殖、凋亡及對藥物的敏感性[7]。有研究發現激活的AKT和MAPK,依次磷酸化BAD和BCL-2,進而削弱鉑類和紫杉烷的促進細胞凋亡作用[8]。筆者前期研究發現MAPK信號通路在晚期上皮性卵巢癌組織中異常激活,并發現磷酸化p38 MAPK在耐藥卵巢癌組織中表達較非耐藥卵巢癌組織中升高。
二甲雙胍是一種用于治療2型糖尿病的雙胍類降糖藥,最近兩項大型流行病學調查研究表明:長期服用二甲雙胍能夠降低卵巢癌的發病率,而且二甲雙胍能夠顯著延長卵巢癌合并糖尿病患者的無進展生存期[9]。二甲雙胍通過STK11(也稱LKB1)激活AMPK,激活過程涉及多個參與細胞增殖調節的信號通路,其中包括MAPK信號通路[10]。但二甲雙胍是否能夠增加化療藥物對卵巢癌細胞的敏感性及相關的作用機制研究尚屬空白。
本研究首先觀察二甲雙胍對卵巢癌細胞增殖的影響,以及二甲雙胍是否可增強順鉑的化療敏感性,并通過檢測二甲雙胍對化療藥物相關的重要信號通路MAPK信號通路的調節作用來探討相關的作用機制。以期尋找能提高卵巢癌化療敏感性的新的治療方案。
1 材料與方法
1.1 細胞系和試劑 人卵巢漿液性乳頭狀囊腺癌細胞系SKOV3,中、高分化,貼壁生長,購于中國醫學科學院細胞庫,置于37 ℃、5% CO2培養箱中培養。細胞系常規3~5 d傳代。兔抗人p38 MAPK多克隆抗體、兔抗人P-p38 MAPK單克隆抗體;兔抗人AMPK多克隆抗體、兔抗人P-AMPK單克隆抗體,兔抗人GAPDH單克隆抗體購自Cell signaling公司;二甲雙胍、順鉑購自美國Sigma公司,胎牛血清購自杭州四季青公司;Western blotting檢測試劑盒購自武漢博士德公司;Trizol 試劑購自美國Invitrogen公司;BrdU標記及檢測試劑盒購自德國Roche公司。
1.2 方法
1.2.1 Brdu檢測細胞增殖 用BrdU-ELISA試劑盒(Roche)檢測細胞增殖的變化。不同濃度二甲雙胍對SKOV3細胞增殖的影響:取對數生長期的SKOV3細胞,消化后調整細胞濃度為1.0×105/mL,加入96孔板中,每孔200 μL。(1)二甲雙胍組:加入不同濃度二甲雙胍(0.01 mM、0.1 mM、1 mM);(2)對照組:加入等量的PBS為對照組。加入等量含2%胎牛血清的RPMI 1640培養基,置于37 ℃、5% CO2、相對濕度90%的培養箱中培養48 h后,BRDU法檢測不同濃度二甲雙胍對SKOV3細胞增殖的影響。
取對數生長期的SKOV3細胞,消化后調整細胞濃度為1.0×105/mL,加入96孔板中,每孔200 μL。實驗分組:(1)順鉑組:將順鉑加到細胞懸液中,終濃度分別為1、2、4、6 ng/mL;(2)二甲雙胍+順鉑組:將順鉑加到細胞懸液中,終濃度分別為1、2、4、6 ng/mL,并均加入二甲雙胍至終濃度為0.1 mM,每一濃度設3個平行孔,共兩組;將細胞置于37 ℃、5% CO2、相對濕度90%的培養箱中培養48 h后,BrdU-ELISA試劑盒檢測細胞增殖的變化。實驗過程:細胞用10 μL/well BrdU labeling solution 37 ℃孵育2 h,倒掉labeling solution,加入200 μL/well Fix Denat 20 ℃孵育30 min,倒掉Fix Denat液,加入100 μL/well anti-BrdU-POD工作液20 ℃孵育90 min,然后去除工作液,用洗液洗3次。最后,去除洗液,加入100 μL/well底物液20 ℃孵育20 min,然后加入25 μL的1 M H2SO4,1 min后用450 nm波長檢測吸光值(參考波長:690 nm),每次3個復孔,重復3次實驗。同時用MTT方法驗證BrdU技術的有效性(數據中沒有顯示)。方法同上,實驗重復3次。
1.2.2 Western blotting 取對數生長期的SKOV3細胞,消化后調整細胞濃度為5.0×105/mL,加入6孔板中,每孔2 mL,孵育24 h后加藥。實驗分組:二甲雙胍組:將二甲雙胍(10、20 mM)加入細胞懸液,每一濃度設3個平行孔;對照組:加入與二甲雙胍等量的PBS。加入等量含2%胎牛血清的RPMI 1640培養基,置于37 ℃、5% CO2、相對濕度90%的培養箱中培養。孵育12 h后,提取兩組細胞總蛋白,Western blot法檢測AMPK、photo-AMPK/Total-AMPK、Photo-p38 MAPK/p38 MAPK蛋白的表達情況。具體步驟如下: 用 RIPA(1% NP40,0.5 sodium deoxycholate and 0.1% SDS)提取細胞蛋白,加樣于10% SDS-PAGE中,然后轉到硝酸纖維素膜上。用5%的脫脂牛奶和0.1% Tween室溫孵育1 h,然后用一抗(Cyclin D1,photo-AMPK,total-AMPK,GAPDH)4 ℃孵育(1:1000,CST)過夜。用PBST洗膜5 min,3次后,HRP連接的二抗(1:2000,CST)孵育2 h。最后再用PBST洗膜5 min,3次。用ECL試劑盒檢測硝酸纖維素膜上的條帶。用GAPDH(1:1000,CST)來校正上樣量。蛋白條帶包括GAPDH,均用Quantity One(Bio-Rad,Hercules,CA)成像程序檢測光密度值。實驗重復3次。
1.3 統計學處理 采用SPSS 17.0統計學軟件對數據進行處理,組間差異采用單因素方差分析,以P<0.05為差異有統計學意義。
2 結果
2.1 二甲雙胍抑制卵巢癌細胞增殖的情況 二甲雙胍能夠抑制卵巢癌細胞增殖,并且這種抑制作用能夠被Compound C所削弱。隨著二甲雙胍濃度(1×10-3mol/L,1×10-4mol/L,1×10-5mol/L)的增加,其對卵巢癌細胞SKOV3增殖的抑制作用逐漸增強(*P<0.05,**P<0.01)。其中1×10-4mol/L 和1×10-5mol/L的二甲雙胍能夠顯著抑制子宮內膜癌細胞的生長。而AMPK阻斷劑Compound C(5×10-7mol/L,1×10-6mol/L)均可削弱二甲雙胍的這種抑制卵巢癌細胞增殖的作用。1×10-6mol/L Compound C與二甲雙胍聯合應用,其對卵巢癌細胞增殖的抑制作用與空白對照組比較差異無統計學意義(P>0.05),見圖1。
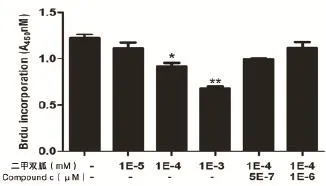
圖1 二甲雙胍抑制卵巢癌細胞增殖情況
2.2 二甲雙胍能夠增強卵巢癌對順鉑的敏感性 將不同濃度的順鉑(1、2、4、6 ng/L)加入卵巢癌細胞SKOV3中,加入或者不加入0.1 mM二甲雙胍孵育細胞48 h后,結果表明:0.1 mM的二甲雙胍聯合順鉑(1、2、4、6 ng/mL)作用于卵巢癌細胞時,順鉑抑制卵巢癌細胞生長的作用顯著增強(P<0.05)。其中6 ng/mL順鉑聯合0.1 mM的二甲雙胍對卵巢癌細胞的抑制作用最顯著(P<0.05),見圖2。
2.3 二甲雙胍聯合p38 MAPK阻斷劑SB203580能夠增強二甲雙胍的抗卵巢癌細胞增殖的作用 單獨應用SB203580(5、10 μM)能抑制卵巢癌SKOV3的增殖,差異有統計學意義(P<0.05)。二甲雙胍(0.1 mM)和SB203580(5、10 μM)聯合應用對卵巢癌細胞SKOV3增殖的抑制作用顯著增強(*P<0.05,**P<0.01)。其中0.1 mM二甲雙胍與10 μM p38 MAPK阻斷劑SB203580聯合應用對卵巢癌細胞SKOV3增殖的抑制作用最顯著(**P<0.01),見圖3。
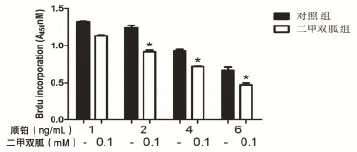
圖2 兩組對順鉑敏感性的比較
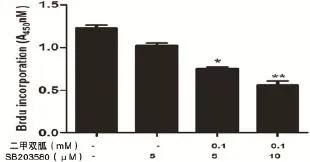
圖3 二甲雙胍聯合p38 MAPK阻斷劑SB203580增強二甲雙胍的抗卵巢癌細胞增殖情況
2.4 二甲雙胍激活AMPK信號通路,并抑制MAPK信號通路 二甲雙胍(10、20 mM)作用卵巢癌細胞SKOV3 6 h后,磷酸化AMPK水平顯著增高,且升高的磷酸化AMPK水平能夠被AMPK阻斷劑Compound C所削弱。經二甲雙胍(1、10 mM)處理后,卵巢癌細胞SKOV3中磷酸化p38 MAPK蛋白水平顯著降低,見圖4。
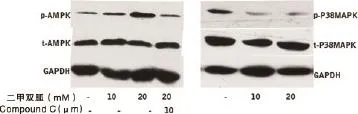
圖4 卵巢癌細胞SKOV3中磷酸化p38MAPK蛋白水平(經二甲雙胍處理后)
3 討論
最近兩項大型流行病學資料顯示:(1)長期服用二甲雙胍可降低卵巢癌的發病風險;(2)在合并糖尿病的卵巢癌患者中,服用二甲雙胍的患者較未服用患者的無病進展存活率顯著增加[10-11]。筆者研究結果發現,二甲雙胍能夠抑制卵巢癌細胞增殖,這種作用是通過激活AMPK信號通路實現的。AMP激活蛋白激酶(AMPK)是主要的細胞能量調節器,是代謝和腫瘤互相作用的主要調節子[11]。二甲雙胍以一種非胰島素介導的方式直接調節細胞增殖和凋亡,二甲雙胍通過激活AMPK,激活的AMPK調節多個信號通路,其中包括mTOR和MAPK信號通路,最終調節細胞增殖和凋亡。
化療藥物引起的細胞損傷主要是通過、絲裂原活化蛋白激酶(MAPK)信號通路實現的,并且化療藥物耐受的形成也與MAPK信號通路激活密切相關[6]。MAPK家族包括P38MAPK、細胞外信號調節蛋白激酶(ERK)、c-jun氨基末端激酶(JNK)等多個亞家族。這些亞族組成多條信號通路,其中最主要的有P38途徑、ERK1/2途徑。MAPK信號通路在多種惡性腫瘤(包括卵巢癌)細胞的增殖、凋亡和化療耐藥產生過程中發揮重要作用[6]。MAPK家族成員被磷酸化激活后,將細胞外的各種刺激信號傳遞到細胞內,引起細胞內級聯反應。有研究發現激活的MAPK,依次磷酸化BAD和BCL-2,進而削弱鉑類和紫杉烷的促進細胞凋亡作用,使腫瘤細胞對化療藥物產生抵抗[12]。筆者的研究結果表明:二甲雙胍可能通過激活AMPK信號通路,進而抑制MAPK信號通路來抑制卵巢癌細胞增殖的。這與以上研究結果相一致。
筆者的研究結果還發現:二甲雙胍(0.1 mM)能夠增強順鉑抑制卵巢癌細胞增殖作用。與最近的幾項研究結果一致:二甲雙胍能改善乳腺癌化療耐藥,并且發現二甲雙胍的這種對化療耐藥的調節作用是通過激活AMPK實現的[13]。Tseng 等[16]在非小細胞肺癌細胞中發現二甲雙胍不僅能夠降低紫杉醇誘導p38 MAPK介導的切除修補基因(ERCC1)的表達,還能夠增加紫杉醇誘導的細胞毒效應。另外在肺癌、乳腺癌和前列腺癌裸鼠體內模型中,二甲雙胍能夠顯著增強順鉑、紫杉醇和多柔比星對腫瘤細胞生長的抑制作用,并且二甲雙胍能夠減少多柔比星的用量,延長疾病緩解期[14-15]。但這些結果說明二甲雙胍可能通過激活AMPK調節腫瘤細胞對化療藥物的敏感性。
筆者同時發現,二甲雙胍聯合MAPK信號通路抑制劑能夠增強二甲雙胍的抗腫瘤作用。p38 MAPK、p42 MAPK信號通路抑制劑可增加二甲雙胍和紫杉醇的抗腫瘤作用[16]。Liu 等[17]在乳腺癌中發現二甲雙胍和mTOR抑制劑(RAD001)聯合可增強化療藥物的細胞毒作用,聯合應用二甲雙胍、化療藥物和mTOR阻斷劑能夠協同抑制乳腺癌細胞增殖。Monteagudo等[18]在前列腺癌細胞中,p42 MAPK siRNA能夠顯著增強二甲雙胍的抗腫瘤作用。因此,鉑、紫杉醇化療的基礎上聯合二甲雙胍和信號通路阻斷劑可能會增強卵巢癌化療的療效,這些研究結果都與筆者的研究結果一致。
總之,二甲雙胍能夠提高卵巢癌細胞系SKOV3細胞對順鉑的敏感性,并且這種作用是依賴于AMPK激活的;p38 MAPK阻斷劑SB203580也能夠抑制SKOV3的增殖,二甲雙胍能夠增強這種抑制作用。二甲雙胍的這種增強卵巢癌細胞對順鉑敏感性的作用可能是通過激活AMPK,從而抑制MAPK信號通路實現的。筆者的研究結果為臨床應用二甲雙胍及MAPK信號通道阻斷劑來提高卵巢癌化療藥物的敏感性提供理論支持,為卵巢癌的臨床聯合用藥提供新思路。
[1] Roshan A,Stan B.Ovarian cancer: stategies for overcoming resistance to chemotherapy[J].Nature Reviews Cancer Volume,2003,3(1),502-516.
[2]周鳳珍,周霞平.卡鉑聯合多西他賽及吉西他濱治療復發性卵巢癌的臨床分析[J].中國醫學創新,2011,8(36):26-28.
[3]劉曉文,胡明英.AKT基因被RNA干擾抑制后對卵巢癌SKOV3細胞增殖及凋亡的影響[J].中國醫學創新,2011,8(36):1-2.
[4]范炳娟,張穎.對卵巢癌腹腔鏡術后轉移擴散的研究[J].中國醫學創新,2013,10(12):150-152.
[5]劉瑩,張穎.卵巢癌臨床治療回顧及展望[J].中國醫學創新,2013,10(12):153-154.
[6] Rajesh K,Lawrence D M.Multidrug resistance (MDR) in cancer:Mechanisms, reversal using modulators of MDR and the role of MDR modulators in influencing the pharmacokinetics of anticancer drugs[J]. European Journal of Pharmaceutical Sciences,2000,11(4):265-283.
[7] Fecher L A,Amaravadi R K,Flaherty.The MAPK pathway in melanoma[J].Curr Opin Oncol,2008,20(2),183-189.
[8] Ohta T,Ohmichi M,Hayasaka T,et al.Inhibition of phosphatidylinositol 3-kinase increases efficacy of cisplatin in vivo ovarian cancer models[J].Endocrinology,2006,147(14):1761-1769.
[9] Rattan R,Gin S,Hartmann L C,et al.Metformin attenuates ovarian cancer cell growth in an AMP-kinase dispensable manner[J].Journal of Cellular and Molecular Medicine,2011,15(1):166-178.
[10] Iris L,Romero A,Cormick M,et al.Relationship of type Ⅱdiabetes and metformin use to ovarian cancer progression, survival,and chemosensitivity[J].Obstet Gynecol,2012,119(1):61–67.
[11] Michael B,Claudia B,Christian M,et al.Use of metformin and the risk of ovarian cancer: a case-control analysis[J].Gynecologic Oncology,2011,123(12):200-204.
[12] Deyin X,Sandra O.Modeling resistance to pathway-targeted therapy in ovarian cancer[J].Cell Cycle,2005,4(8):1004-1006.
[13] Hyung G K,Tran T H, Eun H H,et al.Metformin inhibits P-glycoprotein expression via the NF-κB pathway and CRE ranscriptional activitu through AMPK activation[J].British Journal of Pharmacology,2011,162(15):1096-1108.
[14] Iliopoulos D,Hirsch H A,Struhl K.Metformin decreases the dose of chemotherapy for prolonging tumor remission in mouse xenografts involving multiple cancer cell types[J].Cancer Res,2010,7(2):3196-3201.
[15] Rocha G Z,Dias M M,Ropell E R,et al.Metformin amplifies chemotherapy-induced AMPK activation and antitumoral growth[J]. Clin Canc Res,2011,17(4):3993-4005.
[16] Tseng S C,Huang Y C,Chen H J,et al.Metformin-mediated downregulation of p38mitogen-activated protein kinase-dependent excision repair cross-complementing 1 decreases DNa repair capacity and sensitizes human lung cancer cells to paclitaxel[J].Biochem Pharmacol,2013,85(4):583-594.
[17] Liu H,Scholz C,Zang C,et al.Metformin and the mTOR inhibitor everolimus (RAD001) sensitize breast cancer cells to the cytotoxic effect of chemotherapeutic drugs in vitro[J].Anticancer Res,2012,32(5):1627-1637.
[18] Monteagudo S,Pérez-Martínez F C,Pérez-Carrión M D,et al.Inhibition of p42 MAPK using a nonviral vector-delivered siRNA potentiates the anti-tumor effect of metformin in prostate cancer cells[J].Nanomedicine(Lond),2012,7(4):493-506.
Metformin Enhances Cisplatin Sensitivity through Activating MAPK Signaling Pathway in Ovarian Cancer/
XIE Ya,ZHANG Ying,SHI Ming-xing.//Medical Innovation of China,2014,11(12):007-010
Objective:To investigate metformin whether improve the sensitivity of cisplatin in ovarian cancer and explore the underlying mechanisms.Method:Ovarian cancer cell line SKOV3 was used. The expression of phosphorylatedp38MAPK and AMPK were confirmed in ovarian cancer cells by Western blotting. BRDU ELISA KIT was used to analyze the effects of metformin , SB203580 (p38MAPK inhibitor) and cisplatin alone or together in ovarian cancer cells.Result:(1)Metformin could not only inhibit the proliferation of ovarian cancer cell line SKOV3 cells, but also improve the sensitivity to cisplatin, which is dependent on the activation of AMPK. (2) SB203580, the p38 MAPK inhibitor, could also inhibit the proliferation of SKOV3, which could be enhanced by metformin.Conclusion:Metformin may enhance cisplatin sensitivity through activating MAPK signaling pathway in ovarian cancer cells.
Metformin; Ovarian cancer; AMPK; MAPK; Cisplatin; Cell proliferation
10.3969/j.issn.1674-4985.2014.12.003
2014-02-05) (本文編輯:蔡元元)
國家自然科學基金(81202070)
①鄭州大學第一附屬醫院 河南 鄭州 450052
謝婭
First-author’s address:The First Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China

