AQP1在慢傳輸型便秘發病過程中的作用機制探討
趙兵,孔鵬飛,吳至久,唐學貴
(川北醫學院附屬醫院肛腸科,四川 南充 637000)
慢傳輸型便秘(slow transit constipation,STC)是指結腸的傳輸功能障礙,腸內容物傳輸緩慢而引起的便秘。其主要臨床癥狀為大便干結,便次減少,便意減弱甚至消失,排便不暢,屬于常見的功能性便秘。隨著生活水平的提高,便秘的發病在近年來有逐漸增高的趨勢。研究指出便秘在兒童發病率高,大約占90%-95%,大多屬于功能性便秘[1]。便秘在老年人群的發病也日益引起人們的重視,有研究認為便秘與結直腸癌發病雖無直接關聯,但便秘患者藥物治療后能降低患結直腸癌的風險[2]。慢傳輸型便秘病因復雜,其具體的發病機制尚不十分明確。水通道蛋白的發現,為研究便秘提供了新的方向。已有研究表明AQP3、AQP4參與結腸水轉運過程,和便秘發生具有一定相關性[3-4]。而AQP1作為最早發現的水通道蛋白,是否也參與便秘的發病?因此,為進一步探討便秘的發病機理,我們選擇AQP1作為研究對象,設計動物實驗,建立大鼠便秘模型,研究AQP1在慢傳輸型便秘發病過程中的作用機制。
1 材料和方法
1.1 材料
1.1.1 實驗動物 SD大鼠48只,雌雄各半,體重(200±20)g,清潔級,由川北醫學院動物實驗中心提供。
1.1.2 實驗藥物及試劑 復方地芬諾酯(國藥準字:H41023169),河南鼎昌藥業有限公司提供。莫沙必利(國藥準字:H20031110),成都康弘藥業集團股份有限公司提供。麻仁丸(國藥準字:Z50020517),重慶桐君閣藥廠有限公司提供。大鼠AQP1一抗免疫組化試劑,北京博奧森生物技術有限公司提供。兔SP檢測試劑盒,北京康為世紀生物科技有限公司提供。
1.1.3 主要儀器 微波爐,切片機,-80 ℃、-20 ℃、-4 ℃低溫冰箱,電子天平,Olypmus 光學顯微鏡,微量移液器,電熱恒溫水浴鍋。
1.2 實驗方法
1.2.1 動物分組 48只SD大鼠,隨機分為4組:空白組、便秘模型組、莫沙比利治療組、麻仁丸治療組。
1.2.2 動物造模 根據萬錦州等[5]復方地芬諾酯造模方法稍作改進,空白組大鼠每日給予生理鹽水0.2 mL/10 g,便秘模型組和治療組大鼠每日給予復方地芬諾酯10 mg/kg加入生理鹽水配制成混懸液灌胃,正常進水進食,連續7 d作為1個療程,連用3療程,療程間停藥1 d。第三療程末次給藥后記錄各組大鼠24 h內大便粒數和大便濕重,所得結果用SPSS19.0統計分析,確定慢傳輸型便秘模型的建立。
1.2.3 藥物治療方法 空白組,不造模,不治療;模型組,只造模,不治療。便秘模型建立成功后:莫沙必利組,按2.5 mg/ kg用藥量,加入生理鹽水配制成混懸液4 mL,通過灌胃給藥,連續3 d作為1個療程,共給藥2個療程,療程間停藥1 d,整個過程正常喂食進水。麻仁丸組,按3.0 g/kg 用藥量,加入生理鹽水配制成混懸液4 mL,通過灌胃給藥,連續3 d作為1個療程,共給藥2個療程,療程間停藥1 d,整個過程正常喂食進水。
1.2.4 標本采集 動物模型建好后,用頸椎脫臼法集體處死所有大鼠,剖腹取近端結腸6~8 mm,在生理鹽水中清洗干凈,放入4%多聚甲醛中固定,室溫保存。
1.2.5 免疫組化檢測 取組織塊,經固定后,常規石蠟包埋,4 μm切片;將組織切片放在60 ℃恒溫電烤箱中1 h后取出;切片經脫蠟水化,抗原修復:滴加3%H2O2,在37 ℃下孵育10 min,阻斷內源性過氧化物酶的活性;滴加山羊血清封閉液,在37 ℃下孵育15 min;滴加一抗(1∶100),4 ℃冰箱內孵育過夜;滴加二抗(生物素標記的山羊抗兔IgG),37 ℃孵育30 min;滴加辣根過氧化物酶標記的鏈霉卵白素工作液(S-A/HRP),37 ℃孵育15 min;DAB顯色,在顯微鏡下掌握染色程度,自來水充分沖洗。蘇木素復染,鹽酸乙醇分化;常規脫水、透明、封片及鏡檢。
所有切片都設陰性對照(不滴加一抗,PBS代替一抗),染色陽性結果為:AQP1陽性產物呈棕褐色或棕紅色。每張切片均隨機選取5個具有代表性的高倍鏡視野(×400),用高分辨率圖像分析儀Image-Proplus6.0提供的工具來測定各視野的平均光密度(density mean,MD)值,MD值越大說明陽性細胞越多。
1.3 統計學分析
2 結果
2.1 各組大鼠近端結腸AQP1免疫組化結果
空白組主要表達于結腸粘膜上皮吸收細胞,細胞頂端、基底側和腔面都有表達,杯狀細胞有少量表達,呈棕褐色,粘膜下層和肌層有少量陽性表達。便秘模型組和空白組相比,陽性細胞染色更明顯,呈棕褐色,胞核無陽性表達。莫沙必利治療組、麻仁丸治療組陽性表達染色較便秘組低,較空白對照組高。見圖1。

2.2 各組大鼠近端結腸AQP1表達平均光密度值(MD)
空白組分別和便秘組、莫沙必利組、麻仁丸相比,其MD值低于其他各組(P<0.05),差異有統計學意義;便秘模型組分別和莫沙必利組、麻仁丸組相比,其MD值高于其他兩組(P<0.05),差異有統計學意義;莫沙必利組和麻仁丸組的MD值比較(P>0.05),差異無統計學意義。見表1。
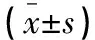
表1 各組大鼠結腸免疫組化AQP1表達平均光密度值(MD)比較
*P<0.05,與空白組比較;#P<0.05,與便秘模型組比較。
3 討論
水通道蛋白(AQPs)是一類存在于細胞膜上的水通透性蛋白,廣泛存在于哺乳動物的各種組織細胞中,在水的吸收、腺體的分泌和細胞內外水的平衡等方面發揮著重要的生理作用。AQP1作為最早發現的水通道蛋白,參與多個組織器官的病理生理過程,Cao 等[6]實驗得出AQP1在輪狀病毒感染腹瀉型小鼠回結腸表達明顯降低,在腹瀉發病過程中起重要作用。有研究表明AQP1參與脊髓損傷的發病過程[7]。Zhang等[8]研究發現AQP1參與肺水腫的形成。Vesterdorf等[9]研究發現AQP1在鼻粘膜上表達并參與呼吸過程的水分調節。近年來,隨著對水通道蛋白研究的不斷深入,AQP1在便秘發病中的作用機制研究也逐漸增多,可能參與了便秘的發病過程。
Denker等[10]在1988年研究紅細胞膜分離純化Rh多肽的過程中發現了一種28KD疏水性跨膜蛋白,并稱之為形成通道的整合膜蛋白28(CHIP28),后來被證實為AQP1。AQP1在消化系統有廣泛的表達,其在人肝臟膽管上皮細胞、毛細膽管內皮細胞、胰腺外分泌小管細胞、唾液腺、結直腸都有大量表達,在消化系統的水轉運過程中起著重要作用。AQP1能夠讓水分子自由通過,但對其他離子和小分子不具有通透性。Zhen等[11]通過建立大鼠慢傳輸型便秘模型,用RT-PCR的方法檢測便秘組、空白組大鼠升結腸和降結腸的AQP1和AQP7的mRNA變化。試驗結果表明,AQP1mRNA在便秘組大鼠升結腸的表達低于空白組(P<0.05),在降結腸兩者表達無統計學意義(P<0.05),而AQP7mRNA表達在便秘組和空白組的升降結腸均無明顯差異(P>0.05)。實驗結果表明慢傳輸便秘的發病和AQP1在結腸表達的下調相關,和AQP7的表達無關。Chen等[12]研究中藥止瀉液對輪狀病毒腸炎乳鼠腸道AQP1,3,4,8 mRNA表達的影響時發現,中藥止瀉液能夠明顯提高乳鼠結腸組織AQP1mRNA 的表達,從而增加結腸對水分的吸收,達到止瀉的作用。該實驗說明AQP1參與結腸對水分的吸收。Ishihara等[13]通過實驗認為AQP1存在于腸神經系統,AQP1陽性腸神經元表達水平的改變可能導致了鏈霉素誘導的糖尿病大鼠胃腸功能紊亂。
本實驗研究發現,AQP1主要表達于大鼠近端結腸粘膜吸收細胞,杯狀細胞少量表達,便秘組大鼠和空白組大鼠相比,結腸粘膜AQP1的表達明顯增高,而通過莫沙必利、麻仁丸治療后,兩治療組大鼠結腸粘膜AQP1表達較便秘組明顯下降,但較空白組大鼠結腸粘膜AQP1表達仍有升高。實驗表明,AQP1在大鼠近端結腸粘膜的表達增強,結腸對水分吸收的增加,導致糞便變干,排出困難,從而形成便秘。通過藥物治療后,大鼠結腸粘膜AQP1表達明顯降低,但較空白組大鼠結腸AQP1表達仍有升高。由此推斷,兩種藥物的通便作用可能和其抑制大鼠結腸粘膜AQP1的表達,減少結腸對腸道水分的吸收,使糞便含水量增加相關。因此,通過對通便藥物治療前后便秘大鼠結腸AQP1表達的變化,我們推斷AQP1在便秘大鼠近端結腸的表達增高導致結腸對水分的過度吸收,從而可能導致便秘的發病。
【參考文獻】
[1] Chen SL,Cai SR,Deng L,et al.Efficacy and complications of polyethylene glycols for treatment of constipation in children:a meta-analysis[J].Medicine(Baltimore),2014,93(16):65.
[2] Anderson JC,Lacy BE.Editorial:constipation and colorectal cancer risk:a continuing conundrum[J].Am J Gastroenterol,2014,109(10):1650-1652.
[3] 楊會鋒,袁惟堂.水通道蛋白3和水通道蛋白9在結腸粘膜的表達意義[J].醫藥論壇雜志,2007,28(6):12-14.
[4] 唐學貴,劉芳,伍靜.便塞通合劑調節慢性便秘大鼠模型遠端結腸AQP4表達的實驗研究[J].中華中醫藥學刊,2010,28(10):2072-2074.
[5] 萬錦洲,馬錦星,劉卉.一種簡易的小鼠便秘模型[J].中國藥理學通報,1994,10(1):71-72.
[6] Cao M,Yang M,Ou Z,et al.Involvement of aquaporins in a mouse model of rotavirus diarrhea[J].Virol Sin,2014,29(4):211-217.
[7] Kaya Y,Ozsoy U,Demir N,et al.Temporal and spatial distribution of the aquaporin 1 in spinal cord and dorsal root ganglia after traumatic injuries of the sciatic nerve[J].Childs Nerv Syst,2014,30(10):1679-1686.
[8] Zhang QY,Fu JH,Xue XD.Expression and function of aquaporin-1 in hyperoxia-exposed alveolar epithelial type II cells[J].Exp Ther Med,2014,8(2):493-498.
[9] Vesterdorf K,Blache D,Maloney SK.Immunolocalization of aquaporins 1,3,and 5 in the nasal respiratory mucosa of a panting species,the sheep(Ovis aries)[J].J Therm Biol,2014,43:61-69.
[10] Denker BM,Smith BL,Agre P,et al.Identification,purification and partial characterization of a novel Mr 28,000 integral membrane protein from erythrocytes and renal tubules[J]. J Biol Chem,1988,263(30):15634-15642.
[11] Zhen L,Wei TY,Hui Z.mRNA expression of aquaporin protein 1 and 7 in rat model of slow transit constipation(STC)[J].African Journal of Pharmacy and Pharmacology,2012,6(36):2643-2645.
[12] Chen H,Gong ST,Qu WJ.Expression of aquaporins in rotavirus enteritis treatment by drug[J].Progress in Modern Biomedicine,2009,9(17):3258-3261.
[13] Ishihara E,Nagahama M, Naruse S,et al.Neuropathological alteration of aquaporin 1 immunoreactive enteric neurons in the streptozotocin-induced diabetic rats[J].Autonomic Neuroscience:Basic and Clinical,2008,138(1):31-40.

