BMECs經TCM和ACM條件培養Caveolin-1的表達對比及其機制的探討
裴 亮 雷 鳴 姚長義 王義寶
(1.遼寧省沈陽市第一人民醫院神經外科,110041;2.中國醫科大學附屬第一醫院神經外科)
·基礎研究·
BMECs經TCM和ACM條件培養Caveolin-1的表達對比及其機制的探討
裴 亮1雷 鳴1姚長義2王義寶2
(1.遼寧省沈陽市第一人民醫院神經外科,110041;2.中國醫科大學附屬第一醫院神經外科)
目的 探討Caveolin-1在大鼠C6膠質瘤細胞件培養液(TCM)和星形膠質細胞條件培養液(ACM)條件培養對腦血管內皮細胞(BMECs)表達的關系。方法 對BMECs進行原代培養,以TCM進行培養,以ACM進行培養作為對照,進行免疫熒光染色和Western blot檢測Caveolin-1表達情況。結果 免疫熒光顯示BMECs中Caveolin-1的表達定位于細胞漿,實驗組染色強度高于對照組;Western blot蛋白測定結果顯示實驗組的IDV灰度值為60 831±2 865.197,明顯高于對照組的IDV灰度值18 645±3 607.659,差異有統計學意義(P<0.05)。結論 Caveolin-1在TCM培養BMECs細胞中高表達,驗證了組織微環境改變可以引起周圍血管內皮細胞表型改變這一假設,為膠質瘤靶向治療載體的選擇上提供了一定的理論依據。
Caveolin-1;大鼠C6膠質瘤細胞件培養液;星形膠質細胞條件培養液;腦血管內皮細胞;膠質瘤
腦膠質瘤是神經系統最常見的惡性腫瘤,由于血腫瘤屏障的存在,化療藥物被限制進入腫瘤組織[1]122-129,而選擇性開放血腦腫瘤屏障能夠有效增加化療藥物在腦膠質瘤組織中的濃度,對腦膠質瘤的治療具有十分重要的意義。Caveolin-1是 Caveolae的標志性蛋白,分子質量為21~24 kDa,修飾于Caveolae的內表面,是質膜微囊的結構蛋白和最好的生物標記物。本研究通過制備大鼠C6膠質瘤細胞條件培養液(TCM)和星形細胞培養液條件培養(ACM)的腦微血管內皮細胞(BMECs),再通過免疫熒光和Western blot檢測BMECs的Caveolin-1的表達,從而探究TCM和ACM不同條件培養對BMECs種Caveolin-1表達的影響,以進一步影響血腦屏障的通透性,為進一步開發新型高選擇性靶向性的膠質瘤化療藥物載體提供理論依據。
1 材料和方法
1.1 主要試劑和材料 II型膠原酶(Sigma)、葡聚糖(Serva)、DMEM培養液(Gibco)、胰蛋白酶(Gibco)、胎牛血清(TBD)、TritonX-100(Sigma)、Caveolin-1單克隆抗體(Santa Cruz)、兔抗Caveolin-1多克隆抗體(Santa Cruz)、抗小鼠免疫球蛋白和辣根過氧化酶(北京中山生物技術公司)、FITC-抗兔(北京中山生物技術公司)、Wistar胎大鼠(1周內,中國醫科大學實驗動物中心)。
1.2 方法 對腦微血管內皮細胞進行原代培養。實驗組以TCM培養液進行培養,對照組以TCM培養液進行培養。分別對實驗組和對照組中的培養細胞進行Caveolin-1的免疫熒光染色。熒光顯微鏡觀察,采集圖像。Western blot檢測Caveolin-1表達和分布。結果用Chemi Imager 5500 V2.03軟件掃描,Fluro Chen2.0軟件定量分析顯色條帶的IDV數據。
1.3 統計學方法 采用SPSS13.0,所有數據以均數±標準差表示,兩組間采用獨立樣本t檢驗。
2 結果
2.1 免疫熒光顯示法檢測BMECs中Caveolin-1的表達 實驗組高于對照組。見圖1。
2.2 Western blot檢測Caveolin-1表達和分布 在Western blot蛋白測定的條帶上見實驗組以TCM進行培養的BMECs中Caveolin-1的表達要明顯高于對照組。IDV灰度值測定后統計分析P<0.05,具有統計學意義。見圖2、表1和圖3(封三)。
3 討論
3.1 Caveolae與Caveolin-1 有研究發現增量調節Caveolin-1蛋白能夠提高CRM197介導的血腦屏障的通透性[2],如果轉運到腫瘤組織的化療藥物濃度增加2倍,其殺傷腫瘤的能力將提高10倍[3]。近年來的研究證實,大多數哺乳動物細胞特別是內皮細胞的細胞質膜均存在燒瓶狀的內陷微區結構,即質膜微囊(Caveolae),它們富含鞘脂和膽固醇,此區域與細胞間黏著結合和緊密連接密切相關[4],質膜微囊被認為與細胞的吞飲作用及物質的跨膜轉運等功能密切相關,它參與許多細胞生命活動。Caveolin-1是Caveolae的標志性蛋白,分子質量為21~24 kDa,修飾于Caveolae的內表面,是質膜微囊的結構蛋白和最好的生物標記物。近年來的研究發現,Caveolin-1與腫瘤細胞的侵襲、轉移以及信號傳導相關。本實驗通過免疫熒光觀察和Western blot蛋白測定發現BMECs中的Caveolin-1在TCM液培養后表達明顯高于ACM培養后的表達,如利用Caveolin-1在腦瘤屏障中高表達是否能制造出特異性高,能選擇性開放血腫瘤屏障的靶點為開發臨床新型高選擇性開放血腫瘤屏障藥物提供理論支持。但是需要注意的是某些因素如N-乙酰半胱氨酸的缺乏和綠茶多酚能夠降低Caveolin-1的表達和血腦屏障作用的減弱[5]。本研究發現在TCM培養下的血管內皮細胞Caveolin-1表達上調,而有利于促進血腫瘤屏障的開放。一方面可以通過此途徑進行化療,提高化療藥物的使用效率,另一方面由于血腫瘤屏障的開放,腫瘤的擴散和轉移,浸潤到正常組織中更加容易,亦能夠解釋研究發現與腫瘤的轉移和浸潤有關的原因。故上調或降低Caveolin-1的表達是個雙刃劍,需要更進一步的研究證實。
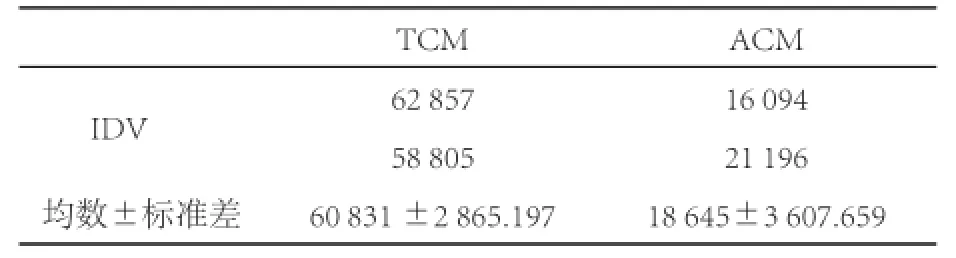
表1 ACM和TCM 培養BMEC中Caveolin-1的Western blot的數據
3.2 TCM、ACM與BMECs 膠質瘤組織中的血腫瘤屏障與正常腦組織的血腦屏障在結構和功能上存在著很大差異,目前膠質瘤腦血管內皮細胞與正常腦血管內皮細胞之間的血腦屏障特性差異的分子機制還不清楚。但膠質瘤腦血管超微結構的研究發現微血管內皮之間緊密連接出現異常[6]。緊密連接由一組分子所構成,包括oc-cludin和連接粘附分子等。國外學者通過比較蛋白質組學的研究發現肺癌周圍的微血管內皮細胞高度表達某些特異性蛋白,而這些蛋白大多參與內陷微區的構成[1]122-129,此研究結果進一步驗證了組織微環境改變可以引起周圍血管內皮細胞表型改變這一假設。前期抑制性消減雜交(suppression subtractive hybridization,SSH)實驗結果顯示膠質瘤微血管段存在著特異性的mRNA表達,提示膠質瘤微環境很可能引起附近腦血管內皮細胞的表型變化,進而影響腦血管內皮細胞表達血腦屏障的特性。本研究通過TCM培養和ACM培養的BMECs,通過免疫熒光標記和Western blot蛋白測定Caveolin-1的表達,進一步證明了BMECs膠質瘤中高表達。
3.3 TCM對BEMCs轉運功能的影響 腫瘤微環境是指腫瘤細胞賴以生存,并對其生命活動產生影響和作用的所有外界環境的總稱。如果腫瘤在沒有足夠的氧氣和營養物質的微環境中,腫瘤只能長到幾立方毫米,為了向外擴展腫瘤必須通過血管生成獲取氧氣和營養。腫瘤細胞在腫瘤發生早期即促進血管生成。因此膠質瘤表現為高度血管化,并且微血管與正常血腦屏障不同,膠質瘤腦血管超微結構的研究發現微血管內皮之間緊密連接出現異常。Zhong Y發現Caveolin-1能夠調節HIV-1介導緊密連接蛋白表達的改變[7]。大量研究結果從不同方面充分證明了形成血腦屏障并非腦血管內皮細胞固有的內在特性,而是由于星形膠質細胞的誘導作用所致[8-9]。鑒于星形膠質細胞存在誘導并維持腦血管內皮細胞形成血腦屏障的作用,膠質瘤微環境對腦血管內皮血腦屏障的影響可能更為復雜[10],我們的體外試驗顯示TCM條件培養可以明顯增加腦微血管內皮細胞上Caveolin-1的表達以及質膜微囊的數量,并且TCM條件培養可以提高小劑量緩激肽作用后BMECs對大分子物質的通透性。結合Fisher等[11]的研究結果我們推測,雖然TCM不能直接增加BMECs上緊密連接的通透性,但是極可能影響BMECs上轉運功能相關區域,特別是質膜微囊的表達,從而在某種程度上提高了血腫瘤屏障的可調控幅度,這為選擇性開放血腫瘤屏障提供了可能的靶點。雖然質膜微囊不直接參與細胞間緊密連接的形成,但是實驗表明上皮細胞系緊密連接相關蛋白的解體、吞飲、再分布以及重新聚合同質膜微囊有著密切的關系。
4 結論
TCM和ACM培養細胞進行免疫熒光觀察和Western blot檢測,Caveolin-1在TCM培養BMECs細胞中高表達。說明在膠質瘤微環境中BMECs中Caveolin-1高表達,從而驗證了組織微環境改變可以引起周圍血管內皮細胞表型改變這一假設,對為進一步開發新型高選擇性靶向性的膠質瘤化療藥物載體提供理論依據。
[1] Zhao LN. Vascular Endothelial Growth Factor Increases Permeability of the Blood-Tumor Barrier via Caveolae-Mediated Transcellular Pathway[J]. J Mol Neurosci, 2010, 44(2).
[2] Wang P, Liu Y, Shang X, Xue Y. CRM197-induced blood-brain barrier permeability increase is mediated by upregulation of Caveolin-1 protein[J]. J Mol Neurosci, 2011, 43(3): 485-492.
[3] Liu LB, Xue YX, Liu YH. Bradykinin increases the permeability of the blood-tumor barrier by the caveolaemediated transcellular pathway[J]. J Neurooncol, 2010, 99(2): 187-194.
[4] Song L, Ge S, Pachter JS. Caveolin-1 regulates expression of junction-associated proteins in brain microvascular endothelial cells[J]. Blood, 2007, 109(4): 1515-1523.
[5] Beauchesne E, Desjardins P, Butterworth RF, Hazell AS. Up-regulation of Caveolin-1 and blood-brain barrier breakdown are attenuated by N-acetylcysteine in thiamine deficiency[J]. Neurochem Int, 2010, 57(7): 830-837.
[6] Davies SC. Blood-brain barrier breakdown in septicencephalopathy and brain tumours[J]. J Anat, 2002, 200(6): 639-646.
[7] Zhong Y, Smart EJ, Weksler B, et al. Caveolin-1 regulates human immunodeficiency virus-1 induced alterations of tight junction protein expression via modulation of the Ras signaling[J]. J Neurosci, 2008, 28(31): 7788-7796.
[8] Fitsanakis VA, Piccola G, Aschner JL, et al. Manganese transport by rat brain endothelial (RBE4) cell-based transwell model in the presence of astrocyte conditioned media[J]. J Neurosci Res, 2005, 81(2): 235-243.
[9] Haseloff RF, Blasig IE, Bauer HC, et al. In search of the astrocytic factor(s) modulating blood-brain barrier functions in brain capillary endothelial cells in vitro[J]. Cell Mol Neurobiol, 2005, 25(1): 25-39.
[10] Neuhaus W, Lauer R, Oelzant S, et al. A novel flow based hollow-fiber blood-brain barrier in vitro model with immortalised cell line PBMEC/C1-2[J]. J Biotechnol, 2006, 125(1): 127-141.
[11] Fischer S, Wobben M, Kleinstuck J, et al. Effect of astroglial cells on hypoxia-induced permeability in PBMEC cells[J]. Am J Physiol Cell Physiol, 2000, 279(4): 935-944.
R65
A
1672-7185(2014)04-0056-03
10.3969/j.issn.1672-7185.2014.04.033
姚長義
2013-11-29)

