RNA干擾技術在藥物轉運體研究中的應用
孔令雷,李 樺
(軍事醫學科學院毒物藥物研究所藥物代謝實驗室抗毒藥和毒理學國家重點實驗室,北京 100850)
RNA干擾技術在藥物轉運體研究中的應用
孔令雷,李 樺
(軍事醫學科學院毒物藥物研究所藥物代謝實驗室抗毒藥和毒理學國家重點實驗室,北京 100850)
RNA干擾是一種利用雙鏈RNA分子特異的沉默靶基因表達的技術,目前已廣泛用于基礎生物醫學研究。作為一種高選擇性和有效的基因調控手段,這一技術也已用于臨床疾病的治療研究和藥物轉運體的研究。藥物轉運體是一類細胞膜蛋白,在藥物的吸收、分布和排泄中發揮重要作用。轉運體功能的抑制或缺失將改變藥物的清除和藥代動力學,導致藥效降低或毒性增加。因此,在新藥研發以及藥物臨床應用中,研究藥物轉運體在藥物跨膜轉運、組織分布、排泄清除和藥-藥相互作用中的作用,對于藥物的有效安全使用,具有重要意義。RNA干擾技術在藥物轉運體介導的藥物轉運和藥-藥相互作用研究方面,具有明顯的優勢。本文對近年來RNA干擾技術在藥物轉運體研究中的應用進行綜述,重點闡述這一技術在藥物轉運體介導的腫瘤耐藥、藥物體內轉運、清除和相互作用研究中的應用,為藥物轉運體的功能和調節研究提供參考。
RNA干擾;藥物轉運體;抗藥性,腫瘤;藥物相互作用;受體,胞質和核
藥物轉運體是一類位于細胞膜、能將藥物攝取或排出細胞的蛋白或多肽,廣泛分布于體內多種器官和組織,如肝、腸、腎和腦等,通過影響藥物的吸收、分布和排泄進而影響藥物的效應或安全性,并導致藥物相互作用[1]。轉運體通過調控藥物在腸上皮細胞、肝細胞或腎小管上皮細胞的進出而影響藥物在小腸的吸收以及在肝和腎的消除。此外,轉運體也能限制或促進藥物在腦、胎盤、腫瘤等生理屏障或細胞的通透。轉運體功能的抑制或缺失將改變藥物在組織中的暴露,導致藥效降低或毒性增加。為此,在新藥物研發以及藥物的臨床應用中,研究藥物轉運體在候選藥物或臨床藥物跨膜轉運、組織分布、排泄清除和藥物相互作用中的作用,對于藥物有效安全使用,具有重要的意義[2]。
RNA干擾(RNA interference,RNAi)技術是21世紀初發現的一種有效的基因調節方法,并在基礎生物醫學研究領域中得到了廣泛應用和快速發展。例如,研究基因功能,用于基因治療以及腫瘤治療等[3]。目前,多數藥物轉運體的基因已經被鑒別和克隆,而 RNAi技術也已用于轉運體的研究中[2,4]。與傳統的基因敲除方法相比,RNAi是可逆的,使得其能通過可逆性抑制作用研究轉運體的體內功能,或者用于促進有利于藥物臨床應用的體內處置;再者,RNAi能特異性地抑制靶基因的表達,避免化學抑制劑因轉運蛋白基因之間具有高度的同源性而導致的非特異性,在藥物體內處置和藥物相互作用研究中,具有良好的應用前景。本文將對近年來RNAi技術在藥物轉運體研究中的應用進行綜述,重點總結這一技術在藥物轉運體介導的腫瘤耐藥、藥物體內轉運、清除和相互作用研究中的應用,為藥物轉運體的功能和調節研究提供參考。
1 藥物轉運體
已知的藥物轉運體分為兩類:ATP-結合盒轉運體(ATP-binding cassette,ABC)和溶質載體(solute carrier,SLC)[5]。ABC類轉運體主要通過ATP供能介導細胞對藥物的外排,與藥物外排轉運相關的轉運體主要有 P-糖蛋白(P-glycoprotein,P-gp),多藥耐藥相關蛋白(multi-drug resistanceassociated protein,MRP)和乳腺癌耐藥蛋白(breast cancer resistance protein,BCRP)等。SLC類轉運體主要介導細胞對藥物的攝取,包括有機陰離子轉運體(organic anion transporter,OAT)、有機陰離子轉運多肽(organic anion transport polypeptides,OATP)、有機陽離子轉運體(organic cation transporter,OCT)等[6]。攝取和外排轉運體通過動態的相互作用共同調節細胞內藥物或內源性物質的蓄積和轉運。
藥物轉運體具有多樣性和復雜性,藥物轉運體家族存在多個亞家族和亞型,如ABCC亞家族包括12種亞型(ABCC1~ABCC12),這些轉運體亞型之間有大量重疊的底物,而有些重疊的底物也是藥物代謝酶的誘導劑或抑制劑。因此,在缺少藥物基因組學信息的情況下,很難確定不同轉運體在藥物轉運分布及藥物相互作用中的作用。
2 RNA干擾技術
RNAi是由雙鏈RNA介導的序列特異的基因沉默現象,它在轉錄水平、轉錄后水平和翻譯水平上阻斷基因的表達,具有高效性和高特異性的特點[7]。RNAi不僅已廣泛用于基因功能研究,作為一種高選擇性和有效性的治療方法也已經用于臨床研究[3]。RNAi通過內源性微小RNA(miRNA)或外源性的小干擾RNA(siRNA)或短發夾RNA (shRNA)發揮作用。化學合成的siRNA應用簡單方便,但由于缺少細胞內的放大機制,只能對靶基因產生暫時的抑制作用,其有效性取決于靶序列,轉染方式和靶蛋白的半衰期。載體或病毒介導的shRNA主要由生物化學和基因的方法合成,通過質粒或病毒載體進入細胞后能夠對靶基因產生長效穩定的抑制作用,其有效性取決于shRNA的優化、載體的選擇以及有效的傳遞方式[8]。miRNA是一種高度保守的小的非編碼RNA,由接近20~25 nt的單鏈RNA分子組成,能夠在轉錄后水平對靶基因進行調節,對細胞生理和病理功能發揮重要作用。目前,siRNA,shRNA和miRNA均已在藥物轉運體研究得到應用。
3 RNA干擾技術逆轉藥物轉運體相關的腫瘤耐藥
耐藥性是導致腫瘤和其他疾病治療失敗的主要原因之一。耐藥性產生的主要機制包括細胞內可溶性藥物吸收的減少、細胞內遺傳和表型的改變以及疏水性藥物通過細胞表面轉運體外排的增加[9]。其中,外排轉運體介導的藥物外排所致的耐藥性發生,是目前研究的熱點。外排轉運體P-gp,MRP和BCRP的表達上調是耐藥性產生的主要機制,已成為腫瘤化學治療的主要障礙[10-11]。通過抑制藥物轉運體的表達和功能,可增加耐藥細胞的藥物暴露,是目前逆轉藥物耐受的主要手段之一。但是,臨床上應用化學抑制劑克服腫瘤耐藥的療效有限,且會引起嚴重的毒性反應[12]。而RNAi技術能特異性地抑制轉運體基因的表達和功能,提高化學治療效果,降低因化學抑制劑帶來的風險,為逆轉腫瘤耐藥提供了新的思路和方法。
近期的研究表明,針對外排轉運體的siRNA實驗研究,展示了該技術能顯著抑制腫瘤細胞的轉運體表達和功能,成功逆轉腫瘤耐藥,提高化學治療的效果。表1匯總了RNAi技術在藥物耐藥性研究中的應用文獻。多柔比星和表柔比星均屬阿霉素類藥物,能夠有效地治療多種惡性腫瘤。研究發現,應用MDR1的siRNA能夠抑制耐多柔比星的MCF-7乳腺癌細胞中MDR1的蛋白表達,恢復多柔比星在細胞內的累積和分布,提高耐藥細胞對多柔比星的化學敏感性[13-14]。在多種人腫瘤細胞系中,MRP1的siRNA能夠明顯抑制MRP1 mRNA和蛋白的表達,提高表柔比星對腫瘤細胞的有效性[15]。Pichler等[16]用生物素發光的方法發現,RNAi技術能夠分別有效抑制MDR1在腫瘤細胞、小鼠腫瘤組織以及肝的表達和功能,說明 RNAi技術在體內逆轉MDR1的可行性。Patutina和Matsui[17-18]兩課題組分別通過特異的mdr1a/1b siRNA,同時抑制mdr1a/1b在小鼠體內的表達,提高了化學治療的敏感性。此外,Honjo等[19]報道應用siRNA能夠有效抑制成纖維樣滑膜細胞和大鼠滑膜中的P-gp表達,提高地塞米松的抗炎作用,改善類風濕性關節炎的治療。RNAi作為一種高效的序列特異性的基因敲除技術,在多基因調控的耐藥治療領域取得了迅速發展,展現了很好的應用前景。
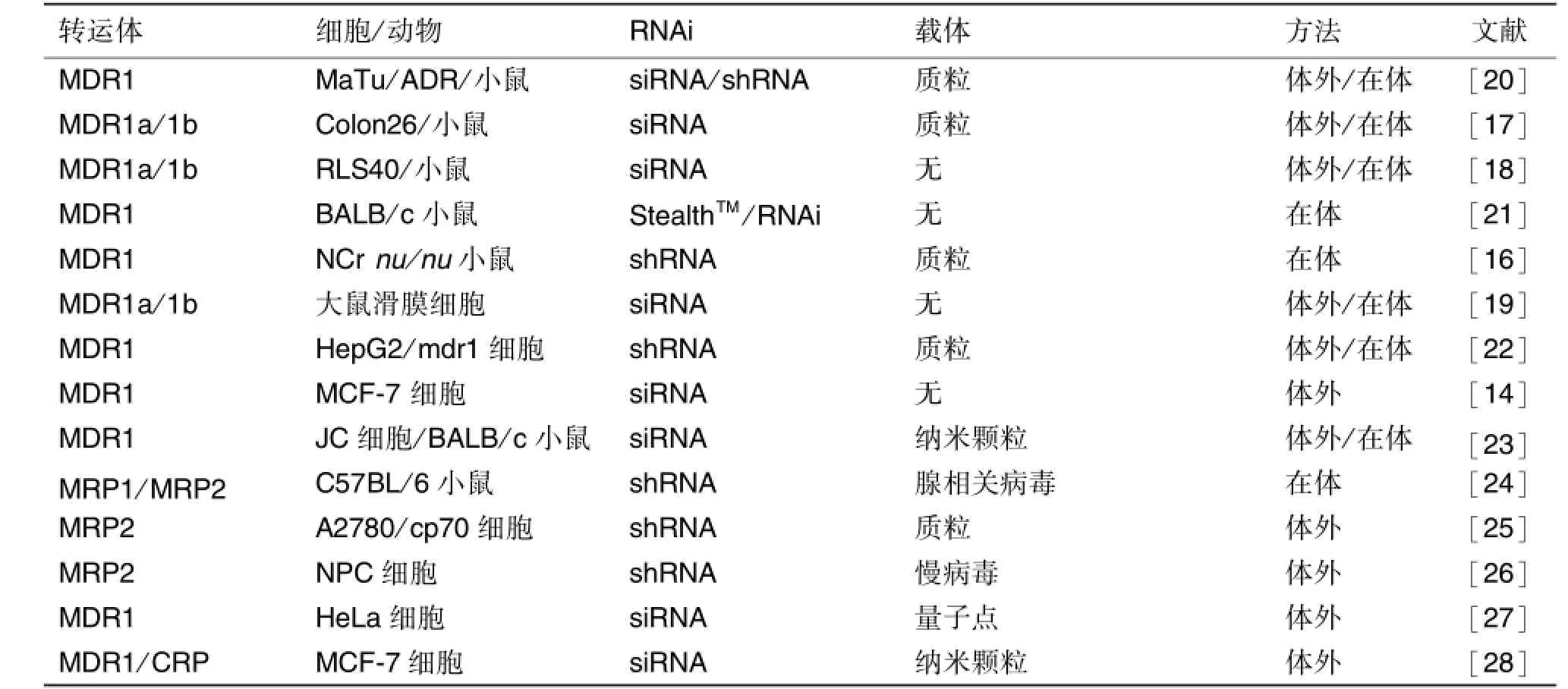
表1 RNA干擾技術在逆轉耐藥性研究中的應用
4 RNA干擾技術在藥物處置研究中的應用
轉運體通過調控藥物在腸上皮細胞、肝細胞和腎小管上皮細胞的攝取和外排,影響藥物在小腸的吸收以及在肝和腎的消除;轉運體也能調控藥物在腦、胎盤、腫瘤和T細胞等的通透性,影響藥物在這些組織器官或細胞的分布,從而改變藥物在體內的處置行為。鑒別藥物是否是轉運體的底物、抑制劑或誘導劑,以及評價不同轉運體在某個藥物處置中的作用,是轉運體介導的藥物處置研究中首先要解決的問題。轉運體底物的鑒別多用化學抑制劑或重組的表達系統來進行。由于化學抑制劑多存在非特異性和底物交叉性,并不能真實反映轉運體在底物轉運中的作用。另外,重組表達系統如轉染Madin-Darby犬腎細胞(MDCK)-MDR1等雖然能夠特異性地鑒別某種轉運體的底物,但由于轉運體數量眾多,且構建重組系統需要較長時間,限制了重組系統的應用[29]。基因敲除動物模型在體內基因功能的研究中發揮了重要的作用。經典的敲除方法主要通過破壞靶基因結構如內源性序列的缺失,外源性序列的插入來完成的。基于RNAi的特異性及其不改變基因組結構的特點,RNAi技術已成為建立功能缺失細胞和動物模型的一種新方法,對于轉運體功能研究和底物鑒別也是一種非常有效的技術,表2匯總的文獻研究表明,該技術已經廣泛用于這一目的。
Caco-2單層細胞表達有多種外排轉運體,主要用于藥物的雙向轉運研究。Darnell等[30]將慢病毒介導的P-gp和MRP2的shRNA導入Caco-2細胞中,研究了P-gp和MRP2在抗凝血藥希美加群(ximelagatran)排泄中的作用。他們發現,是P-gp而不是MRP2參與了希美加群、羥基美拉加群和美拉加群的轉運。Li等[31]采用慢病毒介導的P-gp,MRP2和BCRP的shRNA,在Caco-2細胞上研究了他汀類藥物的外排作用,結果發現阿托伐他汀、氟伐他汀和羅舒伐他汀由P-gp、BCRP和MRP2介導外排轉運,而洛伐他汀和辛伐他汀的轉運則不通過P-gp,BCRP和MRP2的介導。上述研究表明,將RNAi技術與Caco-2細胞模型相結合,為藥物和轉運體相互作用的研究提供了一個有效工具,在RNAi的Caco-2細胞上,可以評價特定轉運體在藥物跨膜轉運中的作用,并預測潛在的藥物相互作用。

表2 RNA干擾技術在轉運體功能和底物鑒別中的應用
原代培養肝細胞表達Ⅰ相和Ⅱ相代謝酶以及多種轉運體,與生理環境接近,已廣泛用于轉運體介導的藥物肝攝取、代謝和膽汁排泄研究,并可準確地預測肝膽藥物分布[32]。Liao等[33]將 OATP1B1,1B3和2B1的siRNA導入三明治培養的人肝細胞中,顯著降低肝OATP的表達,西立伐他汀的肝攝取由此降低了20%~30%,其代謝產物的肝攝取也降低50%。siRNA干擾肝細胞的結果提示,同時服用OATP抑制劑能顯著地改變西立伐他汀的藥代動力學,引起藥物相互作用。
由于人肝細胞的供體較少且價格昂貴,限制了其在藥物轉運體研究中的應用。三明治培養的大鼠肝細胞由于分離培養相對簡單方便,可廣泛用于藥物肝攝取和膽汁外排的研究[34]。Yue等[35]應用腺病毒介導的BCRP shRNA,成功敲除大鼠肝細胞的BCRP,而不影響P-gp,MRP2,BSEP,MRP4和OATP1A1的表達。應用這一BCRP敲除模型評價呋喃妥因的肝處置發現,呋喃妥因的肝細胞內濃度顯著增加,而呋喃妥因的膽管外排指數和體外膽汁清除率分別降至對照組的11%和14%,表明呋喃妥因的膽汁排泄主要由BCRP介導,與BCRP抑制劑或誘導劑同時服用,可能引起藥物相互作用。
現有文獻報道已經證實,siRNA在體外細胞模型上的特異性和有效性,應用siRNA評價體內轉運體對藥物處置的作用及調節成為下一個研究熱點,但目前的文獻報道較少。van de Water等[36]通過靜脈注射放射性標記的siRNA觀察其生物學分布發現,siRNA主要聚集在腎并經尿排泄。注射1 h后,腎中的siRNA含量比其他組織高40倍。除此之外,該研究還通過注射MRP2 siRNA,觀察了腎近曲小管中MRP2的功能。注射MRP2 siRNA 4 d后,尿中的鈣黃綠素排泄率顯著下降。而MRP4 siRNA不能改變鈣黃綠素的排泄。因此,siRNA為研究腎轉運體的功能提供了新的方法。
5 RNA干擾技術在核受體調節藥物轉運體研究中的應用
鑒于藥物轉運體在藥物的吸收、分布和排泄中發揮的重要作用,其表達和功能的調節對于藥物的有效和安全應用具有重要意義。轉運體的表達和功能主要受到核受體調控[43-44],后者通過調節藥物轉運體基因的表達進而對內源性和外源性物質的轉運產生重大影響,導致不可預知的藥物相互作用的發生。核受體家族主要包括孕烷X受體(pregnane X receptor,PXR)、組成型雄烷受體(constitutive androstane receptor,CAR)和芳香烴受體(aryl hydrocarbon receptor,AHR)等,廣泛參與藥物轉運體的調節[45-46]。表3總結了RNAi技術在核受體調控藥物轉運體研究中的部分應用。
PXR和CAR是調節藥物代謝酶和轉運體的主要核受體,在多種癌細胞中的表達增高,如前列腺癌、乳腺癌、腸癌、結腸癌和子宮內膜癌等,對Ⅰ相及Ⅱ相代謝酶和外排轉運體的基因轉錄調節發揮重要作用。因此,PXR和CAR與腫瘤的耐藥性密切相關,RNAi通過抑制核受體的激活使轉運體的表達下調,從而逆轉腫瘤耐藥性[47]。PXR是調節藥物代謝酶和轉運體基因的最重要的核受體,在許多組織和細胞中表達,包括肝細胞、腸細胞、淋巴細胞、內皮細胞和血腦屏障等。PXR的激活能調節多種轉運體,包括P-gp,MRP2,BCRP和OATP等。Rigalli等[48]研究了抗南美錐蟲藥芐硝唑對ABC轉運體和代謝酶的調節作用發現,芐硝唑能增加P-gp和MRP2的蛋白表達,而給予PXR siRNA后則完全逆轉P-gp和MRP2的上調;隨后他們用報告基因法發現,芐硝唑能激活PXR,應用P-gp siRNA證實了P-gp參與了芐硝唑的轉運。這些結果表明,芐硝唑通過激活PXR使P-gp的表達上調,進而增加了其自身的外排。利尿藥螺內酯同樣可以誘導P-gp的表達,給予PXR的siRNA可使PXR的蛋白水平降低74%,并完全逆轉螺內酯對P-gp的誘導作用[49]。這些研究結果提示,PXR的配體藥物通過激活PXR誘導P-gp的表達,使P-gp底物的自身轉運和代謝等藥代動力學行為發生改變,從而影響其有效性和安全性。
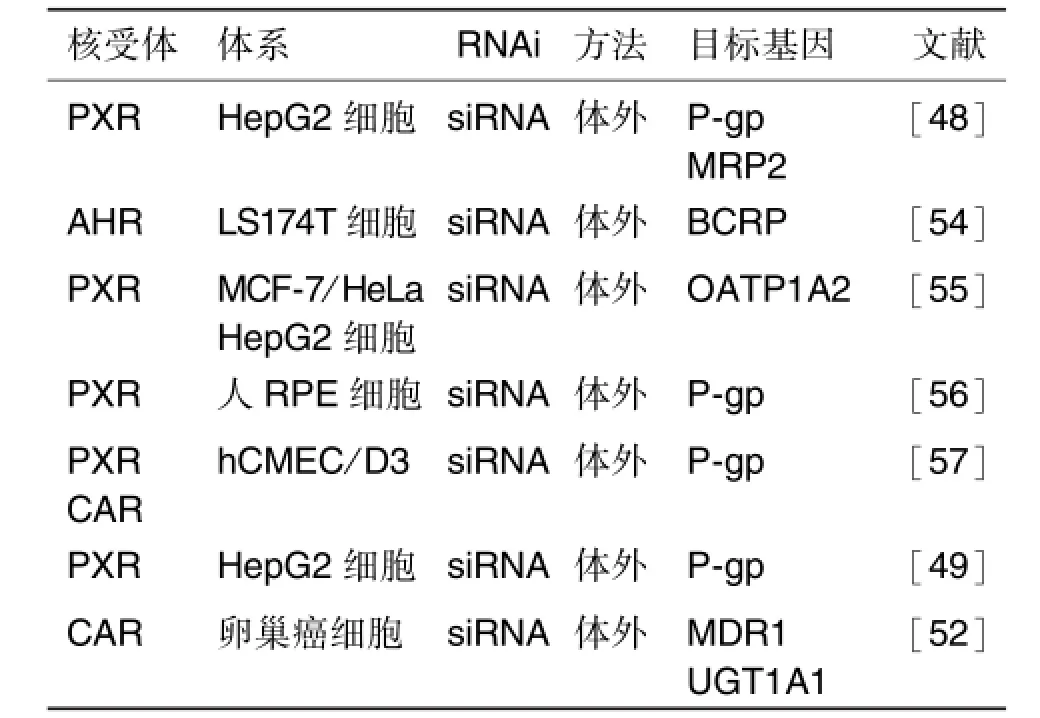
表3 RNA干擾技術在核受體調節藥物轉運體研究中的應用
CAR功能與PXR相似,能識別許多結構不同的化合物,如雄甾烷代謝產物、膽酸等。最近的研究表明,CAR調節的基因與PXR存在很大重疊性,如CYP酶、Ⅱ相酶、膽酸和藥物轉運體等[50-51]。CAR主要分布在肝、腎、小腸、腦和睪丸等組織。CAR激動劑CITCO能夠上調卵巢癌細胞中MDR1和UGT1A1的表達,CAR的siRNA能下調MDR1和UGT1A1的表達,同時促進抗癌藥物引起的細胞生長抑制和凋亡,提高卵巢癌的化學治療[52]。
肝X受體(liver X receptor,LXR)屬于核激素受體超家族,分為LXRα和LXRβ。LXRβ在全身分布廣泛,LXRα則主要分布于肝、腎、小腸和脂肪組織。LXR激動劑TO901317能誘導肝MRP2的表達,但對MDR1和BCRP沒有影響,給予LXRα的siRNA能阻斷 MRP2的表達,表明 LXR參與了MRP2的調控,可能會影響藥物的膽汁排泄[53]。因此,應用RNAi技術不僅有助于了解核受體對靶基因調控的作用,還可以對藥物轉運的潛在作用有更深的理解。
6 展望
目前,已發現的藥物轉運體超過400種,多數轉運體已經被克隆和鑒別。面對如此眾多的轉運體,鑒別其在藥物轉運中的功能并用于疾病的治療,成為研究的熱點。RNAi技術將大大促進對這些轉運體基因功能的研究,與傳統的基敲除技術相比,RNAi技術具有投入少,周期短,操作簡單等優勢。隨著對RNAi機制研究的不斷深入,RNAi技術將成為研究藥物轉運體基因功能不可或缺的工具。此外,隨著藥物轉運體基因功能的闡明,在臨床上應用特異干擾RNA與化學藥物聯合治療可以提高藥物的療效,避免藥物不良反應。
雖然RNAi技術以其特異性和高效性在生物學領域中迅速發展,取得許多令人振奮的研究成果,但仍有下列問題需要解決。① siRNA的有效性。siRNA的有效性受多種因素的影響,包括靶序列,有效的傳遞系統以及靶蛋白的半衰期。目前,siRNA的設計方法已經取得很大進展,但有效siRNA序列的選擇仍然是一個技術難題,siRNA的有效性需要反復進行實驗篩選。哺乳動物細胞內缺少RNAi擴增機制,siRNA分子或表達載體能否進入每一個靶細胞是基因敲除成功的關鍵。但是由于轉染細胞的類型不同以及轉染試劑的毒性使轉染過程的優化比較困難。藥物轉運體通常具有較長的半衰期,轉染后觀察到蛋白敲除和功能改變需要較長的時間。此外,影響siRNA有效性的另一個主要問題是脫靶效應即非靶基因的抑制,導致siRNA非特異性的發生[58]。②siRNA的傳遞系統。siRNA的大小及其所帶的負電荷使其很難穿過細胞膜,因此應用中最重要的步驟是將siRNA有效傳遞進入靶細胞。目前,脂質體、納米材料等已經成功的用于siRNA的傳遞,但是尚未從根本上解決問題[59]。③毒性反應。siRNA或shRNA的導入可能激活體內干擾素反應基因,非特異性地全面抑制內源性mRNA的翻譯,并導致細胞凋亡。另外,雙鏈RNA通過與RNA結合蛋白相互作用也能夠引起自身免疫反應[60]。雖然RNAi技術還存在以上問題,但隨著RNAi機制的逐漸闡明,這些問題將有望得到解決。
總之,RNAi技術被認為是基因治療,轉運體功能研究和藥物研發中的一項革命性方法。目前,RNAi已經成功用于逆轉轉運體介導的腫瘤耐藥性、轉運體功能和底物鑒別研究和藥物基于轉運體的相互作用研究。RNAi技術的特異性和有效性使之成為研究藥物轉運體的有效工具,將有望在藥物代謝、腫瘤治療等方面發揮重要作用。
[1] Kusuhara H,Sugiyama Y.Role of transporters in the tissue-selective distribution and elimination of drugs:transporters in the liver,small intestine,brain and kidney[J].J Control Release,2002,78 (1-3):43-54.
[2] Yu AM.Small interfering RNA in drug metabolism and transport[J].Curr Drug Metab,2007,8(7): 700-708.
[3] Lares MR,Rossi JJ,Ouellet DL.RNAi and small interfering RNAs in human disease therapeutic applications[J].Trends Biotechnol,2010,28(11): 570-579.
[4] Abbasi M, Lavasanifar A, Uludag H.Recent attempts at RNAi-mediated P-glycoprotein downregulation for reversal of multidrug resistance in cancer[J].Med Res Rev,2013,33(1):33-53.
[5] Keogh JP.Membrane transporters in drug development[J].Adv Pharmacol,2012,63:1-42.
[6] Yoshida K, Maeda K, Sugiyama Y.Hepatic and intestinal drug transporters:prediction of pharmacokinetic effects caused by drug-drug interactions and genetic polymorphisms[J].Annu Rev Pharmacol Toxicol,2013,53:581-612.
[7] Lee SH, Sinko PJ.siRNA-getting the message out[J].Eur J Pharm Sci,2006,27(5):401-410.
[8] Aagaard L, Rossi JJ.RNAitherapeutics:principles,prospects and challenges[J].Adv Drug Deliv Rev,2007,59(2-3):75-86.
[9] Kerbel RS.Molecular and physiologic mechanisms of drug resistance in cancer:an overview[J]. Cancer Metastasis Rev,2001,20(1-2):1-2.
[10] Zhang Q, Li F.Combating P-glycoprotein-mediated multidrug resistance using therapeutic nanoparticles[J].Curr Pharm Des,2013,19(37): 6655-6666.
[11] Li H,Yang BB.Friend or foe:the role of microRNA in chemotherapy resistance[J].Acta Pharmacol Sin,2013,34(7):870-879.
[12] Liang XJ,Chen C,Zhao Y,Wang PC.Circumventing tumor resistance to chemotherapy by nanotechnology[J].Methods Mol Biol,2010,596:467-488.
[13] Chen Y,Bathula SR,Li J,Huang L.Multifunctional nanoparticles delivering small interfering RNA and doxorubicin overcome drug resistance in cancer[J]. J Biol Chem,2010,285(29):22639-22650.
[14] D?nmez Y, Gündüz U.Reversalofmultidrug resistance by small interfering RNA(siRNA)in doxorubicin-resistant MCF-7 breast cancer cells [J].Biomed Pharmacother,2011,65(2):85-89.
[15] Wu Z,Li X,Zeng Y,Zhuang X,Shen H,Zhu H,et al.In vitro and in vivo inhibition of MRP gene expression and reversal of multidrug resistance by siRNA[J].Basic Clin Pharmacol Toxicol,2011,108(3):177-184.
[16] Pichler A,Zelcer N,Prior JL,Kuil AJ,Piwnica-Worms D.In vivo RNA interference-mediated ablation of MDR1 P-glycoprotein[J].Clin Cancer Res,2005,11(12):4487-4494.
[17] Matsui Y,Kobayashi N,Nishikawa M,Takakura Y. Sequence-specific suppression of mdr1a/1b expression in mice via RNA interference[J]. Pharm Res,2005,22(12):2091-2098.
[18] Patutina OA,Mironova NL,Popova NA,Kaledin VI,Nikolin VP,Vlassov VV,et al.The siRNA targeted to mdr1b and mdr1a mRNAs in vivo sensitizes murine lymphosarcoma to chemotherapy[J].BMC Cancer,2010,10:204.
[19] Honjo K, Takahashi KA, Mazda O,Kishida T,Shinya M,Tokunaga D,et al.MDR1a/1b gene silencing enhances drug sensitivity in rat fibroblastlike synoviocytes[J].J Gene Med,2010,12(2): 219-227.
[20] Stein U,Walther W,Stege A,Kaszubiak A,Fichtner I,Lage H.Complete in vivo reversal of the multidrug resistance phenotype by jet-injection of anti-MDR1 short hairpin RNA-encoding plasmid DNA [J].Mol Ther,2008,16(1):178-186.
[21] Xiao H,Wu Z,Shen H,Luo AL,Yang YF,Li XB,et al.In vivo reversal of P-glycoprotein-mediated multidrug resistance by efficient delivery of stealth RNAi[J].Basic Clin Pharmacol Toxicol,2008,103(4):342-348.
[22] Abbasi M,Aliabadi HM,Moase EH,Lavasanifar A,Kaur K,Lai R,et a.siRNA-mediated down-regulation of P-glycoprotein in a xenograft tumor model in NOD-SCID mice[J].Pharm Res,2011,28(10): 2516-2529.
[23] Patil YB,Swaminathan SK,Sadhukha T,Ma L,Panyam J.The use of nanoparticle-mediated targeted gene silencing and drug delivery to overcome tumor drug resistance[J].Biomaterials,2010,31(2):358-365.
[24] Borel F,van Logtenstein R,Koornneef A,Maczuga P,Ritsema T,Petry H,et al.In vivo knock-down of multidrug resistance transporters ABCC1 and ABCC2 by AAV-delivered shRNAs and by artificial miRNAs[J].J RNAi Gene Silencing,2011,7: 434-442.
[25] Ma JJ,Chen BL,Xin XY.Inhibition of multi-drug resistance of ovarian carcinoma by small interfering RNA targeting to MRP2 gene[J].Arch Gynecol Obstet,2009,279(2):149-157.
[26] Xie SM,Fang WY,Liu Z,Wang SX,Li X,Liu TF,et al.Lentivirus-mediated RNAi silencing targeting ABCC2 increasing the sensitivity of a human nasopharyngeal carcinoma cell line against cisplatin[J]. J Transl Med,2008,6:55.
[27] Li JM,Wang YY,Zhao MX,Tan CP,Li YQ,Le XY,et al.Multifunctional QD-based co-delivery of siRNA and doxorubicin to HeLa cells for reversal of multidrug resistance and real-time tracking[J]. Biomaterials,2012,33(9):2780-2790.
[28] Li YT,Chua MJ,Kunnath AP,Chowdhury EH. Reversing multidrug resistance in breast cancer cells by silencing ABC transporter genes with nanoparticle-facilitated delivery of target siRNAs[J]. Int J Nanomed,2012,7:2473-2481.
[29] Tian X,Zhang P,Zamek-Gliszczynski MJ,Brouwer KL.Knocking down transport:applications of RNA interference in the study of drug transport proteins [J].Drug Metab Rev,2005,37(4):705-723.
[30] Darnell M,Karlsson JE, Owen A,Hidalgo IJ,Li J,Zhang W,et al.Investigation of the involvement of P-glycoprotein and multidrug resistance-associated protein 2 in the efflux of ximelagatran and its metabolites by using short hairpin RNA knockdown in Caco-2 cells[J].Drug Metab Dispos,2010,38 (3):491-497.
[31] Li J,Volpe DA,Wang Y,Zhang W,Bode C,Owen A,et al.Use of transporter knockdown Caco-2 cells to investigate the in vitro efflux of statin drugs[J]. Drug Metab Dispos,2011,39(7):1196-1202.
[32] Hewitt NJ,Lechón MJ,Houston JB,Hallifax D,Brown HS,Maurel P,et al.Primary hepatocytes: current understanding of the regulation of metabolic enzymes and transporter proteins,and pharmaceutical practice for the use of hepatocytes in metabolism,enzyme induction,transporter,clearance,and hepatotoxicity studies[J].Drug Metab Rev,2007,39(1):159-234.
[33] Liao M, Raczynski AR, Chen M, Chuang BC,Zhu Q,Shipman R,et al.Inhibition of hepatic organicanion-transportingpolypeptidebyRNA interference in sandwich-cultured human hepatocytes:an in vitro model to assess transporter-me-diated drug-drug interactions[J].Drug Metab Dispos,2010,38(9):1612-1622.
[34] Swift B,Pfeifer ND, Brouwer KL.Sandwich-cultured hepatocytes:an in vitro model to evaluate hepatobiliary transporter-based drug interactions and hepatotoxicity[J].Drug Metab Rev,2010,42 (3):446-471.
[35] Yue W, Abe K, Brouwer KL.Knocking down breast cancer resistance protein(Bcrp)by adenoviral vector-mediated RNA interference(RNAi)in sandwich-cultured rat hepatocytes:a novel tool to assess the contribution of Bcrp to drug biliary excretion[J].Mol Pharm,2009,6(1):134-143.
[36] van de Water FM,Boerman OC,Wouterse AC,Peters JG,Russel FG,Masereeuw R.Intravenously administered short interfering RNA accumulates in the kidney and selectively suppresses gene function in renal proximal tubules[J].Drug Metab Dispos,2006,34(8):1393-1397.
[37] Yue W,Lee JK,Abe K,Sugiyama Y,Brouwer KL. Decreased hepatic breast cancer resistance protein expression and function in multidrug resistance-associated protein 2-deficient(TR-)rats[J].Drug Metab Dispos,2011,39(3):441-447.
[38] Tian X,Zamek-Gliszczynski MJ,Zhang P,Brouwer KL.Modulation of multidrug resistance-associated protein 2(Mrp2)and Mrp3 expression and function with small interfering RNA in sandwich-cultured rat hepatocytes[J].Mol Pharmacol,2004,66 (4):1004-1010.
[39] Watanabe T, Onuki R, Yamashita S, Taira K,Sugiyama Y.Construction of a functional transporter analysis system using MDR1 knockdown Caco-2 cells[J].Pharm Res,2005,22(8):1287-1293.
[40] Celius T,Garberg P,Lundgren B.Stable suppression of MDR1 gene expression and function by RNAi in Caco-2 cells[J].Biochem Biophys Res Commun,2004,324(1):365-371.
[41] Yang K,Pfeifer ND,Hardwick RN,Yue W,Stewart PW,Brouwer KL.An experimental approach to evaluate the impact of impaired transport function on hepatobiliary drug disposition using Mrp2-deficient TR-rat sandwich-cultured hepatocytes in combination with Bcrp knockdown[J].Mol Pharm,2014,11(3):766-775.
[42] Aliabadi HM, Landry B,Mahdipoor P,Hsu CY,Uludaˇg H.Effective down-regulation ofbreast cancer resistance protein(BCRP)by siRNA delivery using lipid-substituted aliphatic polymers[J]. Eur J Pharm Biopharm,2012,81(1):33-42.
[43] Pavek P,Smutny T.Nuclear receptors in regulation of biotransformation enzymes and drug transporters in the placental barrier[J].Drug Metab Rev,2014,46(1):19-32.
[44] Pavek P,Smutny T.Nuclear receptors in regulation of biotransformation enzymes and drug transporters in the placental barrier[J].Drug Metab Rev,2014,46(1):19-32.
[45] Chen T.Overcoming drug resistance by regulating nuclear receptors[J].Adv Drug Deliv Rev,2010,62(13):1257-1264.
[46] Chen Y,Tang Y,Guo C,Wang J,Boral D,Nie D. Nuclearreceptors in the multidrug resistance through the regulation of drug-metabolizing enzymes and drug transporters[J].Biochem Pharmacol,2012,83(8):1112-1126.
[47] Yu M,Ocana A,Tannock IF.Reversal of ATP-binding cassette drug transporter activity to modulate chemoresistance:why has it failed to provide clinical benefit?[J].Cancer Metastasis Rev,2013,32(1-2):211-227.
[48] Rigalli JP,Perdomo VG,Luquita MG,Villanueva SS,Arias A,Theile D,et al.Regulation of biotransformation systems and ABC transporters by benznidazole in HepG2 cells:involvement of pregnane X-receptor[J].PLoS Negl Trop Dis,2012,6 (12):e1951.
[49] Rigalli JP,Ruiz ML,Perdomo VG,Villanueva SS,Mottino AD,Catania VA.Pregnane X receptor mediates the induction ofP-glycoprotein by spironolactone in HepG2 cells[J].Toxicology,2011,285(1-2):18-24.
[50] Chan GN,Hoque MT,Bendayan R.Role of nuclear receptors in the regulation of drug transporters in the brain[J].Trends Pharmacol Sci,2013,34 (7):361-372.
[51] Wallace BD, Redinbo MR.Xenobiotic-sensing nuclear receptors involved in drug metabolism:a structural perspective[J].Drug Metab Rev,2013,45(1):79-100.
[52] Wang Y,Masuyama H,Nobumoto E,Zhang G,Hiramatsu Y.The inhibition of constitutive androstane receptor-mediated pathway enhances the effects of anticancer agents in ovarian cancer cells [J].Biochem Pharmacol,2014,90(4):356-366.
[53] Chisaki I,Kobayashi M,Itagaki S,Hirano T,Iseki K. Liver X receptor regulates expression of MRP2 but not that of MDR1 and BCRP in the liver[J].Biochim Biophys Acta,2009,1788(11):2396-2403.
[54] Tompkins LM,Li H,Li L,Lynch C,Xie Y,NakanishiT,et al.A novel xenobiotic responsive element regulated by aryl hydrocarbon receptor is involved in the induction of BCRP/ABCG2 in LS174T cells[J].Biochem Pharmacol,2010,80(11):1754-1761.
[55] Meyer zu Schwabedissen HE,Tirona RG,Yip CS,Ho RH,Kim RB.Interplay between the nuclear receptor pregnane X receptor and the uptake transporter organic anion transporter polypeptide 1A2 selectively enhances estrogen effects in breast cancer [J].Cancer Res,2008,68(22):9338-9347.
[56] Zhang Y,Lu M,Sun X,Li C,Kuang X,Ruan X. Expression and activity of p-glycoprotein elevated by dexamethasone in cultured retinal pigment epithelium involve glucocorticoid receptor and pregnane X receptor[J].Invest Ophthalmol Vis Sci,2012,53(7):3508-3515.
[57] Chan GN,Hoque MT,Cummins CL,Bendayan R. Regulation of P-glycoprotein by orphan nuclear receptors in human brain microvessel endothelial cells[J].J Neurochem,2011,118(2):163-175.
[58] Rao DD, Senzer N, Cleary MA, Nemunaitis J. Comparative assessment of siRNA and shRNA off target effects:what is slowing clinical development [J].Cancer Gene Ther,2009,16(11):807-809.
[59] Kesharwani P,Gajbhiye V,Jain NK.A review of nanocarriers for the delivery of small interfering RNA[J].Biomaterials,2012,33(29):7138-7150.
[60] Deng Y,Wang CC,Choy KW,Du Q,Chen J,Wang Q,et al.Therapeutic potentials of gene silencing by RNA interference:principles,challenges,and new strategies[J].Gene,2014,538 (2):217-227.
RNA interference technique and its appIication to drug transporter research
KONG Ling-lei,LI Hua
(State Key Laboratory of Toxicology and Medical Countermeasures,Laboratory of Drug Metabolism and Pharmacokinetics,Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,China)
RNA interference(RNAi)is a powerful technique that utilizes double-stranded RNA molecules to specifically knock down the expression of the targeted gene.The RNAi technique has a broad application to basic biomedical research.Thanks to its high selectivity and effectivity,this technique is also used clinically as a disease intervention and therapeutic method as well as in the research of drug transporters.Drug transporters are membrane proteins that play important roles in the absorption,distribution and elimination of a wide range of drugs.Inhibition or deletion of transporters may affect clearance and pharmacokinetics of drugs and lead to altered toxicity or therapeutic efficacy.Therefore,in drug development and clinical application,it has become critically important to characterize the roles of transporters in transmembrane transport,tissue distribution,clearance of drugs and drug-drug interactions. However,the diversity and complexity of transporters make it difficult to identify and confirm the role of transporters in drug transportation and drug-drug interactions using chemical inhibitors of transporters. RNAi is an excellent method in delineating their specific roles in drug distribution,elimination and drugdrug interactions.This article reviews recent studies using RNAi to silence gene expression of specific transporters and the application to the research of transporters mediated cancer resistance,drug disposition,clearance and drug-drug interactions.
RNA interference;drug transporter;drug resistance,neoplasm;drug interaction;receptors,cytoplasmic and nucler
LI Hua,Tel:(010)66930664,E-mail:amms_hli@126.com
R965.2
:A
:1000-3002(2014)06-0939-08
10.3867/j.issn.1000-3002.2014.06.018
Foundation item:The project supported by National Natural Science Foundation of China(81302760);The Chinese Postdoctoral Science Foundation Project(2013M542510);National Science and Technology Major Project of China (2008ZXJ09006001);and National Science and Technology Major Project of China(2012ZX09301003-001)
2014-08-18 接受日期:2014-11-18)
(本文編輯:喬 虹)
國家自然科學基金(81302760);中國博士后基金(2013M542510);國家科技重大專項(2008ZXJ09006001);國家科技重大專項(2012ZX09301003-001)
孔令雷(1982-),男,博士后,主要從事神經藥理及藥物代謝研究。
李 樺,Tel:(010)66930664,E-mail: amms_hli@126.com

