灰旱獺-長尾黃鼠鼠疫疫源地監測中應用ELISA檢測F1抗體的可行性分析
熱娜·吐爾地,阿不力米提·買托乎提,布仁明德,阿布力克木·阿不都熱西提,雷 剛,王信惠,廖力夫,徐秉臣
我國的灰旱獺(Marmotabaibacina)-長尾黃鼠(Citellusundulatus)雙宿主鼠疫疫源地,僅分布在北天山北坡,東起沙灣縣的博爾霍拉地區,西到尼勒克縣的恰克蘭尼勒克溝。烏蘇市古爾圖山地牧場(N 44°050~44°20',E83°22'~83°50') 灰旱獺-長尾黃鼠混居,1964年從自斃長尾黃鼠臟器分離出第一株鼠疫菌,1967年發生1例人間腺鼠疫死亡病例,被定為灰旱獺-長尾黃鼠雙宿主鼠疫疫源地[1]。古爾圖山地牧場在各類鼠疫疫源地中,不僅動物血清鼠疫F1抗體陽性率較高,而且分離的鼠疫菌株也較多[1]。2010-2012年鼠疫監測工作中,應用酶聯免疫吸附試驗夾心法(ELISA)與間接血凝試驗(IHA)檢測鼠疫F1抗體,本文報告兩種方法的檢測結果并討論ELISA鼠疫監測中的應用前景。
1 材料與方法
1.1材料
1.1.1標本 鼠疫監測工作中釆集的灰旱獺、長尾黃鼠和牧犬血清,加硫柳汞防腐,4 ℃保存備用。
1.1.2試劑 間接血凝試驗檢測鼠疫菌F1抗體診斷試劑盒:吉林博德醫學免疫制品有限公司,批號:20100101,20110115,20111215;酶聯免疫吸附試驗檢測鼠疫菌F1抗體診斷試劑盒:新疆維吾爾自治區疾病預防控制中心,蘭州生物制品研究所研制,批號:20100315,20110501,20120103。
1.1.3儀器 酶標儀(Multiskan Mk3) 上海熱電儀器有限公司;洗板機(WELLWASH 4MK2) 上海賽默飛世爾儀器有限公司。
1.2方法
1.2.1IHA檢測鼠疫F1抗體(微量法) 微量血凝板管底為90°角V形,試驗在28~37 ℃進行,設陽性、陰性對照。初篩:每份標本6管,每管加稀釋液25μL,首管加標本25 μL,連續2倍稀釋到最末管;每管加1%F1抗原致敏血細胞液25 μL,旋轉振蕩1 min,28~37 ℃靜置90 min,觀察結果,凝集血細胞布滿管底為陽性反應終點。驗證:包括測滴度試驗和抑制試驗,滴度試驗列每管加稀釋液,抑制試驗列加含鼠疫F1抗原稀釋液,首管加復檢標本,連續2倍稀釋到最末管;以下操作步驟同初篩試驗。滴度試驗的陽性反應滴度比抑制試驗高2個或2個以上滴度為驗證試驗陽性,判為鼠疫F1抗體陽性反應,滴度用1∶2n表示,n為陽性反應終點管數[2]。
1.2.2ELISA檢測鼠疫F1抗體 試驗在28~37 ℃進行,設陽性、陰性對照。初篩:鼠疫F1抗原反應板每管加稀釋液50 μL;每管加1份標本50 μL,靜置90 min;流水沖洗5次;加酶標Fl抗原液100 μL,反應45 min,流水沖洗5次加TMB顯色液A液B液,避光反應15 min,加終止液,陰性為無色或顏色很淡。觀測記錄結果:目測:距白色背景15~20 cm,從上方向下觀察,陰性(-)無色或顏色很淡,陽性(+)顏色明顯可見;比色計比色:雙波長450 nm/630 nm,標本OD值>0.2為陽性反應。驗證:初篩陽性反應標本做驗證試驗,滴度試驗列加稀釋液,抑制試驗列加含鼠疫F1抗原的稀釋液,兩列的首管加同份標本,連續2倍稀釋;以下操作步驟同初篩試驗。標本OD >0.20為陽性反應滴度終點,滴度用1∶2n表示,n為陽性反應終點管數。檢測滴度試驗比抑制試驗滴度高2個或2個以上滴度為驗證試驗陽性,判為鼠疫F1抗體陽性[2]。
1.2.3鼠疫細菌學檢驗 包括顯微鏡檢查,分離培養,噬菌體裂解試驗,和動物試驗四個步驟[2]。
1.2.4統計方法 用SPSS 16.0統計軟件,顯著性檢驗,陽性率用χ2檢驗,陽性反應幾何平均滴度用t檢驗。
2 結 果
2.1鼠疫F1抗體陽性率比較 烏蘇市古爾圖地區2010-2012年,灰 旱 獺、長尾黃鼠和牧犬血清,用ELISA和IHA檢測血清鼠疫F1抗體,結果見表1。ELISA和 IHA檢測血清鼠疫F1抗體,長尾黃鼠血清的陽性率分別為11.71%(118/1008) 和1.73% (21/1216),差異非常顯著(χ2=93.67,P<0.001);牧犬血清的陽性率分別為38.89% (28/72) 和10.71% (7/75) ,差異非常顯著(χ2=18.56,P<0.001)。檢測長尾黃鼠和牧犬血清鼠疫F1抗體,ELISA的陽性率高于IHA。
2.2鼠疫F1抗體滴度分布 ELISA和IHA兩種方法檢測2010-2012年間的血清鼠疫F1抗體,陽性反應滴度分布列于表2,以ELISA的陽性標本數計算兩種方法的平均滴度。檢測長尾黃鼠血清鼠疫F1抗體, ELISA和IHA的平均滴度分別為27.805(s 23.427)和21.254(s 22.832),差異非常顯著(t=51.38P<0.001);牧犬血清鼠疫F1抗體平均滴度分別為27.731(s 22.736)和21.50(s 22.611),差異非常顯著(t=14.034P<0.001)。
2.3檢驗鼠疫菌結果 鼠疫細菌學監測數據見表3。從病死灰旱獺中分離的2株鼠疫菌,跳蚤分離的鼠疫菌株較多,受跳蚤保存液中結晶紫質量和保存時間的影響,不同年份的檢出率差異較大;長尾黃鼠鼠疫菌檢出率較高,且檢出率較穩定。長尾黃鼠鼠疫菌檢出率與F1抗體陽性率比較見表4。
3 討 論
ELISA是目前多種疾病監測中最常用的方法,已成為國際主流技術,敏感性和特異性大大高于IHA[3]。在鼠疫監測中,ELISA已經成為采用國家最多的抗體檢測方法,一些新近開展鼠疫監測的國家,在國際組織的支持下也開始使用這種方法[4-5]。我國在5年前,就把ELISA和IHA檢測鼠疫F1抗體列入了鼠疫診斷標準(WS279-2008)[2]。
ELISA檢測鼠疫F1抗體試劑盒,25 ℃以下陰涼處保存60 d效價穩定,沖洗步驟洗去與特異性反應無關的物質,排除溶血和腐敗物質的干擾。酶標抗原催化底物的顯色反應,顯示F1抗體的含量。鼠疫F1抗原致敏紅細胞是IHA檢測鼠疫F1抗體的關鍵試劑,混懸液中醛化紅細胞吸附F1抗原的量和牢度,對溫度、pH值、離子種類和強度的變化十分敏感,野外現場工作中運輸和保存試劑,經常偏離適宜條件,導致F1抗原從醛化紅細胞表面脫落,試劑的效價降低甚至完全失效。抑制試驗只能降低特異性凝集滴度,而不改變非特異性凝集滴度。IHA檢測嚴重溶血、腐敗標本,常出現高滴度非特異性凝集,低滴度特異性凝集被高滴度非特異性凝集掩蓋,這是IHA檢測鼠疫F1抗體滴度分布缺乏低滴度陽性的主要原因。檢測長尾黃鼠和牧犬血清鼠疫F1抗體,ELISA的陽性率是IHA的6.77倍(χ2=73.67,P<0.001)和3.63倍(χ2=18.56,P<0.001),ELISA的幾何平均滴度是IHA的6.22倍(t=51.38,P<0.001)和5.15倍(t=14.034,P<0.001)。ELISA和IHA檢測長尾黃鼠和牧犬血清鼠疫F1抗體的敏感性差異非常顯著。
IHA與ELISA檢測鼠疫F1抗體陽性率顯著性檢驗:長 尾 黃 鼠:χ2=73.67P<0.001 牧 犬:χ2系希臘文=18.56P<0.001.
Note: The significance between IHA and ELISA in detecting plague F1 antibody:Citellusundulates--χ2=73.67,P<0.001; husbandry dog--χ2=18.56,P<0.001.
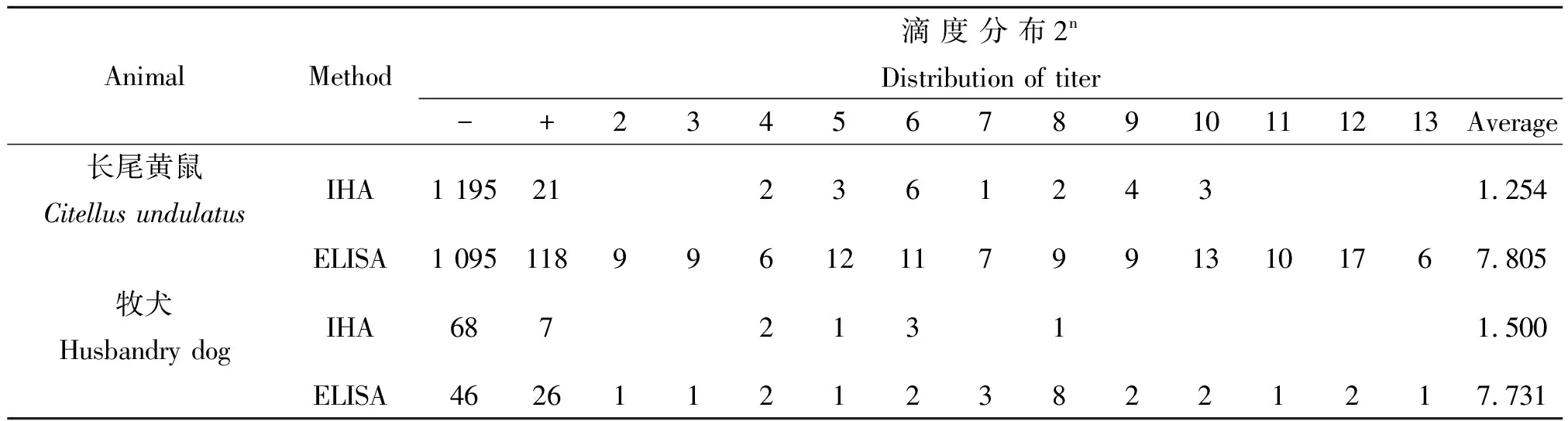
表2 兩種方法檢測長尾黃鼠和牧犬血清鼠疫F1抗體滴度分布
IHA與ELISA檢測鼠疫F1抗體平均滴度顯著性檢驗:長尾黃鼠t=51.38P<0.001 牧犬t=14.034P<0.001.
Note: The significance between IHA and ELISA in detecting the average titer of plague F1 antibody:Citellusundulates--t=51.38,P<0.001, husbandry dog--t=14.034,P<0.001.

表3 烏蘇市古爾圖地區檢驗鼠疫菌結果

表4 ELISA和IHA長尾黃鼠F1抗體陽性率與檢菌陽性率比較
細菌學方法分離鼠疫菌和免疫學方法檢測鼠疫F1抗體,都是鼠疫監測的重要內容,分離鼠疫菌試劑穩定,技術成熟,實驗動物為清潔級小白鼠,表3顯示長尾黃鼠臟器鼠疫菌檢出率高,且檢出率穩定。表4顯示長尾黃鼠F1抗體陽性率與鼠疫菌檢出率的比值,ELISA比值大、波動小(8.016~8.714),IHA比值小、波動大(0.528~1.649),提示ELISA檢測長尾黃鼠F1抗體是灰旱獺-長尾黃鼠鼠疫疫源地監測的敏感穩定的指標。
我國開展鼠疫監測較早,至今仍沿用2005年的全國鼠疫監測方案,該監測方案檢測鼠疫F1抗體只有IHA一種方法。為了能與世界同步,與周邊國家的監測結果相比較,我國也應當在監測中推廣ELISA檢測抗體方法[6]。依照新版鼠疫診斷標準(WS279-2008)修訂鼠疫監測方案,增加ELISA檢測抗體方法,不僅附合方案服從標準的原則,而且可提高鼠疫診斷的準確性,減少根據錯誤檢驗結果實施防控措施的損失。在灰旱獺-長尾黃鼠鼠疫疫源地監測中,應用ELISA和 IHA檢測血清鼠疫F1抗體,為修訂全國鼠疫監測方案提供實驗數據和參考資料。
參考文獻:
[1]Zhang HY. Xinjiang plague[M]. Urumqi: Endemic Bulletin Editorial Board, 1994: 20-28. (in Chinese)
張鴻猷.新疆鼠疫[M].烏魯木齊:地方病通報編輯部,1994: 20-28.
[2]MOH.Health care industry standard of the People's Republic of China WS 279-2008 diagnostic criteria of plague[S](The 2008-09-01 implementation). (in Chinese)
中華人民共和國衛生部.中國人民共和國衛生行業標準WS279-2008鼠疫診斷標準[S](2008-09-01實施).
[3]Hai R. Development and application of plague diagnostic techniques in China[J]. Chin J Endemiol, 2007, 26(5): 473-474. (in Chinese)
海榮.鼠疫診斷技術在我國的發展及應用前景[J].中國地方病學雜志, 2007, 26(5):473-474.
[4]Tikhomirov E, Dennis DT, Gage KL, et al. Plague manual: epidemiology, distribution, surveillance and control[M]. Geneva: WHO, 1999: 11-14
[5]Chu MC. Laboratory manual of plague diagnostic tests[M]. Geneva: WHO, 2000.
[6]Yu DZ. Animal plague epidemiology[M]. Beijing: Science and Technology Press, 2009: 179-181. (in Chinese)
俞東征.鼠疫動物流行病學[M].北京:科教出版社,2009:179-181.

