無償獻血者乙肝表面抗原、丙肝抗體血清學陽性反應的核酸檢測相關性探討
胡宇,蔣燕,何敏靜,陳寶葵(佛山市順德區中心血站,廣東佛山 528300)
目前,我國血液病毒篩查項目中傳染性標志物的主要檢測方法是酶聯免疫檢測。血清學轉換窗口期的漏檢是當前檢測策略下風險產生的主要原因。其次還有病毒變異導致的檢測試劑不識別以及低病毒載量的慢性攜帶狀態所造成的漏檢等。核酸檢測被視為降低血清學窗口期漏檢風險及低病毒載量檢出的最佳解決方法。
隨著核酸檢測技術在中國的發展,為進一步保障臨床輸血安全,提高血液質量,部分血站同時采用NAT技術與酶聯免疫技術對血液病毒進行篩查。為全面合理評估血清學檢測和核酸檢測在降低輸血相關感染風險中的相關性,我們擬通過對本站酶聯免疫檢測HBsAg與抗-HCV陽性反應血清標本進行核酸檢測,探討兩次酶聯免疫檢測方法與NAT技術對HBV、HCV檢測的關聯。現將檢測情況報道如下。
1 材料與方法
1.1 材料
1.1.1 標本 本站2013年1至6月HBsAg、抗-HCV檢測陽性的部分無償獻血者血液標本。
1.1.2 儀器 金立LD5-10B離心機,XANTUS全自動加樣器,FAME24/20全自動酶標儀。混樣平臺:Hamitlton Microlab STAR.IVD。提取平臺:COBAS AmpliPrep Lnstrument。擴增平臺:COBAS TaqMan Analyzer。
1.1.3 耗材與試劑 ELISA試劑盒HBsAg(國產A、進口A),抗-HCV(國產B、進口B);NAT檢測試劑盒Roche MPX V2.0。
1.2 方法
按照酶免檢測試劑說明書采用ELISA方法對22707例無償獻血者血液標本進行常規酶聯免疫血液篩查HBsAg、抗-HCV。收集52例HBsAg血清學篩查陽性的標本和49例抗-HCV血清學篩查陽性的標本進行核酸檢測。
分別將HBsAg陽性、抗-HCV陽性標本分為3組:HBsAg國產、進口酶免檢測同時陽性標本31例,單一進口酶免試劑陽性標本15例,單一國產酶免試劑陽性標本6例。抗-HCV國產、進口酶免檢測同時陽性標本25例,單一進口酶免試劑陽性標本15例,單一國產酶免試劑陽性標本9例。將上述標本進行核酸檢測。
1.3 統計學分析
采用樣本率比較的χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 酶免檢測結果
單一國產和進口試劑 HBsAg ELISA初篩陽性率分別為0.07%(17/22707)和0.06%(14/22707),國產、進口雙試劑HBsAg ELISA陽性率為0.38%(86/22707)。單一國產和進口試劑抗-HCV ELISA初篩陽性率分別為0.07%(15/22707)和0.10%(23/22707),國產、進口雙試劑抗-HCV ELISA雙陽性率為0.18%(40/22707)。結果見表1。
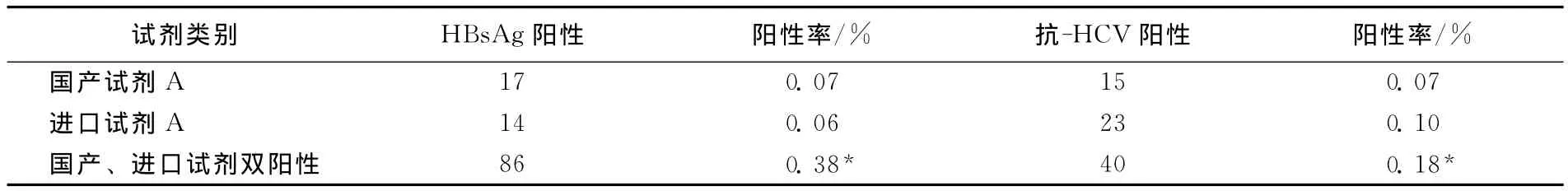
表1 無償獻血者HBsAg、抗-HCV ELISA篩查情況比較(n=22707)
HBsAg國產和進口試劑ELISA檢測陽性率無顯著性差異(χ2=0.269,P>0.05),抗-HCV國產和進口試劑ELISA檢測陽性率無顯著性差異(χ2=1.686,P>0.05)。
2.2 核酸檢測結果
52份HBsAg ELISA陽性樣本HBV核酸檢測結果,49份抗-HCV ELISA陽性樣本HCV核酸檢測結果見表2。
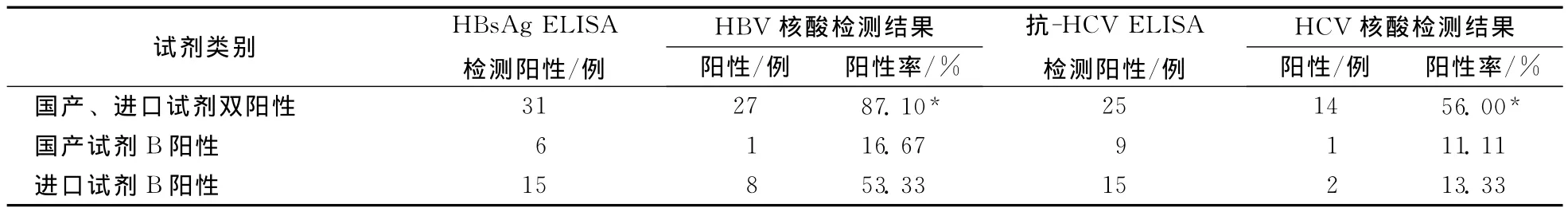
表2 HBsAg、抗-HCV ELISA陽性樣本HBV、HCV核酸檢測結果
HBsAg國產和進口試劑ELISA檢測陽性率無顯著性差異(χ2=0.269,P>0.05),抗-HCV國產和進口試劑ELISA檢測陽性率無顯著性差異(χ2=1.686,P>0.05)。
3 討論
我們分別采用國產和進口酶免試劑,對22707份無償獻血者樣本進行了HBsAg和抗-HCV平行檢測,結果發現進口與國產HBsAg、抗-HCV ELISA試劑陽性率未存在顯著性差異。而酶聯免疫檢測假陽性的原因有:①操作方面,加樣時酶標板污染。②試劑方面,試劑的抗原制備不純會造成假陽性,國產試劑的假陽性高于進口試劑,兩種以上不同試劑同時檢測為陽性時其真陽性可能性大。③樣本方面,樣本溶血以及自身抗體和交叉反應物質對檢測結果也具有干擾作用[1]。因此,應選擇靈敏度強、特異性高的檢測方法,并建立專門的試劑質量評估方案,使用評估合格的試劑和檢測標準,應隨科學技術的發展將成熟的檢測技術盡快應用于血液病毒感染檢測。
本試驗中,HBsAg國產、進口雙試劑陽性反應血清31例中,27例HBV核酸檢測為陽性,檢出率為87.1%,提示國產進口雙試劑陽性時,酶聯免疫方法的檢測結果與核酸檢測結果符合率較高。HBsAg單一國產試劑陽性反應血清6例中,HBV核酸檢測陽性1例,檢出率為16.67%;HBsAg單一進口試劑陽性反應血清8例中,HBV核酸檢測陽性15例,檢出率為53.33%。抗-HCV國產、進口雙試劑陽性反應血清25例中,14例HCV核酸檢測為陽性,檢出率為56%,提示國產進口雙試劑陽性時,酶聯免疫檢測結果與核酸檢測結果符合率較高。抗-HCV單一國產試劑陽性反應血清9例,HCV核酸檢測陽性1例,檢出率為11.11%;抗-HCV單一進口酶免試劑陽性反應血清15例,HCV核酸檢測陽性2例,檢出率為13.33%。
從理論上講,血清中即使只存在1個病毒核酸分子,通過PCR擴增后都能檢測出來,但在實際工作中,血清中病毒核酸含量、PCR試劑的檢測靈敏度、樣本和擴增體系中可能存在某些抑制病毒核酸擴增的因素等都會影響NAT檢測結果。
核酸檢測不能替代常規的血清學檢測,兩者在降低輸血相關病毒感染風險中的作用也并不只是簡單的互補。本試驗中的HBsAg、抗-HCV血清學雙試劑陽性標本因未作進一步確認試驗,不能排除假陽性的存在;同樣,若標本中病毒載量極低,也不能排除核酸檢測假陰性的可能。必要的獻血者追蹤和更進一步的實驗室確證手段及檢測策略應有助于血清學檢測和核酸檢測不一致結果的解釋和分析[2-3]。
NAT檢測對提高血液安全有幫助,雖然從經濟學角度考慮,出現大量標本混檢的形式[4-5],但對于受血者來說,一旦輸入感染病毒的血液,被感染的概率就是100%。因此,大多數國家從人權角度考慮仍然主張在經濟允許的條件下開展NAT血液檢測[6]。血液病毒篩查的血清學方法與核酸檢測方法應是互補的,我國應建立適合我國國情的血液病毒篩查模式,最大限度地降低輸血殘余風險,保證血液安全。
[1]袁曉華,文國新.血液病毒篩查中血清學和核酸檢測方法應用評估 [J].新疆醫科大學學報,2009,32(8):1201-1205.
[2]Hollinger EB,Dodd RY.Hepatitis B virus traceback and lookback:factors to consider[J].Transfusion,2009,49(1):176-184.
[3]Allainl JP,Candotti D.Diagnostic algorithm for HBV safe transfusion [J].Blood Transfusion,2009,7(3):174-182.
[4]歐陽玲,黃建國,謝秀華,等.核酸檢測技術在深圳地區獻血者血液病毒篩查中的應用 [J].國際醫學檢驗雜志,2010,31(7):764-768.
[5]Yugi H,Mizui M,Tanaka J.Hepatitis B virus(HBV)screening strategy to ensure the safety of blood for transfusion through a combination of immunological testing and nucleic acid amplificaltion testing Japanese experience [J].J Clin Virol,2006,36(Suppll):56-64.
[6]Weber B,Muhlbacher A,Melchior W.Detection of an acuteasymptomatic HBsAg negative hepatitis B virus infection in blood donor by HBV DNA testing [J].J Clin Virol,2005,32:67-70.
[編輯] 何勇

