地下水中病原菌及其快速檢測技術研究進展
文 一,郜志云,白 輝,朱崗輝
環境保護部環境規劃院,北京100012
地下水是可利用水資源的重要組成部分,全球三分之一的淡水資源來自于地下水,也是許多國家的主要飲水來源[1]。隨著經濟社會的發展,地下水環境面臨越來越多的威脅,病原微生物成為影響地下水環境的重要污染物[2]。以地下水為媒介傳播疾病的微生物主要包括細菌、病毒和寄生蟲,能引發霍亂、傷寒、傳染性肝炎、鉤端螺旋體等疾病,會造成大規模傳染病的暴發[3]。在發展中國家,約80%的疾病是由水生病原菌引起的,這些疾病造成每天約27 000人死亡[4];在美國,每年估計有590萬人因暴露地下水病原菌而致病,造成9 400 人死亡[5]。
隨著人口增長和土地利用擴展,病原菌污染源增加,增加了地下水污染的可能性,因此開展地下水中病原菌監測是保障飲水安全,保護人群健康的重要前提。目前中國地下水中病原菌的檢測方法主要為傳統微生物培養法[6],該方法存在操作繁瑣、檢測時間長、部分病原菌難以檢測等問題,難以滿足當前地下水環境管理對檢測技術的需求。核酸擴增、生物芯片及生物傳感器等檢測技術是當前重要的水體病原菌檢測手段。發展快速、精確的病原菌檢測技術是世界各國研發的熱點,該文對近年來國際上出現的地下水病原菌檢測技術進行簡要的介紹,以期為地下水中病原菌的有效監測和控制提供技術支持。
1 地下水中的病原菌
地下水中的病原菌微生物一般來自人與動物的排泄物,特別是糞便,其污染源有發生滲/泄漏的垃圾填埋場、畜禽養殖場、污水處理廠和接納生活和畜禽污水的地表水體[7],通過土壤淋濾和地表水-地下水水力交換進入到地下水中。
地下水常見的污染致病菌主要為腸道菌如大腸桿菌(Escherichia Coli)、沙門氏菌(Salmonella)、空腸彎曲桿菌(Campylobacter)及水生細菌如嗜肺軍團菌(Legionella pneumophila)等多種細菌,詳見表 1[8-13]。
大多數通過人或動物的糞便進入水體的水源性病原菌不能在水中生長,但某些病原菌,如軍團菌、非典型分支桿菌、類鼻疽伯克氏菌是環境微生物,可在水體或土壤中生長,增加人群暴露風險。除攝入途徑外,有些病原菌還可通過吸入和皮膚接觸暴露于人群,如軍團菌和非典型分支桿菌可通過吸入途徑引起呼吸道感染,類鼻疽伯克氏菌則可通過接觸傳播引起接觸部位的感染。大部分病原菌可引起腹瀉、嘔吐、發熱、頭痛等輕微癥狀,少部分強致病菌在較低感染濃度下可引起嚴重的系統性疾病甚至死亡。
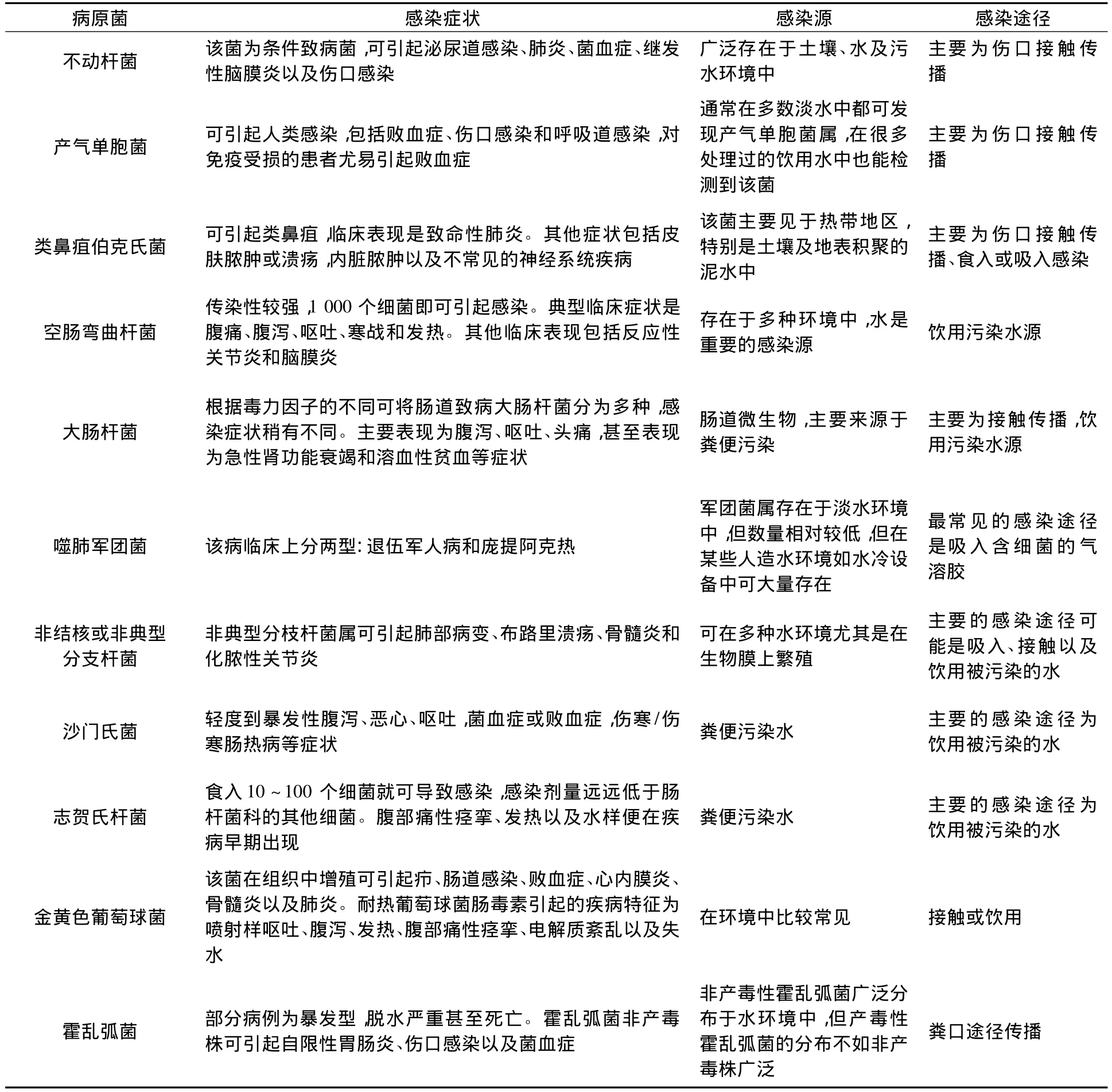
表1 地下水中常見病原菌
2 病原菌遷移轉化
病原菌在地下水中的遷移轉化受到表層土壤和包氣帶厚度、地質構造、水文地質狀況和污染源類型的影響,見表2[14]。土壤和包氣帶通過過濾和吸附作用阻止病原菌向地下水中遷移。土壤粒徑分布是影響過濾效果的重要因素,粒徑越小,效果越好,因為細顆粒物的死端孔隙能有效過濾病原菌;吸附作用受到包氣帶疏水性、土壤和沉積物濕度、pH、離子強度的影響。相比于含水層,表層土壤和包氣帶具有更強的使病原菌衰減的能力,Schijven研究結果表明,在沙丘中傳染性病毒用25 d從污染源遷移了30 m,病毒數量減少了8個數量級,在該場地的含水層中,要降低到相同的數量需要遷移 40 d[15]。
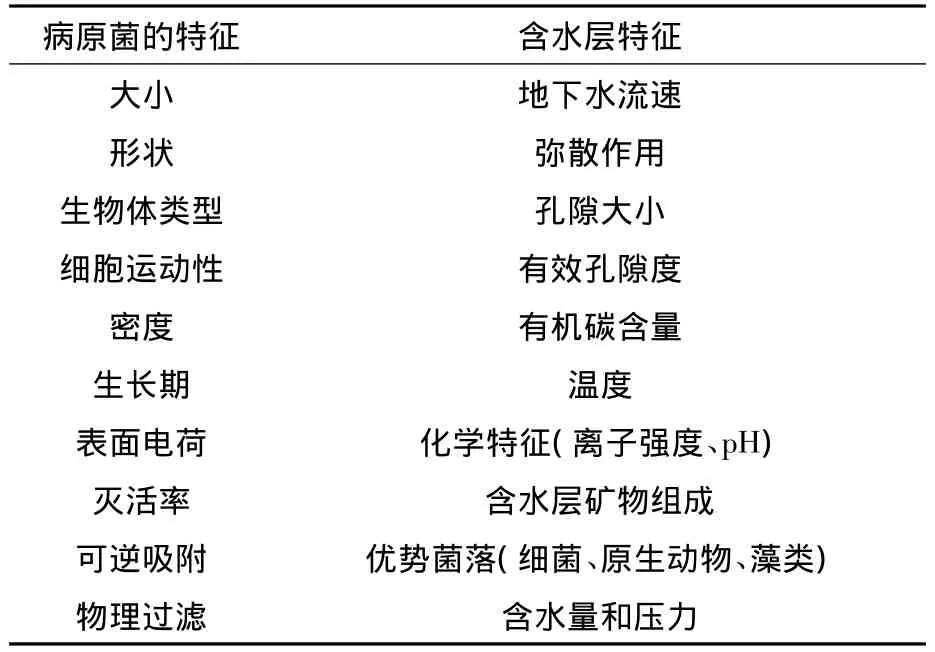
表2 地下水中影響病原菌遷移的因素
病原菌進入含水層后,含水層孔隙度和水流速度是影響病原菌衰減和遷移的重要因素。孔隙、巖溶和裂隙地下水具有不同的流速,對病原菌的衰減程度各不相同[16],在孔隙地下水中,地下水流速為每天十幾米,病原菌不容易遷移,易發生衰減;在巖溶水中,由于較大的水流速度,病原菌可以每天遷移數公里,因此裸露的巖溶含水層易受病原菌的污染。大量結果表明,水源性疾病容易在非孔隙型地下水中爆發,特別是在基巖裂隙或者巖溶地下水中發生[17]。因此,應重視巖溶和裂隙地下水等環境敏感地區的地下水病原菌污染的監測工作。
3 地下水中病原菌檢測現狀
目前大多數國家和地區仍采用傳統培養方法對環境中病原菌進行檢測。由于傳統培養方法獲得檢測結果的成本和時限問題,對于地下水中特殊病原菌的檢測,目前一般僅限于確認是否污染或確證某種水處理工藝的有效性,而對于微生物的監測通常僅限于指示性微生物,如用總大腸菌群監測水處理效果,用埃希氏大腸桿菌指示水體是否被糞便污染。然而多數病原菌的存在條件與指示微生物的存在條件不是完全相關的,用傳統的培養方法很難直接反映其污染情況,因此僅檢測一種或少數幾種病原菌的濃度并不能反映病原菌的污染情況,如流行病學數據表明總大腸菌數,糞大腸菌數等指示微生物與霍亂弧菌、志賀氏菌等引起的病理學發病率的相關性較差,這些情況都說明傳統的檢測方法已經過時,很難起到監測水體環境質量的作用[18]。
4 影響地下水中病原菌檢測的因素
對地下水中病原菌檢測影響因素的了解,是研發有針對性檢測技術的基礎。影響地下水中病原菌的檢測因素主要包括以下3個方面:1)水體體積較大,水體中微生物濃度相對較低,很難直接從大量水中分離或檢測到少量的特定病原菌[19];2)水體中營養物質匱乏,病原菌污染水體并經長時間的適應后易形成存活但不可培養的狀態[20];3)隨著人類活動的增加,病原菌污染水體的機會也相應增加,這也相應提高了對水體中病原菌監測的種類、場所及頻次等要求。因此,快速、高通量、準確特異性是水體病原菌檢測技術研究中需考慮的重要因素。
5 不同病原菌檢測方法在地下水中的應用現狀
病原菌檢測技術主要分為以下幾大類:傳統平板培養法、免疫學方法、聚合酶鏈反應技術(PCR)、生物芯片法(biochip)、生物傳感器(biosensor)等方法,如表3所示。平板培養法檢測所需周期長,很多病原菌檢測方法還未建立,更重要的是許多微生物不能在固體培養基上形成菌落,環境中物理或化學等因素也易影響病原菌的活性而形成不可培養狀態,影響對水體病原微生物及時和有效的監測[21-22]。免疫學方法檢測病原菌的假陽性或假陰性率較高,不能反映水體中病原菌實際污染情況。聚合酶鏈反應技術、生物芯片法、生物傳感器等生物和生物物理方法,因為其快速靈敏、準確度高等特點被廣泛關注。下面對上述3類新技術進行詳細介紹。
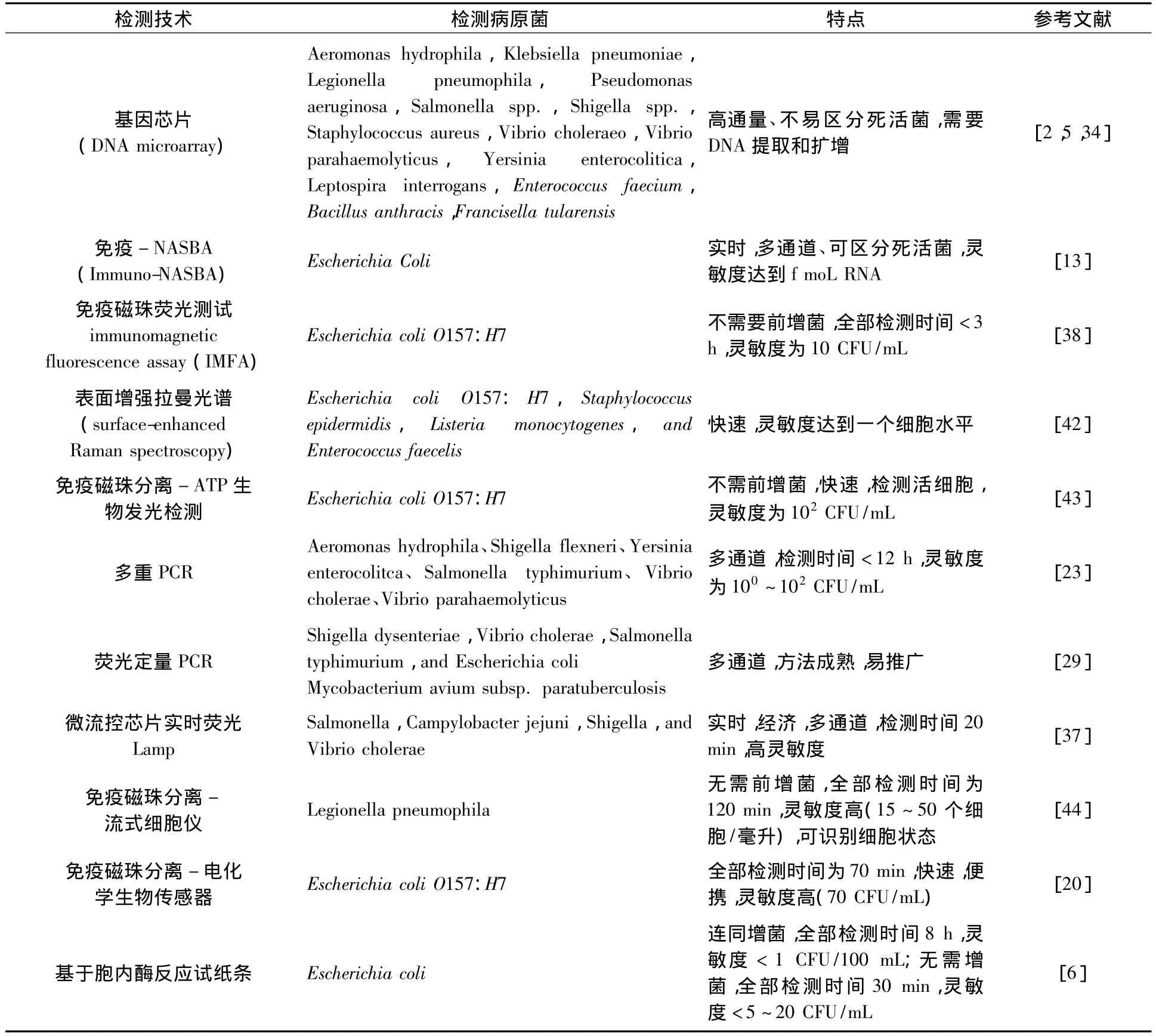
表3 地下水中病原菌主要檢測技術
5.1 聚合酶鏈式擴增反應技術在地下水中的應用現狀
聚合酶鏈反應技術是針對目的基因設計特異寡核苷酸引物,并在反應體系中加入DNA聚合酶和4種dNTP,以目的基因為模板進行多個循環的DNA體外擴增的技術,在短時間內可通過擴增獲得大量目的基因。PCR及其衍生的方法,如實時熒光定量PCR技術,已用于檢測或鑒別不同類型水體中的一種或多種病原菌[23-24],但單獨使用上述方法不能區分活菌和死菌,易造成假陽性,研究發現在熒光定量PCR或基因芯片等核酸擴增技術中利用疊氮溴化丙錠(propidium monoazide),可選擇性結合修飾死菌細胞的DNA,從而間接計算出水體樣本中活菌數量,提高PCR技術的檢測準確度[25-26]。另外由于病原菌在水體中的濃度較低,可通過較長時間的前增菌或濃縮處理,增加目標活菌的濃度,稀釋干擾雜質,復蘇受損細菌[27-29],提高檢測的準確性。為了避免長時間的增菌或濃縮步驟,He等[30]采用免疫磁珠(IMS)直接從水樣中特異性捕獲產志賀毒素大腸桿菌(STEC)。微生物的rRNA(pre-rRNA)是一種反映系統發育特性和指示生理狀態的總rRNA的重要成分,Cangelosi等[31]通過反轉錄實時熒光定量PCR(RT-qPCR)分析pre-rRNA的變化情況達到檢測活病原菌的目的。環介導等溫擴增法(Lamp)是一種比PCR技術更靈敏,速度更快的核酸擴增技術,依賴于能夠識別靶DNA上6個特定區域的4條引物和一種具有鏈置換活性的DNA聚合酶,在恒溫條件下高效擴增核酸,1 h即可完成。Yamazaki等[32]用 Lamp檢測產霍亂毒素的霍亂弧菌,大大縮短了檢測時間,靈敏度提高10倍。為了改善Lamp的應用性,Chang等[33]將病原菌DNA磁珠提取組件及微流控LAMP反應芯片和光學檢測系統整合成一臺可快速、靈敏、方便的裝置,用于水產養殖中水體中病原菌的檢測。
5.2 生物芯片技術在地下水中的應用現狀
生物芯片技術是采用原位合成或微矩陣點樣等方法將大量的生物分子有序地固定在硅膠片等固化材料上,然后與已標記的待測樣品進行作用,通過特定的儀器分析相應的作用情況而達到分析檢測的目的。根據生物芯片所選用固化材料的不同,可將生物芯片分為基因芯片、蛋白芯片、細胞芯片及組織芯片等,各種生物芯片檢測技術均具有檢測通量和自動化程度高的特點,目前對水中病原菌檢測應用較多的主要是基因芯片和微流控芯片。Zhou[34]等針對細菌的16S-23S rRNA 內部轉錄間隔區和促旋酶B基因序列設計寡核苷酸基因芯片,可同時檢測水體中包括肺炎軍團菌、沙門氏菌、致賀氏菌、腸炎耶爾森菌及霍亂弧菌等28種致病菌,重復性和特異性較好,在飲用水中添加陽性細菌后檢測靈敏度最低可至0.1 ng DNA或104CFU/mL。微流控芯片(Microfluidic lab-on-a-chip)具有比表面積大、樣品需要量小及檢測通量高等多種優點,Agrawal等[35]將其同免疫磁納米粒子及碲化鎘量子點標記結合可快速靈敏地同時檢測水中低濃度的大腸桿菌和沙門氏菌。Cichova等[36]在研究水中病原菌的檢測過程中,應用微電化學技術開發了一種微流控生物芯片,可在線裂解病原菌并提取核酸,從而有利于后續的快速檢測。Dharmasiri等[37]用O157多克隆抗體共價耦聯修飾微流控芯片后,可快速富集水體中較低濃度(<100細胞/毫升)的E.coli O157:H7,然后將富集的菌體使用實時熒光定量PCR針對slt1基因擴增檢測,結果表明,該方法的回收率可達到72%,檢出限最低達到6 CFU/L。Liu等[38]用低蛋白結合膜獲得菌體,然后直接提取RNA并進行RT-PCR后,利用芯片檢測E.coli O157:H7的rfbE和fliC基因,該方法最低可檢測到自來水中的3~4 CFU/L的E.coli O157:H7,河水中最低可檢測7 CFU/L的E.coli O157:H7。
5.3 生物傳感器檢測技術在地下水中的應用現狀
生物傳感器起源于20世紀60年代,是將生物識別元件和信號轉換元件緊密結合,從而檢測目標物的分析裝置。不同的生物識別元件和信號轉換元件組成了不同的生物傳感器,分類方式有多種,可根據生物識別元件或信號轉換元件分。轉化元件,目前的生物傳感器主要包括電化學生物傳感器、電流生物傳感器、電位生物傳感器、阻抗生物傳感器、光學生物傳感器和壓電生物傳感器等,目前在致病菌檢測方面研究較多的是電化學生物傳感器、光學生物傳感器和壓電生物傳感器[39]。Simpson 等[40]直接利用光纖可視生物傳感器在2 h內快速檢測水體中的大腸桿菌,不但降低了基質中的PCR反應抑制劑,還減少了對樣品進行前增菌處理過程,提高了檢測速度。Chowdhury等[41]用基于共價連接在電極上多聚苯胺膜的抗原抗體反應制成的阻抗生物傳感器檢測水中的E.coliO157:H7。目前,用于水中致病菌檢測的生物傳感器種類很多,也有不少商品化的儀器問世,但其檢測限還偏高,在實際檢測中易出現假陽性、假陰性的結果。未來生物傳感器的發展趨勢和重點方向是微型化、多功能化、智能化和集成化,開發新一代低成本、高靈敏度、高穩定性和高壽命的生物傳感器是目前研究的熱點。
6 討論
目前,中國對于水體中病原菌等微生物的檢測種類相對于水體中日益增多的病原菌污染仍然比較少,主要限于菌落總數、大腸菌群和軍團菌等。另外,檢測手段也比較落后,主要包括微生物的分離純化,生化鑒定、血清學鑒定、酶學鑒定等常規方法或普通PCR鑒定。隨著分子生物學、物理、電子、材料等多種學科的發展,病原菌的檢測手段也日益豐富,熒光定量PCR、生物芯片或生物傳感器等技術手段得到廣泛的研究和發展,水體中病原菌檢測的準確性、檢測速度、特異性和靈敏度都得到了極大的改善和提高。對于水中病原菌的檢測,除了以上幾種主要技術外還有幾種技術值得研究。如Fan等[42]應用表面增強拉曼光譜結合納米技術檢測水中的多種致病菌,研究表明該技術有望進行快速靈敏的檢測。Hunter等[43]應用死端超濾濃縮水中E.coli O157:H7后,可有效進行IMS/ATP(免疫磁珠捕獲-ATP)的活菌檢測。Keserue等[44]利用流式細胞儀結合膜濃縮技術、免疫磁珠分離技術研究對嗜肺軍團菌的快速檢測,靈敏度高,而且可識別細菌的不同狀態。然而上述這些技術手段在中國還沒得到有效應用,主要原因是這些檢測技術的研究主要集中在對分離純化好的病原菌的檢測階段,病原菌的前增菌和分離純化仍然是這些檢測技術難以突破的技術瓶頸,另外,這些技術的成本昂貴也是難以在實際監測中得到廣泛應用的因素。
7 展望
各種致病菌檢測技術各有所長,也有各自的缺陷。綜上所述,目前病原菌檢測技術的發展趨勢是將PCR、生物芯片等檢測技術同微流控分離、免疫磁珠分離、納米材料標記等結合,利用不同技術的優勢,達到快速、靈敏、經濟、便攜甚至在線監測的目的。因此,未來對地下水中病原菌的檢測技術還要更多考慮多種技術平臺或手段的整合,同時兼顧成本和實用性,以期為保障人類健康和飲用水安全提供更強有力的支撐。
[1]Danielopol D L,Griebler C,Gunatilak A,et al.Present state and future prospects for groundwater ecosystems[J].Environmental Conservation,2003,30:1-27.
[2]Bruce A,Macler J C,Merkle.Current knowledge on groundwater microbial pathogens and their control[J].Hydrogeology,2000,8(1):29-40.
[3]Craun G F,Brunkard J M,Yoder J S,et al.Causes of outbreaks associated with drinking water in the United States from 1971 to 2006[J].Clinical Microbiological Reviews,2010,23(3):507-528.
[4]Andrew S,Ferguson A,Alice C,et al.Comparison of fecal indicators with pathogenic bacteria and rotavirus in groundwater[J].Science of the Total Environment.2013,431:314-322.
[5]Paul D H,Thomas K M,Katarina D M,et al.Contamination of groundwater systems in the US and Canada by enteric pathogens,1990-2013:a review and pooled-analysis[J].Plos One,2014,9(5):1-12.
[6]趙仲麟,李淑英,李燕.水體病原微生物分子檢測技術研究進展[J].生物技術通報,2012,1:41-44.
[7] Kirschner A K,Kavka G G,Velimirov B,et al.Microbiological water quality along the Danube River:integrating data from two whole-river surveys and a transnational monitoring network[J].Water Research,2009,43:673-3 684.
[8]Palmer S,Gully P,White J,et al.Water-borne outbreak of Campylobacter gastroenteritis[J].The Lancet,1983,321(8 319):287-290.
[9]Stout J, Yu V M. BestEcology ofLegionella pneumophila within water distribution systems[J].Applied and environmental microbiology,1985,49(1):221-228.
[10]Baird-Parker A.Foodborne salmonellosis[J].The Lancet,1990,336(8 725):1 231-1 235.
[11]Swerdlow D L,Woodruff B A,Brady R C,et al.A waterborne outbreak in Missouri of Escherichia coli O157:H7 associated with bloody diarrhea and death[J].Annals of Internal Medicine,1992,117(10):812-819.
[12] Bottone E J.Yersinia enterocolitica:overview and epidemiologic correlates[J].Microbes and Infection,1999,1(4):323-333.
[13]Edberg S,Rice E,Karlin R,et al.Escherichia coli:the best biological drinking water indicator for public health protection[J].Symposium Series(Society for Applied Microbiology),2000,(29):106S-116S.
[14]Chilton J.Assessment of aquifer pollution vulnerability and susceptibility to the impactsofabstraction.Protecting Groundwater for Health -Managing the Quality of Drinking Water Sources[R].World Health Organization,2006:199-241.
[15]Schijven J F,Bruin H A,Hassanizadeh S M,et al.Bacteriophages and Clostridium spores as indicator organisms for removal of pathogens by passage through saturated dune sand[J].Water Research,2000,37:2 186-2 194.
[16]Pang L.Microbial removal rates in subsurface media estimated from published studies of field experiments and large intact soil cores[J].J Environmental Quality,2009,38:1 531-1 559.
[17]Fong T T,Mansfield L S,Wilson D L,et al.(2007):Massive MicrobiologicalGroundwaterContamination Associated with a Waterborne Outbreak in Lake Erie,South Bass Island,Ohio[J].Environmental Health Perspective,2007,115(6):856-864.
[18]Lund V.Evaluation of E.coli as an indicator for the presence of Campylobacter jejuni and Yersinia enterocolitica in chlorinated and untreated oligotrophic lake water[J].Water Research,1996,30(6):1 528-1 534.
[19] Fleisher J M.Conducting recreational water quality surveys:someproblemsand suggested remedies.Marine pollution bulletin[J],1990,21(12):562-567.
[20]Cenciarini-Borde C,Courtois S,La S B.Nucleic acids asviability markers forbacteria detection using molecular tools[J].Future Microbiology,2009,4(1):45-64.
[21]Kong R,Lee S,Law T,et al.Rapid detection of six types of bacterial pathogens in marine waters by multiplex PCR.Water Research[J],2002,36(11):2 802-2 812.
[22]Tissie A,Denis M,Hartemann P,et al.Development of a Rapid and Sensitive Method Combining a Cellulose Ester Microfilter and a Real--Time Quantitative PCR Assay To Detect Campylobacter jejuni and Campylobacter coli in 20 Liters of Drinking Water or Low-Turbidity Waters[J].Applied and environmental microbiology,2012,78(3):839-845.
[23]Zhou G,Wen S,Liu Y,et al.Development of a DNA microarray for detection and identification of Legionella pneumophila and ten other pathogens in drinking water[J].International journal of food microbiology,2011,145(1):293-300.
[24] Dharmasiri U,Witek M A,Adams A A,et al.Enrichment and detection of Escherichia coli O157:H7 from watersamples using an antibody modified microfluidic chip[J].Analytical chemistry,2010,82(7):2 844-2 849.
[25]Liu Y,Gilchrist A,Zhang J,et al.Detection of viable but nonculturable Escherichia coli O157:H7 bacteria in drinking water and river water[J].Applied and environmental microbiology,2008,74(5):1 502-1 507.
[26]Fan C,Hu Z,Mustapha A,et al.Rapid detection of food-and waterborne bacteria using surface-enhanced Raman spectroscopy coupled with silver nanosubstrates[J].Applied microbiology and biotechnology,2011,92(5):1-9.
[27]Hunter D M,Leskinen S D,Maga?na S,et al.Deadend Ultrafiltration Concentration and IMS/ATP-bioluminescence detection of Escherichia coli O157:H7 in recreational water and produce wash[J].Journal of microbiological methods,2011,87(3):338-342.
[28] Keserue H A,Baumgartner A,Felleisen R,et al.Rapid detection of total and viable Legionella pneumophila in tap water by immunomagnetic separation,double fluorescentstaining and flow cytometry[J].Microbial Biotechnology,2012,5(6):753-763.
[30]Roszak D,Colwell R.Survival strategies of bacteria in the natural environment[J].Microbiological Reviews,1987,51(3):365.
[31]Fukushima H,Tsunomori Y,Seki R.Duplex real-time SYBR green PCR assays for detection of 17 species of food-or waterborne pathogens in stools[J].Journal of Clinical Microbiology,2003,41(11):5 134-5 146.
[32] Bae S,Wuertz S.Discrimination of viable and dead fecal Bacteroidales bacteria by quantitative PCR with propidium monoazide[J].Applied and environmental microbiology,2009,75(9):2 940-2 944.
[33] Nocker A,Mazza A,Masson L,et al.Selective detection of live bacteria combining propidium monoazide sample treatment with microarray technology[J]. Journalofmicrobiologicalmethods,2009,76(3):253-261.
[34]Bonetta S,Borelli E,Conio O,et al.Development of a PCR protocol for the detection of Escherichia coli O157:H7 and Salmonella spp.in surface water[J].Environmentalmonitoring and assessment,2011,177(1):493-503.
[35]Leskinen S D,Kearns E A,Jones W L, et al.Automated dead-end ultrafiltration of large volume water samples to enable detection of low-level targets and reduce sample variability[J].Journal of applied microbiology,2012,113(2):351-360.
[36]He X,W Qi,Qui?nones B,et al.Sensitive detection of Shiga Toxin 2 and some of its variants in environmental samples by a novel immuno-PCR assay[J].Applied and environmental microbiology,2011,77(11):3 558-3 564.
[37]Cangelosi G A,Weigel K M,Lefthand-Begay C,et al.Molecular detection of viable bacterial pathogens in water by ratiometric pre-rRNA analysis[J].Applied and environmental microbiology,2010,76(3):960-962.
[38]Yamazaki W,Seto K,Taguchi M,et al.Sensitive and rapid detection ofcholera toxin-producing Vibrio cholerae using a loop-mediated isothermal amplification[J].BMC microbiology,2008,8(1):94-102.
[39]Chang W H,Yang S Y,Wang C H,et al.Rapid isolation and detection of aquaculture pathogens in an integrated microfluidic system using loop-mediated isothermal amplification[J].Sensors and Actuators B:Chemical,2011,45(4):146-160.
[40]Agrawal S,Morarka A,Bodas D,et al.Multiplexed Detection of Waterborne Pathogens in Circular Microfluidics[J]. Applied biochemistry and biotechnology,2012,167(6):1-10.
[41]Cíchová M,ProkˇsováM,Tóthová L,et al.On-line cell lysis of bacteria and its spores using a microfluidic biochip[J].Central European Journal of Biology,2012,7(2):230-240.
[42]Palchetti I,Mascini M.Electroanalytical biosensors and their potential for food pathogen and toxin detection[J].Anal Bioanal Chem,2008,391(2):455-471.
[43]Simpson J M,Lim D V.Rapid PCR confirmation of E.coliO157:H7 after evanescent wave fiber optic biosensor detection[J].Biosens Bioelectron,2005,21(6):881-887.
[44]Chowdhury A D,De A,Chaudhuri C R,et al.Label free polyaniline based impedimetric biosensorfor detection of E.coliO157:H7 Bacteria[J].Sensors and Actuators B:Chemical,2012,171:916-923.

