短期暴露于城市污水處理廠尾水的文蛤抗氧化酶響應
蘇恩萍,孟范平,孫 婷,付文超,王 群,李永富,胡 恒 (中國海洋大學海洋環境與生態教育部重點實驗室,山東 青島 266100)
短期暴露于城市污水處理廠尾水的文蛤抗氧化酶響應
蘇恩萍,孟范平*,孫 婷,付文超,王 群,李永富,胡 恒 (中國海洋大學海洋環境與生態教育部重點實驗室,山東 青島 266100)
為研究城市污水處理廠(STPs)尾水是否會引起海洋生物的氧化逆境,將取自青島市李村河污水處理廠的尾水用海水稀釋到不同濃度(0%、1%、5%、10%、20% V/V), 對文蛤(Meretrix meretrix)暴露培養15d, 分析其內臟中超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、谷胱甘肽過氧化物酶(GPx)、谷胱甘肽還原酶(GR)的活性. 結果表明:SOD活性隨尾水暴露時間延長基本表現為“拋物線型”的響應特征,體積比10%、20%的尾水暴露6~12d期間,文蛤體內SOD活性均受到誘導,最大增幅為15.88%;CAT和GPx對尾水的主要響應特征是抑制效應,分別在暴露9d、12d時最為明顯,最大抑制率分別為64.38%和52.39%;較高濃度(20%)的尾水能夠持續抑制GR活性,而其他處理組中,GR對尾水表現為“拋物線型”的響應特征,即:暴露3d或6d時活性增加,而后顯著降低.GR活性的最大誘導出現在暴露3d和6d時,分別比對照組上升81.47%和80.91%.研究結果進一步表明STPs不能有效降解有害化學物質以消除尾水的毒性, 文蛤內臟SOD、CAT、GPx和GR活性能夠敏感指示尾水誘導的氧化逆境.
城市污水處理廠;尾水;文蛤;抗氧化酶
雙殼類動物由于其分布廣泛、營固著生活及其高富集性、能抵抗高濃度化學污染并能從周圍環境蓄積大量外源性物質等特點,現已被廣泛用作海洋環境質量的指示生物[1-3].文蛤(Meretriχ meretriχ)又名花蛤,屬軟體動物門、雙殼綱、真瓣鰓目、簾蛤科、文蛤屬.生活在有淡水注入的內灣及河口附近的細沙質海灘,是我國沿海灘涂養殖的主要經濟貝類之一.
城市污水處理廠(STPs)尾水的排放造成重金屬、表面活性劑、氯代烴、多環芳烴(PAHs)、某些藥物和內分泌干擾物等微量污染物進入受納水體中,成為水環境中化學污染物的重要來源.而現有的污水二級處理工藝以及先進處理技術(高負荷活性污泥法等)均無法對其進行有效去除[4-5].大量研究表明:過渡金屬、PAHs、有機氯和有機磷農藥、多氯聯苯和其他異型物質都能對生物體產生氧化壓力,并引起各種有害影響,如對膜脂、DNA和蛋白質產生損傷等[6].損傷程度取決于生物細胞中具有重要功能的抗氧化酶在氧化逆境條件下的可誘導性[7].任何暴露于污染物的生物體內經常會出現這種重要的逆境響應,因此,包括抗氧化酶在內的抗氧化響應常被用作生態毒理學研究中診斷環境污染對生物體不利影響的生物標志物[8].抗氧化酶(Antioxidant enzyme)是超氧化物歧化酶(SOD)、谷胱甘肽還原酶(GR)、谷胱甘肽過氧化物酶(GPχ)、過氧化氫酶(CAT)等的統稱.一旦在體內形成過氧化物(該物質能引起氧化壓力),這些抗氧化酶即刻發揮功效,利用氧化還原作用將過氧化物轉換為毒害較低或無害的物質.目前國外許多國家已經開始利用抗氧化酶評價 STPs尾水對海水的生態效應
[9-10],而國內的研究相對較少,很大程度上限制了尾水對海水污染影響評價的發展.
青島目前已有五家污水處理廠,日處理污水近百萬 t.這些污水經二級處理后大多排海,能否造成海洋生物抗氧化酶活性的變化尚無相關資料加以判斷.本研究以青島海域常見的雙殼類動物文蛤為研究對象,以青島李村河污水處理廠的尾水為實驗材料,配制尾水體積比(EVR)為0%、1%、5%、10%、20%的尾水-海水混合液,對文蛤連續暴露培養15d,定期采樣測定內臟中 4種抗氧化酶活性隨尾水體積比和暴露時間的變化情況,以探討尾水對雙殼類動物抗氧化防御系統的可能影響,為今后進行尾水的海洋生態毒性效應評價提供依據.
1 材料與方法
1.1 尾水-海水混合液配制及實驗動物馴養
天然清潔海水:取自青島市石老人海域(pH值7.90±0.02、鹽度32‰).
尾水:采自青島李村河污水處理廠,處理工藝為 A2/O(厭氧-缺氧-好氧活性污泥法)+ MBBR(膜生物反應器).每隔6h采集1次,將24h內采集的 4個尾水樣品等體積混合.運回實驗室后,于4℃保存,當天使用.
尾水與海水混合液:將新鮮采集的尾水靜置沉淀1h,取上清液(鹽度約為1‰)與天然清潔海水進行混合,考慮到供試動物文蛤正常生長代謝所需的鹽度范圍為21‰~36‰[11],為避免尾水過量混入海水后引起鹽度低于21‰的情況出現進而干擾文蛤抗氧化酶對尾水毒性的真實響應,暴露實驗中采用的最大尾水體積比(EVR)為20%,并依次設置0%、1%、5%、10%、20%五個梯度.依次向各體積比的混合液中加入相應量的海水晶(山東濰坊市海佳海水晶廠以純凈海水為原料生產),溶解混均,使各體積比處理組的鹽度均保持為32‰.
供試文蛤:平均殼長為 40.1mm,購自水質清潔的青島市嶗山灣大管島海域養殖區,于冰上保存運輸.挑選健康、大小基本一致的蛤仔,在溫度(15±1)℃下,用天然清潔海水馴養7d.期間每天更換新鮮的天然清潔海水,定時定量投加實驗室保種培養的海水小球藻(Chlorella pacifica)作為文蛤的餌料,投加密度為 1.3×107個/(L?d),同時利用空氣泵持續充氧,使DO保持在(6±0.5)mg/L.
1.2 暴露培養
挑選健康、反應靈敏、大小一致的文蛤隨機投放于15個10L玻璃缸中,每個玻璃缸投放90只,加入相應體積比的尾水-海水混合液(每個體積比設3個平行),在上述溫度條件下連續培養15d,每24h 更換1次相應體積比的混合液.每天定時定量投入實驗室保種培養的海水小球藻(Chlorella pacifica)作為文蛤的餌料,投加密度為1.3×107個/(L?d).
對于每個尾水暴露實驗組或空白對照組,在培養開始時以及開始后每隔 3d,隨機取出 30只動物個體(每個處理組的3個玻璃缸中各隨機取出10只),立即在冰上解剖,摘取內臟,切細混合均勻,于-80℃保存,用于抗氧化酶分析.
1.3 生物標志物分析
稱取一定量的內臟,采用高鷹[12]的方法制備提取液,按質量體積比 1:4加入 pH7.8的Tris-HCl(0.02mol/L)緩沖溶液進行勻漿,然后,在轉速10000r/min、4℃下離心15min,取上清液測定SOD、CAT、GPχ、GR活性.
基于酶試劑盒在測定抗氧化酶活性方面的快速、簡便、精密度高、易于標準化等優點,SOD、CAT、GPχ、GR及上清液中蛋白質含量均采用南京建成生物工程研究所生產的試劑盒測定,單位分別為U/mg蛋白質、U/g蛋白質、U/mg蛋白質、U/g蛋白質、g/L.
1.4 數據統計分析
抗氧化酶測定結果表示:對于每個體積比的尾水暴露組或空白對照組,各暴露時間制備的內臟樣品中每種抗氧化酶均平行測定3次,以(平均值 Xi±標準差 SD)表示該尾水暴露組(或空白組)的內臟中該抗氧化酶的活性.
抗氧化酶測定結果的差異顯著性判斷:用單因素方差分析中 Games-Howell(方差非齊性)或Tukey(方差齊性)檢驗方法對暴露培養中每種抗氧化酶活性隨尾水體積比、暴露時間的變化差異性檢驗.統計顯著性水平為P<0.05.數據統計分析使用SPSS 18.0軟件.
相關性分析:采用雙變量 Pearson相關性分析,研究呈單向響應的生物標志物測定值與尾水體積比的關系,統計顯著性水平為 P<0.05和P<0.01.
2 結果與討論
在城市化高度發展和人口密集的沿海地區,污染物隨著STPs出水(或尾水)的排放而進入受納水體中,成為重要污染源[13-14].目前,雖有研究發現作為尾水化學組成成分的壬基酚(NP)、有機氯農藥和PAHs等化學物質能夠通過過氧化作用產生生物毒性[15-18],但是有關 STPs尾水對雙殼類動物氧化逆境因子影響的系統研究尚不多見.
2.1 尾水-海水混合暴露對文蛤內臟SOD活性的影響
圖1為暴露于尾水-海水混合液后文蛤的內臟SOD活性隨尾水體積比(EVR)的變化情況.暴露前的文蛤內臟SOD活性為51.57U/mg蛋白質,在不含尾水的海水(對照組)中培養期間,SOD活性保持在54.41~57.75U/mg蛋白質之間.在尾水-海水混合體系暴露3d后,文蛤內臟SOD活性僅在EVR為10%的處理組中被誘導(P<0.05),比對照組提高5.64%;暴露6d后,有3個處理組的SOD活性顯著高于對照組的水平,最大增幅為15.88%;暴露9d后,所設置的4個尾水體積比處理均誘導了內臟SOD活性,最大增幅出現在EVR1%的處理組,為12.98%.隨后,尾水對SOD的誘導逐漸減弱,暴露12d時,只有體積比為10%、20%的兩個處理組表現出高于對照組的SOD活性,且增幅分別僅為6.87%和5.66%;至暴露15d時,除了EVR為 1%的處理組顯著高于對照組外,其他處理組的SOD活性均低于對照組(EVR5%、10%處理組的降幅分別為 9.63%和 7.67%,P<0.05)或與對照組差異不大(EVR20%處理組,P>0.05).
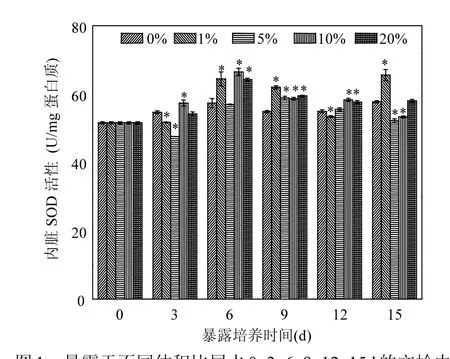
圖1 暴露于不同體積比尾水0, 3, 6, 9, 12, 15d的文蛤內臟SOD活性變化Fig.1 Variation of SOD activities in the viscera of mussels exposed to serial dilutions of STP effluent on days 0, 3, 6, 9, 12and 15*表示在P<0.05水平上與對照組差異顯著,下同
SOD主要存在于細胞質內以及線粒體內外膜之間,其作用是催化超氧陰離子自由基發生歧化反應生成 H2O2和.有關海水重金屬
[20]、NP[21]等對雙殼類動物 SOD活性影響的許多研究報道:隨著暴露時間延長或者濃度增加,誘導幅度逐漸變小,甚至出現抑制,呈現“拋物線型”的劑量-效應關系.本研究發現(圖 1),各體積比的尾水處理組中,隨著暴露時間延長,SOD活性基本表現為“拋物線型”的響應趨勢,只是EVR1%處理組在暴露末期仍有較大幅度誘導,使劑量效應趨勢與其他處理組有所不同.SOD的誘導效應多出現在第6、9、12d,而暴露初期和后期的活性較低,個別處理組甚至受到一定程度抑制.在同樣的暴露時間下,由于尾水中污染成份之間的復雜作用,SOD活性對不同劑量(體積比)尾水并未體現出“拋物線型”響應特征,僅在暴露15d時有相對明顯的低促高抑現象.總體上,在為期15d的暴露期間,文蛤SOD活性對尾水的響應以誘導為主,活性最大增幅為 15.88%,出現在暴露第6d的EVR10%處理組.SOD活性的上升,意味著尾水中的污染成分進入蛤體后能夠產生一定量的?,需要較高SOD活性予以清除.
2.2 尾水-海水混合暴露對文蛤內臟CAT活性的影響

圖2 暴露于不同體積比尾水0, 3, 6, 9, 12, 15d的文蛤內臟CAT活性變化Fig.2 Variation of CAT activities in the viscera of mussels exposed to serial dilutions of STP effluent on days 0, 3, 6, 9, 12and 15
由圖 2可知,暴露前文蛤內臟過氧化氫酶(CAT)活性為80.77U/g蛋白質,隨后的培養期間,對照組的CAT活性變化較小(78.68~84.51U/g蛋白質).經尾水-海水混合體系暴露3d后,各處理組的文蛤內臟 CAT活性均受到明顯抑制(P<0.05),與對照組相比,EVR 1%、5%、10%、20%的處理組中CAT活性分別降低44.28%、45.57%、23.41%和39.08%;暴露6d時,各處理組的CAT活性均出現回升,EVR 10%、20%與對照組無顯著差異(P>0.05);繼續延長暴露時間到培養結束,各處理組的CAT活性無一例外地再次受到明顯抑制,且抑制程度基本上呈現隨EVR增大而提高的趨勢,其中,第 9d和 12d的活性降幅最大, EVR20%的處理組中CAT活性分別降為對照組的 53.38%和 35.62%.暴露 15d時,各處理組的CAT活性雖然有所上升,但仍然顯著低于對照組.
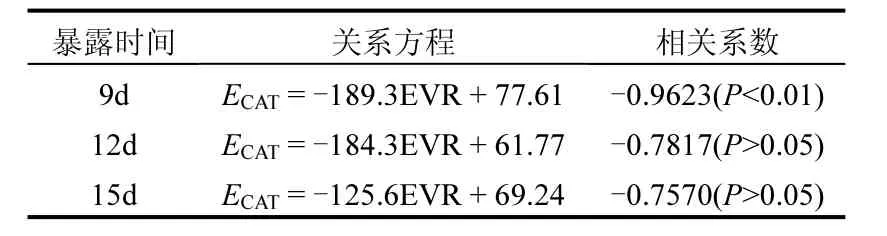
表1 暴露于尾水后文蛤內臟CAT活性與EVR的相關性分析Table 1 Correlative relationship between EVR and CAT activities in the viscera of Meretriχ meretriχ exposed to effluent
CAT是一類末端氧化酶,主要功能是將體內的H2O2分解成O2和H2O,減輕H2O2對細胞的氧化損傷.有學者認為,CAT通常是最早受到誘導的抗氧化酶之一[22-23].但是,以往文獻中,關于雙殼類動物CAT對各種污染物響應特征的研究結果各不相同;較低濃度重金屬誘導雙殼類CAT活性的情況十分少見,隨著海水重金屬濃度的增加或暴露時間延長,雙殼類CAT活性一般會受到較大抑制[24-28].但是,關于有機污染物的研究發現[18],暴露于PAHs(蒽、芘)和有機氯農藥(六六六、艾氏劑、狄氏劑、p,p′-DDT)的翡翠貽貝(Perna viridis)內臟 CAT活性均受到顯著誘導,而且這種情況只發生于暴露開始后一周內.本研究的尾水暴露期間,未觀察到任何處理組的文蛤CAT活性被誘導,相反,CAT活性受抑制的現象非常普遍(只有第6d的EVR10%、EVR20%處理組與同期對照組差異不顯著).暴露初期的CAT活性抑制程度與EVR之間無明顯規律;而在暴露9~15d時,高EVR處理組的CAT活性一般受到較大抑制,表現出強烈的劑量效應關系.這種響應特征不同于前人研究中有機污染物引起 CAT活性明顯上升的情況,而更類似于大多數種類的重金屬對 CAT的抑制效應.相關性分析表明,暴露9d時的文蛤內臟CAT活性與尾水EVR具有極顯著(P<0.01)的負相關性,而在其他暴露時間兩者均不存在顯著相關性(P>0.05).文蛤CAT在某一暴露時段對尾水的顯著相關性響應特征,對于尾水排放海域污染程度的評價分級是有利的.
2.3 尾水-海水混合暴露對文蛤內臟GPχ活性的影響

圖3 暴露于不同體積比尾水0, 3, 6, 9, 12, 15d的文蛤內臟GPχ活性變化Fig.3 Variation of GPχ activities in the viscera of mussels exposed to serial dilutions of STP effluent on days 0, 3, 6, 9, 12and 15
正式培養之前,文蛤內臟的谷胱甘肽過氧化物酶(GPχ)活性為10.08U/mg蛋白質.雖然培養期間活性稍有提高,但波動幅度不大(11.46~13.87U/mg蛋白質).與 CAT類似,大多數處理組的GPχ活性在暴露3d后即受到顯著抑制,相對于同期的對照組,降幅在8.29%~15.65%,高EVR處理組的抑制率較高;暴露時間延長至 6d、9d時,除了EVR10%的處理組持續對GPχ活性產生抑制(8.47%、9.34%)外,其他處理組的GPχ活性大多回升到與對照組差異不顯著的水平,暴露9d時EVR1%處理組的GPχ活性(13.58U/mg 蛋白質)甚至比同期的對照組(11.46U/mg 蛋白質)增加18.50%,即受到明顯誘導;但是,當暴露時間繼續延長時,所有處理組的GPχ活性又受到顯著抑制,其中,以 EVR5%的處理組降幅最大(暴露 12d、15d時分別為52.39%和34.29%).
GPχ能夠通過催化還原型谷胱甘肽(GSH)與H2O2或氫過氧化物反應(ROOH+2GSH→ROH+ H2O+GSSG),有效阻止自由基引起的氧化損傷,而 GSH 自身被氧化為氧化型谷胱甘肽(GSSG)[25].可見,其與 CAT具有相似的抗氧化功能,即具有共同的催化底物.圖3的結果顯示,尾水-海水混合體系培養初期和后期,各處理組的文蛤內臟GPχ活性均普遍受到抑制,且以后期受到的抑制程度較高,雖然暴露中期(第6d和第9d)的GPχ活性有所恢復,EVR1%處理組在第9d的GPχ活性甚至高于同期對照組,但是其在培養結束時均顯著低于對照組.化學污染物對海洋動物 GPχ活性的抑制作用常見于國內外室內和現場調查的文獻中.Richardson等[18]分別采用含PAHs、有機氯農藥的海水培養翡翠貽貝4周,發現鰓GPχ活性與軟組織中芘、螢蒽(P<0.001)、蒽、苯并芘(P<0.01)、六六六、狄氏劑、p,p’-DDT(P<0.05)等污染物含量之間均存在顯著負相關性.孟范平等(2011)[20]綜合國內外暴露于海水重金屬后雙殼類抗氧化酶響應的研究結果認為,重金屬離子(Cu2+、Pb2+、Hg2+)的單一暴露一般會抑制雙殼類鰓和消化腺中GPχ活性.Rocher等[26]對法國塞納河口及塞納灣不同站位的采樣分析表明,斑馬貽貝(Dreissena polymorpha)和紫貽貝(Mytilus edulis)的鰓 GPχ活性與軟組織中重金屬總含量呈顯著負相關(r= -0.73,P<0.05).另外,本研究將圖2、圖3中5個暴露時刻(不含零時刻)測定的25個活性數值進行相關性分析發現,CAT和GPχ活性之間存在顯著正相關性(r=0.558,P<0.01),表明尾水暴露過程中,兩者活性的變化具有一定同步性.暴露初期尾水對兩種酶的抑制效應可能是因為剛接觸尾水不久,文蛤對進入體內的污染成分難以適應所致;后期的抑制效應則是因為較長時間的尾水暴露后,有機、無機污染成分在體內蓄積而產生過多 H2O2或氫過氧化物等活性氧,攻擊酶分子而引起兩種抗氧化酶的活性降低,此時的內臟已處于一定的氧化逆境狀態.
2.4 尾水-海水混合暴露對文蛤內臟GR活性的影響
由圖4可見,暴露培養之前的文蛤谷胱甘肽還原酶(GR)活性為13.17U/g蛋白質,實驗期間對照組的GR活性基本穩定在13.28~15.00U/g蛋白質之間.暴露3d時,EVR 1%的處理組GR活性受尾水作用而顯著提升,比同期對照組增加81.47% (P<0.05),但是EVR 5%、10%的尾水處理未顯著影響到GR活性(P>0.05),EVR 20%的尾水處理則使GR活性降為8.49U/g 蛋白質.暴露6d時,除了EVR 20%處理組的GR活性(3.56U/g 蛋白質)仍受到較大抑制外,其余處理組的 GR活性均出現上揚,增幅在31.54%~80.91%.暴露9d后,多數處理組的GR活性受到一定程度抑制,其中,EVR20%的處理組活性下降幅度最大,第9,12,15d時的GR活性分別比同期的對照組下降69.72%、47.97%和61.25%.

圖4 暴露于不同體積比尾水0, 3, 6, 9, 12, 15d的文蛤內臟GR活性變化Fig.4 Variation of GR activities in the viscera of mussels exposed to serial dilutions of STP effluent on days 0, 3, 6, 9, 12and 15
GR能夠將GSSG再生為GSH,以保持氧化逆境下適宜的GSH/GSSG比值,維持細胞內一定的-SH水平,因此,逆境條件下GR的誘導十分重要,其活性已應用于某些海域現場監測評價中,被認為是一種較為可靠的氧化逆境標志物[27].本研究中,當EVR達到20%時,無論暴露時間長短,GR活性均受到抑制.在其他處理組中,GR活性在尾水暴露初期(3d和 6d)多受到誘導(少數與同期對照組差異不大),而暴露后期的大多數處理組中則觀察到內臟GR活性顯著降低(P<0.05),只有少數處理組的活性與同期對照組差異不顯著.因此認為,文蛤內臟GR對EVR≤10%的尾水的響應符合“拋物線型”的時間效應特征,但是在劑量效應上,這種響應特征僅見于暴露初期(第3d和第6d).低濃度污染物或暴露初期對雙殼類動物GR活性的刺激性,已在室內研究[28]和現場調查[29-31]中得到證實.暴露初期文蛤內臟中較高的 GR活性,反映了GSSG向 GSH的快速轉化,有助于維持機體內GSH含量穩定.而高劑量污染物(或高EVR尾水)以及暴露后期的GR活性受抑,則意味著細胞正常代謝所需的 GSH/GSSG比例難以維持,導致GSSG積累,使文蛤內臟細胞處于氧化脅迫狀態.
3 結論
3.1 SOD活性隨尾水暴露時間延長基本表現為“拋物線型”的響應特征.EVR10%、20%的尾水暴露6~12d期間,SOD活性均受到誘導,最大增幅為15.88%.
3.2 CAT和GPχ對尾水的主要響應特征是抑制效應,分別在暴露9d、12d時最為明顯,最大抑制率分別為64.38%和52.39%.
3.3 EVR20%的尾水能夠持續抑制 GR活性.EVR≤10%的處理組中,GR對尾水基本表現為“拋物線型”的時間效應特征,而同樣形式的劑量效應只出現在暴露初期.GR活性的最大誘導出現在暴露3d和6d時,分別比對照組上升81.47%和80.91%.
[1] Fernandez B, Albentosa M. Integrated assessment of water quality of the Costa da Morte (Galicia, NW Spain)by means of mussel chemical, biochemical and physiological parameters[J]. Ecotoxicology, 2010,19:735-750.
[2] Vethaak A D, Lahr J, Schrap M, et al. An integrated assessment of estrogenic contamination and biological effects in the aquatic environment of the Netherlands [J]. Chemosphere, 2005,59:511-524.
[3] Li X M, Zhang Q H, Dai J V. Pesticide contamination profiles of water, sediment and aquatic organisms in the effluent of Gaobeidian wastewater treatment plant [J]. Chemosphere, 2008, 72:1145-1151.
[4] Watkinson A J, Murby E J, Kolpin D W. The occurrence of antibiotics in an urban watershed: From wastewater to drinking water [J]. Sci. Total Environ., 2009,407:2711-2723.
[5] Bolong N, Ismail A F, Salim M R. A review of the effects of emerging contaminants in wastewater and options for their removal [J]. Desalination, 2009,239:229-246.
[6] 王麗平,鄭炳輝,孟 偉.環境污染物對水生生物產生氧化壓力的分子生物標志物 [J]. 生態學報, 2007,27(1):380-388.
[7] Di Giulio R T, Washburn P C, Wenning R J, et al. Biochemical responses in aquatic animals: a review of determinants of oxidative stress [J]. Environ. Toxicology and Chemistry, 1989,8:1103-1123.
[8] Letendre J, Chouquet B, Manduzio H, et al. Tidal height influences the levels of enzymatic antioxidant defences in Mytilus edulis [J]. Marine Environmental Research, 2009,67:69-74.
[9] Zhi-Hua L, Vladimir Z, Jan T. Evaluating environmental impact of STPs situated on streams in the Czech Republic: An integrated approach to biomonitoring the aquatic environment [J]. Water Research, 2011,45:1403-1413.
[10] Steven B, Christopher H, Benat Z. Integrated biomarker assessment of the effects exerted by treated produced water from an onshore natural gas processing in the North Sea on the mussel Mytilus edulis [J]. Marine Pollution Bulletin, 2011,62:327-339.
[11] Tang B J, Liu B Z, Yang H S, et al. Oxygen consumption and ammonia-N excretion of Meretrix meretrix in different temperature and salinity [J]. Chinese Journal of Oceanology and Limnology, 2005,23(4):469-474.
[12] 高 鷹.海水銅鉛及環境因子對菲律賓蛤仔生物標志物的影響研究 [D]. 青島:中國海洋大學, 2011,22-23.
[13] Watkinson A J, Murby E J, Kolpin D W, et al. The occurrence of antibiotics in an urban watershed: From wastewater to drinking water [J]. Sci. Total Environ., 2009,407: 2711-2723.
[14] Bolong N, Ismail A F, Salim M R, et al. A review of the effects of emerging contaminants in wastewater and options for their removal [J]. Desalination, 2009,239:229-246.
[15] 高永剛,李正炎.壬基酚對櫛孔扇貝組織抗氧化酶活性的影響[J]. 中國海洋大學學報, 2006,36(S):135-138.
[16] Chen F, Gao J, Zhou Q. Toxicity assessment of simulated urban runoff containing polycyclic musks and cadmium in Carassius auratus using oxidative stress biomarkers [J]. Environmental Pollution, 2012,162:91-97.
[17] Gagne F, Blaise C, Andre C. Occurrence of pharmaceutical products in a municipal effluent and toxicity to rainbow trout (Oncorhynchus mykiss) hepatocytes [J]. Ecotoxicology and Environmental Safety, 2006,64:329-336.
[18] Richardson B J, Mak E, Luca-Abbot S B De, et al. Antioxidant responses to polycyclic aromatic hydrocarbons and organochlorine pesticides in green-lipped mussels (Perna viridis): Do mussels“integrate” biomarker responses? [J]. Marine Pollution Bulletin, 2008,57:503-514.
[19] Manduzio H, Monsinjon T, Rocher B, et al. Characterization of an inducible isoform of the Cu/Zn superoxide dismutase in the mussel Mytilus edulis [J]. Aquatic Toxicology, 2003,6(64):73-83.
[20] 孟范平,高 鷹,趙順順,等.雙殼類分子生物標志物對海水重金屬的響應評述 [J]. 中國海洋大學學報, 2011,41(5):100-109.
[21] Cossu C, Doyotte A, Jacquin M C, et al. Glutathione reductase, selenium-dependent glutathione peroxidase, glutathione levels, and lipid peroxidation in freshwater bivalves, Unio tumidus, as biomarkers of aquatic contamination in field studies [J]. Ecotoxicology and Environmental Safety, 1997,28:122-131.
[22] Regoli F, Gorbi S, Frenzilli G, et al. Oxidative stress in ecotoxicology: from the analysis of individual antioxidants to a more integrated approach [J]. Marine Environment Research, 2002,54:419-423.
[23] 趙元鳳,呂景才,宋曉陽.海洋污染對毛蚶過氧化氫酶影響研究[J]. 環境科學學報, 2002,22(4):534-536.
[24] 王 凡,趙元鳳,呂景才,等.銅污染對扇貝內臟團抗氧化酶活性的影響 [J]. 水產科學, 2008,27(12):622-624.
[25] Regoli F, Principato G. Glutathione, glutathione-dependent and antioxidant enzymes in mussel, Mytilus galloprovincialis, exposed to metals under field and laboratory conditions: implications for the use of biochemical biomarkers [J]. Aquatic Toxicology, 1995,31:143-164. [26] Rocher B, Goff J L, Peluhet L, et al. Genotoxicant accumulation and cellular defence activation in bivalves chronically exposed to waterborne contaminants from the Seine River [J]. Aquatic Toxicology, 2006,79:65-77.
[27] Meyer J N, Smith J D, Winston G W, et al. Antioxidant defenses in killifish (Fundulus heteroclitus) exposed to contaminated sediments and model prooxidants: short-term and heritable responses [J]. Aquatic Toxicology. 2003,65(4):377-395.
[28] Verlecar X N, Jena K B, Chainy G B N. Modulation of antioxidant defences in digestive gland of Perna viridis (L.), on mercury exposures [J]. Chemosphere, 2008,71:1977-1985.
[29] Torres M A, Testa C P, Gaspari C. Oxidative stress in the mussel Mytella guyanensis from polluted mangroves on Santa Catarina Island, Brazil [J]. Marine Pollution Bulletin, 2002,44:923-932.
[30] Porte C, Biosca X, Sole M, et al. The integrated use of chemical analysis, cytochrome P450 and stress proteins in mussels to assess pollution along the Galician coast (NW Spain) [J]. Environmental Pollution, 2001,112:261-268.
[31] Cheung C C C, Zheng G J, Li A M Y, et al. Relationships between tissue concentrations of polycyclic aromatic hydrocarbons and antioxidative responses of marine mussels, Perna viridis [J]. Aquatic Toxicology, 2001,52:189-203.
Responses of the antioxidant enzymes in Meretriχ meretriχ exposed to effluent from municipal sewage treatment
plants for short-term.
SU En-ping, MENG Fan-ping*, SUN Ting, FU Wen-chao, WANG Qun, LI Yong-fu, HU Heng
(Key Laboratory of Marine Environment and Ecology, Ocean University of China, Ministry of Education, Qingdao 266100, China). China Environmental Science, 2014,34(2):511~517
In order to investigate if effluent from municipal sewage treatment plants (STPs) cause oxidative stress in marine organisms, Meretriχ meretriχ were exposed to effluent from the Licunhe STP in Qingdao City at various concentrations (0%, 1%, 5%, 10% and 20% V/V), diluted in seawater, for 15days. Antioxidant enzymes analyzed in the viscera of mussels were superoxide dismutase (SOD), catalase (CAT), glutathione peroxidase (GPχ) and glutathione reductase (GR). Results showed that the variation trend of SOD activities with exposure time exhibited a parabolic curve shape with a maximal increment of 15.88%, which was induced from day 6 to day 12 in both exposure groups (10% and 20% effluent). Both CAT and GPχ were inhibited by the effluent with the highest inhibition 64.38% and 52.39%, at the day 9 and day 12, respectively. At higher effluent concentration (20%), GR activity was inhibited constantly during the exposure period. However, GR activities responded in a parabolic curve shape in other exposure groups where an initial increase was observed at day 3 or day 6 followed by a significant decrease after day 9, and the highest increment were 81.47% and 80.91%, at day 3 and day 6, respectively. Current experimental results suggest that STPs do not have the capacity to biodegrade harmful chemicals sufficiently to prevent toxic action of effluent, and SOD, CAT, GPχ and GR activities in viscera of M. meretriχ are sensitive indicators of oxidative stress induced by effluent.
municipal sewage treatment plants (STPs);effluent;Meretriχ meretriχ;antioxidant enzymes
X835
:A
:1000-6923(2014)02-0511-07
蘇恩萍(1990-),女,山東招遠人,中國海洋大學碩士研究生,主要從事環境生物監測技術研究.
2013-06-21
國家自然科學基金項目(41240040)
* 責任作者, 教授, fanpingm@tom.com

