定量壓制對大青葉煎煮質量的影響
朱 聰,宋 英*,王聰穎,郭志青
(1.成都中醫藥大學附屬醫院,四川 成都 610072;2.成都中醫藥大學 藥學院,四川 成都 610075)
?
定量壓制對大青葉煎煮質量的影響
朱 聰1,宋 英1*,王聰穎2,郭志青1
(1.成都中醫藥大學附屬醫院,四川 成都 610072;2.成都中醫藥大學 藥學院,四川 成都 610075)
目的:通過對大青葉壓制飲片和普通飲片的煎煮,觀察定量壓制是否影響大青葉的煎煮質量。方法:分別對大青葉壓制飲片和傳統飲片進行單味煎煮和在復方中煎煮,以靛玉紅含量及干膏率為評價指標。結果:壓制中藥飲片水煎液中靛玉紅含量及干膏收率與傳統飲片無明顯差異。結論:壓制并不影響大青葉飲片的煎煮效果。
大青葉壓制飲片;傳統飲片;靛玉紅;干膏率
大青葉為常用清熱解毒中藥,來源于十字花科植物菘藍isatisindigoticafort的干燥葉[1],具有清熱解毒、涼血消斑的功能,主要用于治療溫邪入營、高熱神昏、發斑發疹、黃疸、熱痢、痄腮、喉痹、丹毒、癰腫等癥[2]。其主要有效成分為吲哚類生物堿: 靛藍( indigotin) 、靛玉紅( indirubin) ,《中國藥典》2010 版以靛玉紅作為大青葉藥材的質量控制指標[3],并且靛玉紅是傳統的治療白血病的藥物[4]。
大青葉密度小、流動性差,不利于小包裝飲片的定量分裝和藥房的調劑。
壓制飲片是一種新的專利技術,其采用物理壓縮法,將飲片制成一定形狀, 用一定的包裝材料封裝,由配方藥師直接調配而無需稱量,是一種新型飲片[5]。同時解決了花類、全草類、葉類及部分質輕或不規則飲片,因密度小、流動性差、體積大而增加飲片生產、包裝、貯藏、運輸、調劑等環節中存在困難[6]。本實驗旨在研究定量壓制會不會對大青葉的煎煮質量造成影響,從而為大青葉壓制飲片的質量標準提供參考。
1 儀器與試藥
1.1 試驗儀器
島津LC 20A液相色譜儀,浙大智達N2000色譜工作站;BP211D分析天平(十萬分之一型,德國賽多利斯公司);101A-3干燥箱(上海市實驗儀器總廠);永欣TW-2000W可調溫電爐(郫縣永結電器總廠)。
1.2 試藥
大青葉傳統飲片(批號:120319,四川省中藥飲片有限公司);大青葉壓制中藥飲片(批號:120319,四川省中藥飲片有限公司);靛玉紅對照品(批號110717-200204,中國食品藥品生物制品檢定研究院);甲醇為色譜純,水為重蒸餾水,其它試劑均為分析純。
2 方法與結果
2.1 含量測定[7-9]
2.1.1 色譜條件 色譜柱為 Comatex C18(250mm×4.6mm,5μm);流動相:甲醇—水為75∶25(體積分數);流速:1μL/min ;檢測波長:289nm,柱溫:30℃;進樣量:20μL。理論塔板數按靛玉紅計應不低于4 000。
2.1.2 對照品溶液制備 精密稱取靛玉紅1.62mg,置50mL量瓶中,加甲醇至刻度,搖勻,精密吸取2mL,置10mL量瓶中,加甲醇至刻度,搖勻,即得(6.48μg/μL)。
2.1.3 供試品溶液制備 取本品細粉0.25g,精密稱定,置索氏提取器中,加三氯甲烷,浸泡15h,加熱回流提取至提取液無色。回收溶劑至干,殘渣加甲醇使溶解并轉移至100μL量瓶中,加甲醇至刻度,搖勻,濾過,取續濾液,即得。
2.1.4 專屬性試驗 按“2.1.1”項色譜條件,精密吸取對照品溶液、供試品溶液和陰性供試品溶液各20μL,注入液相色譜儀,結果供試品中靛玉紅色譜峰與相鄰色譜峰分離度>1.5,理論塔板數按靛玉紅峰計算不低于4 000,陰性無干擾。見圖1。
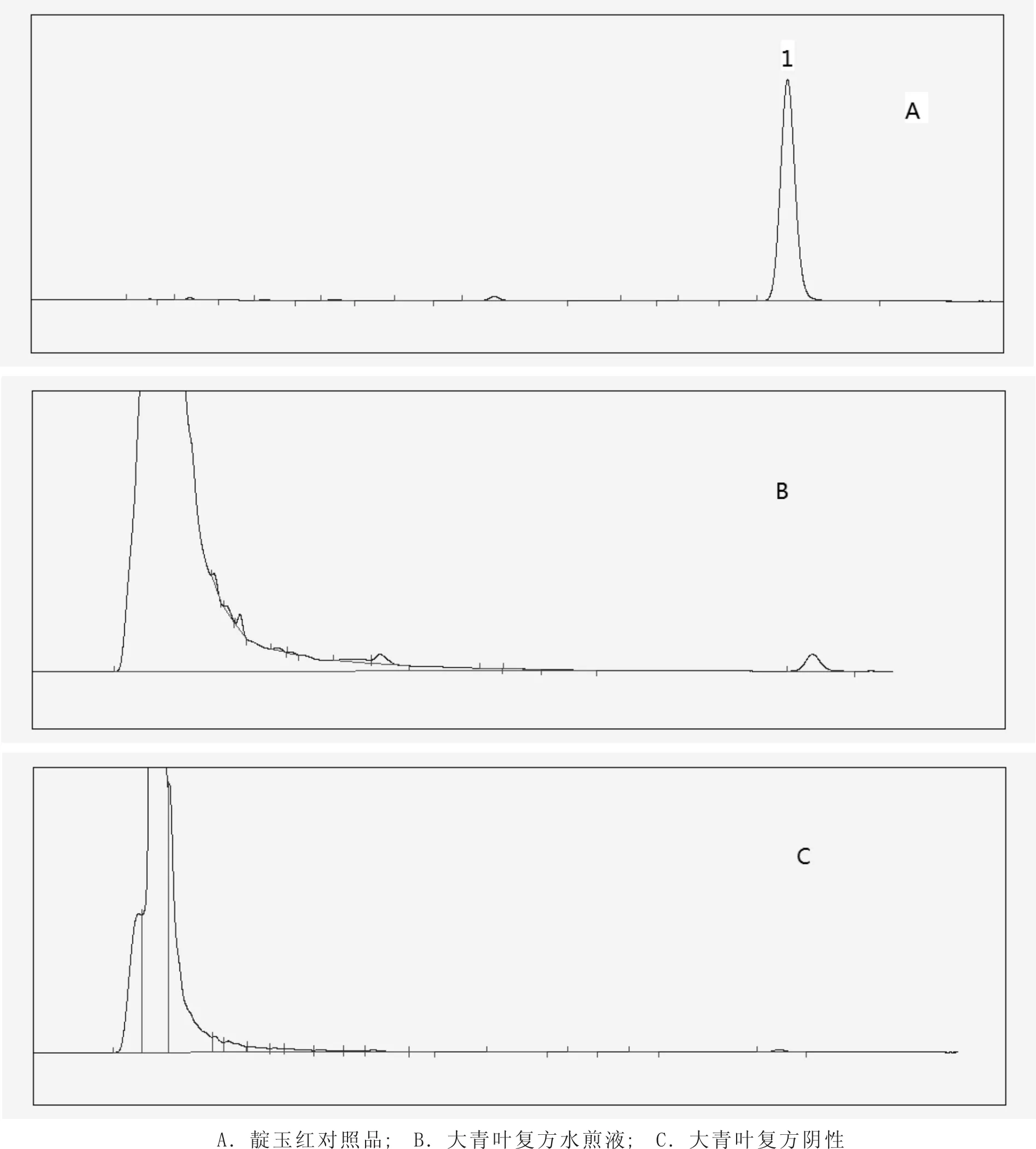
圖1 靛玉紅對照品、供試品和陰性樣品的HPLC圖譜
2.1.5 精密度試驗 按照“2.1.1”項色譜條件,精密吸取靛玉紅對照品溶液20μL,注入液相色譜儀,連續進樣6次,記錄靛玉紅色譜峰峰面積,結果顯示,靛玉紅對照品峰面積均值為23 475.2,RSD為1.57%,表明精密度良好。
2.1.6 穩定性試驗 按照“2.1.1”項色譜條件,精密吸取供試品溶液20μL,分別于0h、2h、4h、6h、8h、10h,注入液相色譜儀,記錄峰面積,計算含量,結果顯示,靛玉紅峰面積均值為660.7,RSD為2.58%,表明供試品溶液在10h內穩定性較好。
2.1.7 重復性試驗 按“2.1.3”項下方法,分別制備供試品溶液6份,按照“2.1.1”項色譜條件,注入液相色譜儀,記錄靛玉紅色譜峰峰面積,計算供試品中靛玉紅含量,結果顯示,樣品中靛玉紅含量均值為47.990 7μg/μL,RSD為2.26%,表明試驗重復性較好。
2.1.8 加樣回收率試驗 精密稱取已知含量的樣品制備溶液0.5μL(479.907 2μg/μL)共6份,分別精密加入靛玉紅對照品溶液(0.143 2mg/μL)2μL,按供試品制備方法及色譜條件,測定含量,計算回收率。
回收率
經計算靛玉紅的加樣回收率平均值為98.76%,加樣回收率在95%~105%之間,RSD=2.08%,表明該方法的加樣回收率良好。
2.1.9 標準曲線制備 分別精密吸取靛玉紅對照品溶液(6.48μg/μL)1mL置50mL量瓶中,1mL、2mL、5mL置25mL量瓶中,分別加甲醇至刻度,搖勻,即得標準曲線對照品溶液。按照上述色譜條件,分別精密吸取20μL,注入液相色譜儀,記錄峰面積,結果見表1。以峰面積(Y)對進樣量(X)進行回歸分析,計算回歸方程,并以峰面積為縱坐標,對照品含量(μg)為橫坐標,繪制標準曲線,標準曲線見圖2。
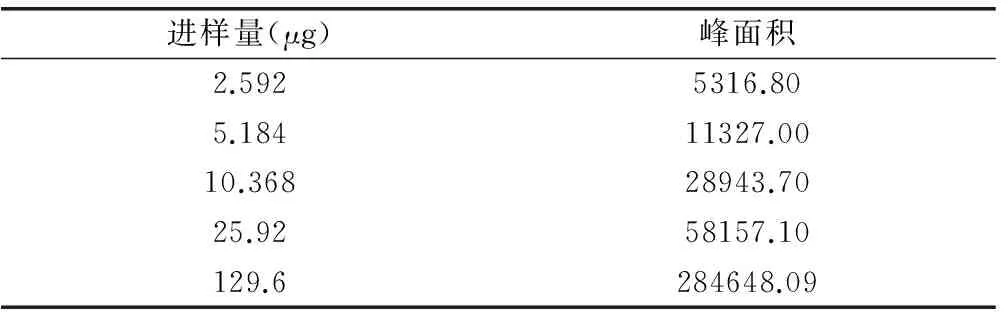
表1 靛玉紅線性范圍考察
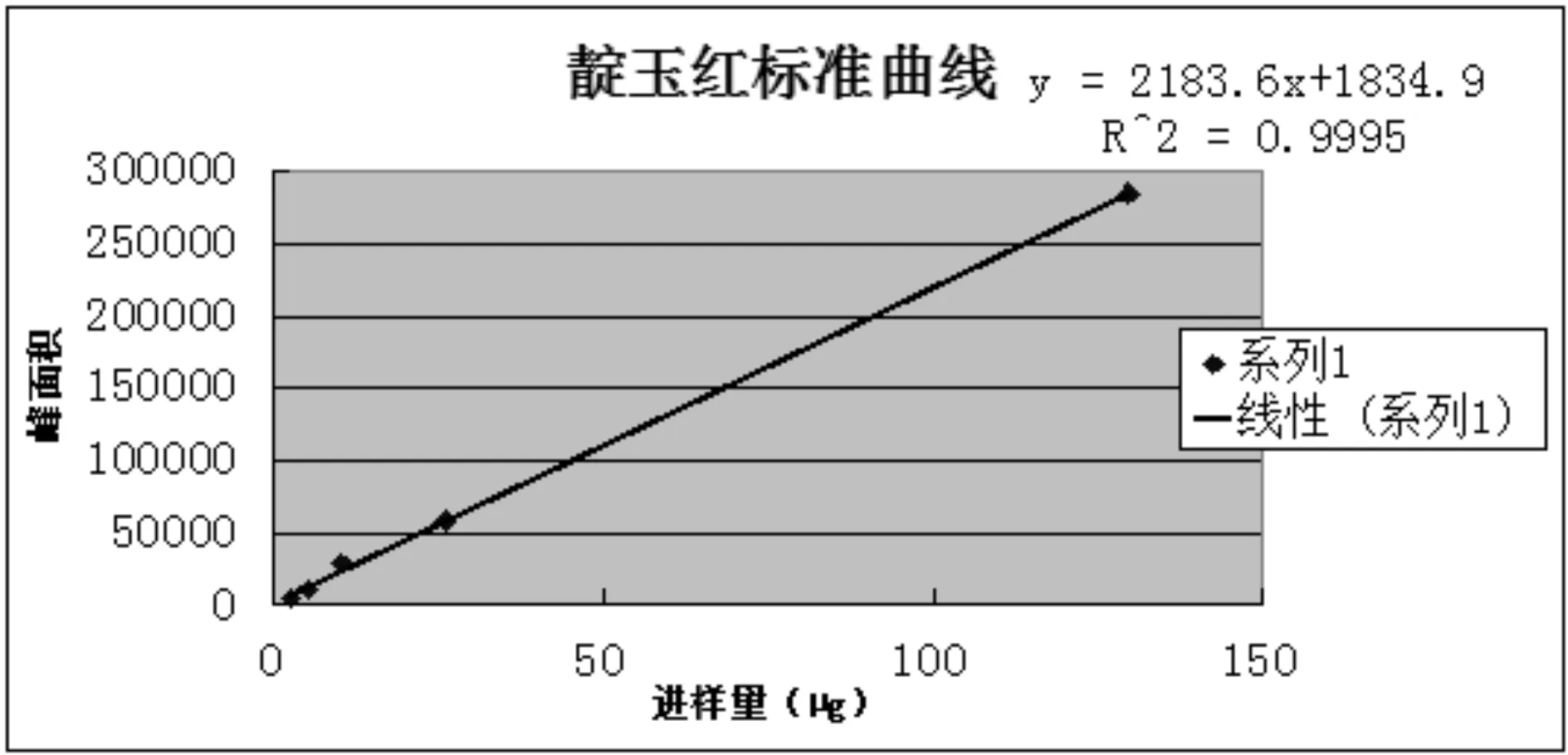
圖2 靛玉紅標準曲線
經計算,得線性回歸方程Y=2 183.6X+1 834.9,R=0.999 8,結果表明,進樣量在2.592~129.6μg范圍內,靛玉紅進樣量與峰面積呈良好線性關系。
2.2 大青葉定量壓制樣品與傳統飲片單味煎煮比較
2.2.1 靛玉紅含量測定 分別稱取大青葉傳統飲片600g和壓制飲片600g各6份,其中各取3份分別加15倍量水,浸泡30min,第1次煎煮保持微沸15min,第2次煎煮保持沸騰10min,濾過,濾液濃縮并定容至7 000mL,作為傳統煎煮組;另外各3份分別加水8 000mL,浸泡30min,煎煮15min,濾過,藥液定容至7 000mL,作為機器煎煮組。精密吸取上述各樣品溶液5mL,置10mL量瓶中,加甲醇至刻度,搖勻,經微孔濾膜(0.45μm)濾過,取續濾液作為供試品溶液。精密吸取供試液20μL,注入液相色譜儀,計算靛玉紅含量,結果見表2。
2.2.2 干膏收率測定 精密吸取樣品溶液25mL,置已恒重的蒸發皿中,在水浴上蒸干后,于105℃干燥3h,置干燥器中冷卻30min,迅速精密稱定重量,試驗結果見表2。
2.2.3 結果 大青葉壓制中藥飲片單味水煎液中靛玉紅含量略高于傳統飲片單味水煎液,干膏收率基本一致。
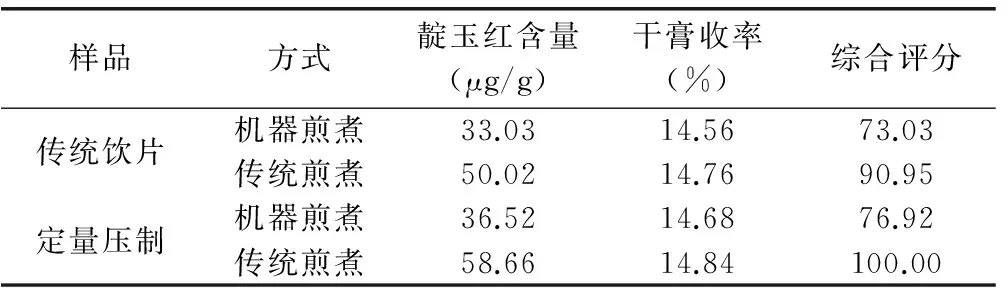
表2 單味煎煮比較結果
注:靛玉紅含量及干膏收率權重系數分別為0.6、0.4。
2.3 大青葉壓制飲片和傳統飲片在復方中煎煮比較
2.3.1 靛玉紅含量測定 按照處方比例分別稱取大青葉600g、升麻400g、玄參400g、知母400g、麥冬400g、荷葉400g 6份和大青葉壓制飲片600g、升麻400g、玄參400g、知母400g、麥冬400g、荷葉400g 6份,其中各取3份分別加15倍量水,浸泡30min,第1次煎煮保持微沸15min,第2次煎煮保持沸騰10min,濾過,濾液濃縮并定容至7 000mL,作為傳統煎煮組;另外各三組分別加水10 000mL,浸泡30min,煎煮15min,濾過,藥液定容至7 000mL,作為機器煎煮組。
另按處方比例稱取除大青葉外藥材共100g,按照上述方法制備缺大青葉陰性樣品溶液。
精密吸取上述樣品溶液1μL,置10μL量瓶中,加甲醇至刻度,搖勻,經微孔濾膜(0.45μm)濾過,取續濾液作為供試品溶液。精密吸取供試液20μL,注入液相色譜儀,計算靛玉紅含量,結果見表3。
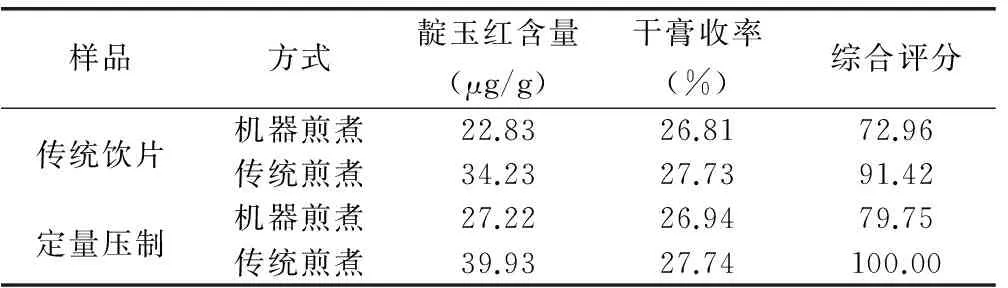
表3 復方煎煮比較結果
注:靛玉紅含量及干膏收率權重系數分別為0.6、0.4。
2.3.2 干膏收率測定 精密吸取樣品溶液25μL,置已恒重的蒸發皿中,在水浴上蒸干后,于105℃干燥3h,置干燥器中冷卻30min,迅速精密稱定重量,試驗結果見表3。
2.3.3 結果 大青葉壓制中藥飲片復方水煎液中靛玉紅含量略高于未壓制飲片,干膏收率基本一致。
2.4 溶出曲線比較[10-11]
2.4.1 不同時間點靛玉紅含量測定 ①傳統飲片樣品溶液制備。分別稱取大青葉傳統飲片200g,加水2 000mL(補加吸水量),浸泡30min,分別于煎煮5min,10min,15min,20min,30min,40min,50min,60min取樣100mL,并補充水體積,藥液濾過,備用。②定量壓制樣品溶液制備。分別稱取定量壓制樣品200g,按上述方法同法制備定量壓制樣品溶液。

圖3 靛玉紅溶出曲線
精密吸取上述樣品溶液10mL,置25mL量瓶中,加甲醇至刻度,搖勻,經微孔濾膜(0.45μm)濾過,取續濾液作為供試品溶液。精密吸取供試液20μL,注入液相色譜儀,計算靛玉紅含量,結果見表4(圖3)。
2.4.2 不同時間點干膏收率測定 精密吸取煎煮不同時間點樣品溶液各25μL,置已恒重的蒸發皿中,在水浴上蒸干后,于105℃干燥3h,置干燥器中冷卻30min,迅速精密稱定重量,試驗結果見表4。
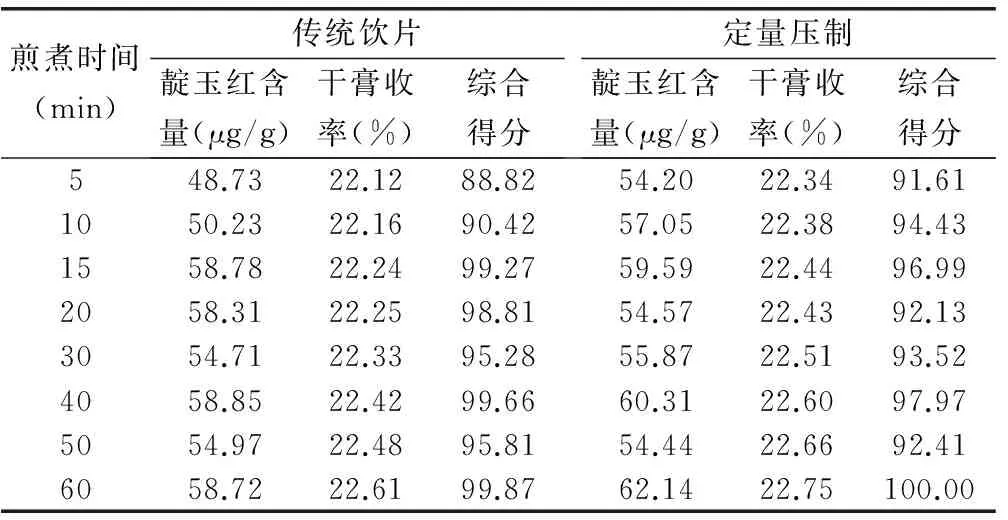
表4 溶出曲線結果
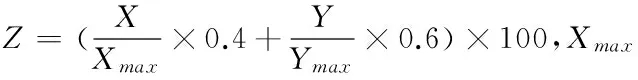
3 結論
以上大青葉傳統飲片與壓制中藥飲片的溶出曲線、單味煎煮、復方煎煮比較結果表明,在大青葉壓制中藥飲片崩散完全情況下,壓制中藥飲片水煎液中靛玉紅含量略高于傳統飲片,但無統計學差異,干膏收率與傳統飲片無明顯差異,壓制并不影響大青葉飲片的煎煮效果。且從靛玉紅前15min的溶出曲線看,由于壓制樣品不會像傳統樣品一樣漂浮在水面,故其溶出速度更快。
[1] 國家藥典委員會. 中國藥典(一部) [M] .北京:中國醫藥出版社,2010:20-21.
[2] 喇鳳英,胡浩彬.大青葉藥材及其飲片的質量分析研究[J].治法方藥,2009,41(8):59.
[3] 鄭雪花.大青葉的化學成分與藥理作用[J].懷化學院學報,2007,26(5):55-57
[4] 夏小艷,劉可春,王思鋒,等.大青葉中靛玉紅的抗血管生成活性研究[J].中國藥學雜志,2010,45(3):187-189.
[5] 盛蓉,宋英,管娜,等.菊花小包裝飲片的壓制工藝研究[J].中成藥,2013,35(4):852-855.
[6] 卜訓生.小包裝中藥飲片調劑的優勢及存在問題[J].北京中醫藥,2008,27(7)i554.
[7] 王虹霞,梁劍平,李雪虎,等.HPLC法測定大青葉中靛玉紅的含量[J].湖南農業科學,2012(3):87-89.
[8] 阮洪生,曹玲.大青葉不同生長時期靛玉紅含量動態變化研究[J].安徽農業科學,2010,38(5):2328-2329.
[9] 國家藥典委員會. 中國藥典(一部) [M] .北京:中國醫藥出版社,2010:21.
[10] 謝沐風.溶出曲線相似性的評價方法[J].中國醫藥工業雜志,2009,40(4):308.
[11] 王昕,唐素芳,高立勤.溶出曲線相似性的兩種評價方法[J].天津藥學,2011,23(1):53.
(責任編輯:宋勇剛)
The Press Forming’s Affects to the Decoction Quality of Folium Isatidis
Zhu Cong1,Song Ying1*,Wang Congying2,Guo Zhiqing1
(1.The Affiliated Hospital of Chengdu University of Traditional Chinese Medicine,Chengdu 610072,China;2.Pharmacy College,Chengdu University of Traditional Chinese Medicine,Chengdu 610075,China)
Objective:To observe whether the press forming affects the decoction quality of Folium Isatidis by contrast the decoction of compressed pieces and ordinary pieces.Methods:Evaluating the content of indirubin and dry extract yielding rate of compressed pieces and ordinary pieces respectively. Results:No obvious difference of indirubin content nor dry extract yielding rate was found in the decoction between compressed pieces and ordinary pieces. Conclusion:Press forming does not affect the decoction quality of Folium Isatidis pieces.
Folium Isatidis Compressed Pieces;Ordinary Pieces;Indirubin;Dry Extract Yielding Rate
2014-07-02
四川省科技計劃項目(2011SZ0311)
朱聰(1988-),男,成都中醫藥大學附屬醫院中藥師,研究方向為中藥制劑。
通訊簡介:宋英(1959-),男,碩士,成都中醫藥大學附屬醫院主任藥師,研究方向為中藥炮制與制劑。
R284.2
A
1673-2197(2014)21-0014-03

