氟吡菌胺對斑馬魚的毒性效應
林 琎,王紅艷,王開運*,范維娣,許 輝,劉 杰(1.山東農(nóng)業(yè)大學植物保護學院,山東 泰安71018;.山東農(nóng)業(yè)大學農(nóng)藥環(huán)境毒理研究中心,山東 泰安 71018;.山東棉花研究中心,山東 濟南 50100;.山東省聯(lián)合農(nóng)藥工業(yè)有限公司,山東 濟南 50100)
氟吡菌胺對斑馬魚的毒性效應
林 琎1,2,王紅艷3,王開運1,2*,范維娣2,許 輝4,劉 杰4(1.山東農(nóng)業(yè)大學植物保護學院,山東 泰安271018;2.山東農(nóng)業(yè)大學農(nóng)藥環(huán)境毒理研究中心,山東 泰安 271018;3.山東棉花研究中心,山東 濟南 250100;4.山東省聯(lián)合農(nóng)藥工業(yè)有限公司,山東 濟南 250100)
采用斑馬魚胚胎發(fā)育技術和傳統(tǒng)毒理學方法, 研究了氟吡菌胺對斑馬魚胚胎、成魚及仔魚的毒性效應.結果發(fā)現(xiàn),氟吡菌胺對3個階段斑馬魚均具有致死能力,對仔魚LC50(48h)值為0.204mg/L,成魚LC50(96h)為0.286mg/L,幼魚LC50(96h)為1.489mg/L.研究表明,0.0596mg/L以上濃度的氟吡菌胺對斑馬魚胚胎均有一定程度的致死效應,高濃度處理組胚胎出現(xiàn)心包囊腫、卵黃囊不吸收、黑色素沉積少及魚體彎曲等癥狀;氟吡菌胺對斑馬魚成魚進行14d暴露后,處理組成魚體重下降,產(chǎn)卵量減少,有效卵量降低; 0.0298mg/L處理組144h子代仔魚存活率雖然比較高,但存活魚大部分出現(xiàn)心包囊腫、體彎曲等畸形.上述結果說明,水體中殘留的氟吡菌胺對于斑馬魚各生命階段的生長發(fā)育均具有潛在的危害.
氟吡菌胺;斑馬魚;胚胎;成魚;急性毒性
氟吡菌胺(fluopicolide)化學名稱為 2,6-二氯-N-[(3-氯-5-三氟甲基-2-吡啶基)甲基]苯甲酰胺[1],是德國拜耳公司開發(fā)的一種新型苯甲酰胺類內吸性殺菌劑,對各種作物的霜霉病、晚疫病、疫病等均有良好的防治效果,其主要作用于細胞膜和細胞間的特異性蛋白,對病原菌的各主要形態(tài)均有很好的抑制活性[2-3].拜耳公司用氟吡菌胺和強內吸傳導性殺菌劑霜霉威鹽酸鹽復配成商品制劑銀法利,因其見效快和耐雨水沖刷的特點贏得許多農(nóng)民的喜愛,自2006年在中國上市以來,在番茄、辣椒、馬鈴薯、西瓜、黃瓜、葡萄、煙草上均有使用報道[4-7].住友化學美國分公司生產(chǎn)的氟吡菌胺已經(jīng)登記用于水果、蔬菜和田間作物,以及草皮和觀賞植物等非作物使用.美國環(huán)保署也已經(jīng)對氟吡菌胺啟動公開審議,預計氟吡菌胺的審議在 2021年完成[8]. 氟吡菌胺對哺乳動物毒性為:大鼠急性經(jīng)口、經(jīng)皮 LD50> 5000mg/kg,對兔皮膚無刺激性,兔眼睛有輕度刺激性,豚鼠皮膚無致敏性,對兔、大鼠無潛在致畸性,對大鼠無致癌作用;氟吡菌胺對環(huán)境生物急性毒性為:山齒鶉急性經(jīng)口 LD50>2250mg/kg,鴨急性 經(jīng) 口 LD50>2250mg/kg,虹 鱒 魚 LC50= 0.36mg/L(96h),藍鰓太陽魚LC50=0.75mg/L(96h),大型溞 EC50>1.8mg/L(48h),水藻 EC50>4.3mg/L (72h), 蚯蚓 LC50>1000mg/kg(14d),蜜蜂觸殺LD50>100mg/只[9];綜上所述,氟吡菌胺對蜜蜂、鳥和水藻的急性毒性均為低毒,對大型溞為中毒,而對兩種魚的急性毒性則為高毒.目前,氟吡菌胺對水生生物的研究主要集中在急性毒性方面,其對魚類繁殖和生長發(fā)育的影響尚未見報道.本實驗采用EPA和國際OECD認可的測定單一化學物毒性實驗用魚——斑馬魚為試驗材料[10-12],觀察研究了氟吡菌胺對斑馬魚成魚、胚胎及仔魚生長發(fā)育的影響,以期為氟吡菌胺的水生生物毒理實驗研究及其安全使用提供參考.
1 材料與方法
1.1 儀器與試劑
BM2100數(shù)碼生物顯微鏡,PQX-330A-3H人工氣候箱,孵化器, 5L玻璃水族箱,曝氣裝置,微量移液槍.
96%氟吡菌胺(CAS號:239110-15-7)由山東農(nóng)業(yè)大學農(nóng)藥環(huán)境毒理研究中心提供,氟吡菌胺用寧乳-34和黃原膠助溶后,用超純水配制成1000mg/L儲備液備用,本實驗使用的助溶劑濃度不高于0.1mg/L,實驗用水為實驗室制備的超純水.
1.2 受試生物
野生型斑馬魚成魚和 3個月大的幼魚均購自泰安市于氏水族館.斑馬魚成魚雌魚抽檢體長為(4.32±0.026)cm,體重為(0.749±0.0491)g,雄魚抽 檢 體 長 (4.61±0.031)cm,體 重 為 (0.614± 0.0615)g,3個月大的幼魚抽檢體長為(2.08± 0.12)cm,體重為(0.060±0.012)g;斑馬魚成魚購入后雌雄分開飼養(yǎng)在超純水中,水中溶解氧大于5.8mg/L,用加熱棒和光照恒溫箱控制溫度為28℃,光周期為 14h:10h(晝/夜).每日早晚各喂食一次經(jīng)紫外消毒處理過的紅線蟲或孵化后的豐年蝦幼體,每次喂食5min后將剩余的餌料和糞便及時吸出,每日換水 1/3.繁殖前一天晚上將雌雄斑馬魚(雌雄斑馬魚數(shù)量比約為1:2)魚缸靠近,次日凌晨合缸,在魚缸底部放置隔離網(wǎng),以防斑馬魚自食其卵,給光讓其產(chǎn)卵受精.利用虹吸法收集魚卵,用超純水迅速清洗受精卵以除去其間混有的雜質和污物,剔除受損受精卵或未受精卵,選取卵裂期的受精卵供試.將清洗過的正常受精卵分為兩部分:一部分用作胚胎實驗;另一部分放在28℃人工氣候箱中孵化,待仔魚游泳平衡后用于仔魚暴露實驗.斑馬魚成魚和幼魚試驗前在實驗室內水簇箱中馴養(yǎng)至少 7d,溫度 24~28℃,試驗前1d不喂食.
1.3 試驗方法
1.3.1 三個階段斑馬魚急性毒性試驗 對斑馬魚成魚、3個月大幼魚的急性毒性試驗依據(jù)OECD203標準方法[13]進行,根據(jù)預實驗結果,分別設定試驗濃度,幼魚為 1.00,1.20,1.40,1.60, 1.80mg/L,成 魚 為 0.0596,0.121,0.246,0.499, 1.012mg/L,每個試驗濃度重復3次,在5L的燒杯中,放入4L的藥液和10條魚.對剛具有平衡能力的仔魚,其急性毒性試驗使用靜水法生物測試進行了稍加修改.試驗濃度為 0.120,0.150,0.188, 0.234,0.293mg/L,每個濃度重復3次,在100mL的燒杯中裝入50mL供試藥液和10條仔魚.
幼魚和成魚試驗持續(xù)暴露 96h,仔魚試驗暴露 48h,做最高濃度相應的溶劑對照和空白對照.試驗藥液每24h更新一次,以保持藥劑濃度.人工氣候培養(yǎng)箱中培養(yǎng)溫度為(28±1)℃;濕度:70%;光照周期:14h:10h.每24h觀察一次成魚和幼魚的行為反應,隨時記錄成魚和幼魚的死亡數(shù)和中毒癥狀,判斷死亡的標準是用玻璃棒碰觸其尾部無明顯運動.仔魚的中毒癥狀每24h用顯微鏡觀察一次,判斷死亡的標準是沒有心跳,在急性毒性試驗過程中,均不喂食,死亡個體立即清除.
1.3.2 胚胎體外直接染毒 按照 OECD212[14]方法,設計胚胎毒性試驗.在預實驗基礎上,設計了 9個測試濃度,分別為 0.0149,0.0298,0.0596, 0.149,0.298,0.350,0.595,1.012,1.720mg/L.胚胎受精后約1h轉移到盛有2mL試驗藥液的24孔板中,每孔加入一枚受精卵.以超純水作為空白對照,并設最高濃度相對應的溶劑對照.每個試驗濃度20枚卵.試驗藥液每24h更新一次,以保持氟吡菌胺的濃度.觀察 24h胚胎自主運動, 檢查 48h、72h、96h胚胎的心跳速率和72h孵化數(shù),120h仔魚體長.每24h通過顯微鏡觀察胚胎形態(tài)并拍照. 1.3.3 成魚短期重復濃度試驗 根據(jù) OECD204準則[15],稍作修改,進行成魚短期重復濃度試驗,即連續(xù)14d進行氟吡菌胺暴露試驗,其染毒濃度為 0.0149,0.0298,0.0596,0.149,0.298mg/L,為減少加藥過程對斑馬魚的影響,采用靜態(tài)方式染毒.并設空白對照和最高濃度的溶劑對照.試驗用成年斑馬魚隨機分組,將10條雌魚和10條雄魚分別稱重后放入5個不同濃度藥劑,染毒14d,染毒期間每天早晚各喂食1次;染毒結束后,將剩余存活親魚稱重后,將1條雌魚和1條雄魚轉入盛有5L清水的孵化器中,孵化器底部有紗網(wǎng)隔離,給光刺激每一對單獨產(chǎn)卵,產(chǎn)卵結束后取出親魚,檢查每對親魚的產(chǎn)卵量,24h檢查無效卵量,72h檢查孵化數(shù), 144h檢查子代斑馬魚的存活數(shù)和畸形數(shù).
1.4 試驗濃度檢測分析
在對斑馬魚成魚和幼魚的急性毒性試驗過程中,依次在試驗第0h和96h時對試驗每組濃度的1個平行樣進行質量濃度分析,重復2次.取氟吡菌胺水樣40mL于150mL分液漏斗中,用15mL二氯甲烷萃取3次,合并有機相45mL于圓底燒瓶中,38℃減壓濃縮至干,再用20mL甲醇溶解,進行液相分析.
液相分析條件參考張小軍的方法[16]:安捷倫1200HPLC,色 譜 柱 Agilent Zorbaysb-C18 (4.6mm×150mm×5μm),紫外檢測器,流動相為甲醇:水=75:25;流速1.0mL/min,檢測波長265nm;進樣體積20μL.
1.5 數(shù)據(jù)處理
數(shù)據(jù)采用寇氏法分析,分別計算氟吡菌胺對斑馬魚 3個階段的急性毒性?半致死濃度 LC50值及其95%置信區(qū)間.
用DPS V13.5統(tǒng)計分析軟件進行ANOVA分析,將試驗數(shù)據(jù)進行統(tǒng)計分析.本文毒性數(shù)據(jù)均表示為:與空白對照組相比,所得試驗結果呈顯著性差異(P<0.05*)或極顯著差異(P<0.01**).
2 結果與討論
2.1 試驗液質量濃度分析結果
斑馬魚成魚和幼魚的急性毒性試驗過程中,各濃度暴露液實際質量濃度與理論質量濃度比較結果見表1.氟吡菌胺保留時間為7.017min.由表 1可知,試驗過程中氟吡菌胺的實際質量濃度與試驗設計理論濃度誤差范圍均在 80%~120%內(表1),符合OECD203試驗準則有關質量濃度要求,因此本研究中氟吡菌胺的暴露液質量濃度數(shù)據(jù)可采用理論設計濃度.
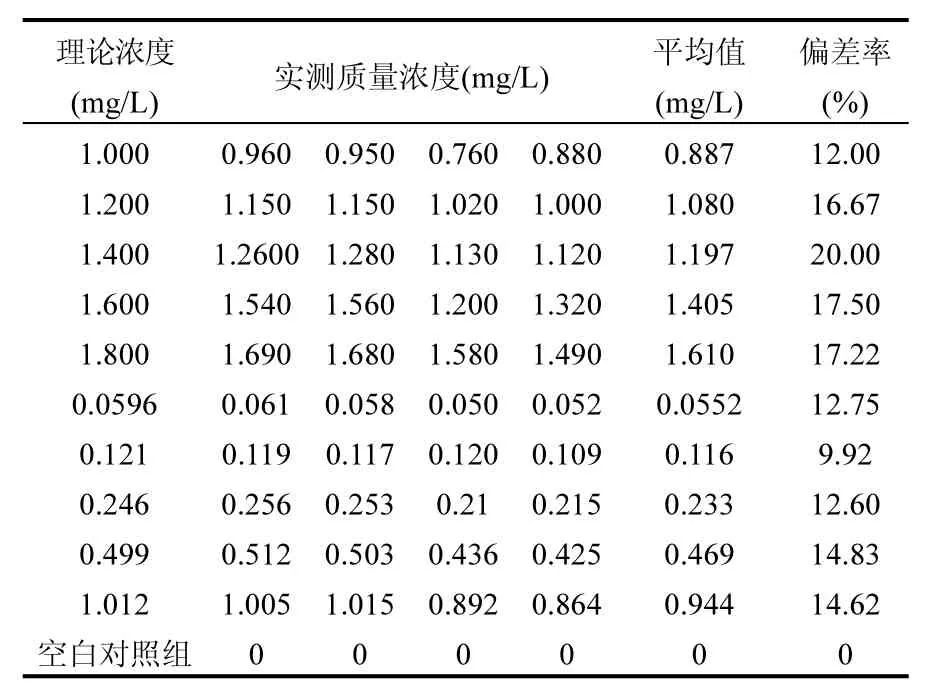
表1 氟吡菌胺質量濃度檢測分析Table 1 The concentration detection and analysis of fluopicolide in test
2.2 三個階段斑馬魚急性毒性結果
在氟吡菌胺對 3個階段斑馬魚的急性毒性試驗過程中,空白對照及助劑對照受試魚在試驗期間未出現(xiàn)死亡,各項體征正常.氟吡菌胺對3個階段的斑馬魚均有致死效應(表2),仔魚LC50(48h)值為0.204mg/L,成魚LC50(96h)為0.286mg/L,幼魚LC50(96h)為1.489mg/L,表明氟吡菌胺對仔魚和成魚毒性高于對幼魚的毒性.換而言之,對氟吡菌胺,仔魚最敏感,成魚次之,幼魚最不敏感.
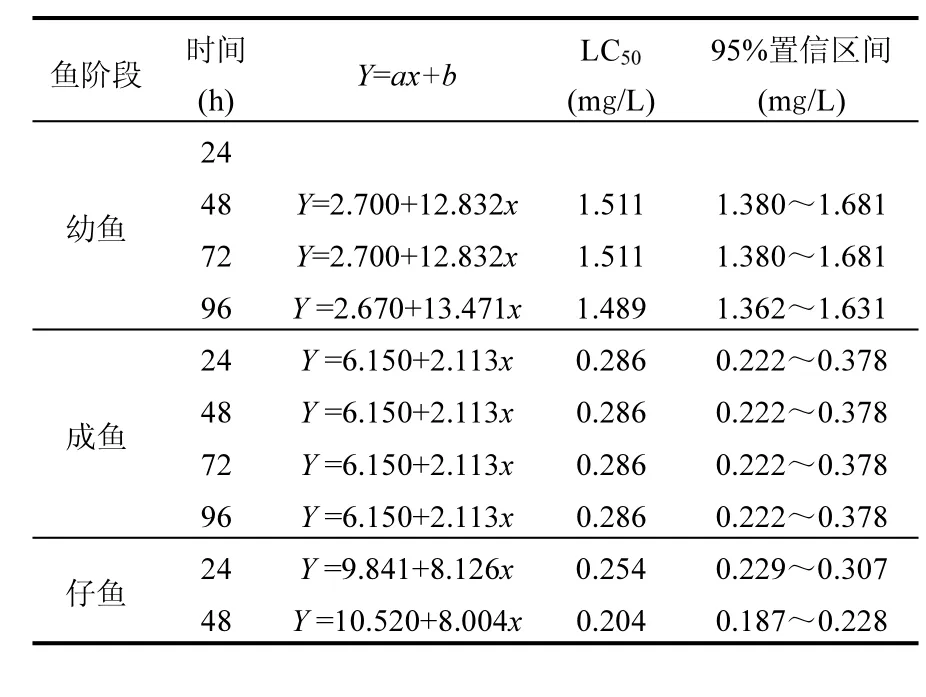
表2 氟吡菌胺對3個階段斑馬魚急性毒性結果Table 2 The acute-toxicity result of fluopicolide to three stages zebrafish
3個階段斑馬魚對氟吡菌胺呈現(xiàn)出相似中毒癥狀:低濃度藥劑暴露期間,魚側翻肚皮在水面游動,魚肚發(fā)白.中高濃度藥劑暴露開始時,即出現(xiàn)快速游動,上下旋轉游動,表現(xiàn)異常興奮,4h即側翻游,12h后靜止不游動,玻棒碰觸尾部仍可迅速游開;最后出現(xiàn)魚體下沉、游動減弱等,最終死亡.
本試驗得出,氟吡菌胺對斑馬魚幼魚LC50(96h)值為 1.489mg/L,按照化學農(nóng)藥環(huán)境安全評價試驗準則劃分的毒性等級,其對魚類急性毒性為中毒;而 EPA數(shù)值顯示:氟吡菌胺對虹鱒魚LC50(96h)值為0.36mg/L,對魚類急性毒性結果為高毒[17].因在毒性評價試驗中所用魚的種類不同,本試驗的LC50(96h)值是EPA數(shù)值的4.1倍,毒性等級也不同.因此,在農(nóng)藥對環(huán)境安全評價過程中,不但要考慮農(nóng)藥本身的成份和乳化劑等,還要考慮評價用魚種類的不同導致的結果差異性.
2.2 氟吡菌胺對斑馬魚胚胎的致死毒性效應
斑馬魚胚胎暴露在含氟吡菌胺的水環(huán)境中,胚胎出現(xiàn)死亡,表現(xiàn)為48h卵凝結、72h已成形但無法從卵殼中脫出且無心跳、胚胎趨于死亡或者已經(jīng)死亡,對不同濃度氟吡菌胺引起的斑馬魚致死效應的統(tǒng)計結果見圖1.
由圖1可知,在氟吡菌胺作用下,斑馬魚胚胎的死亡率隨其濃度的增大而增強, 0.0596mg/L以上濃度的氟吡菌胺對斑馬魚胚胎均有一定程度的致死效應;當氟吡菌胺濃度高于 0.35mg/L時,胚胎的死亡率明顯增大,濃度達1.72mg/L時,72h可導致一半以上的受試胚胎死亡,至96h受試胚胎全部死亡.
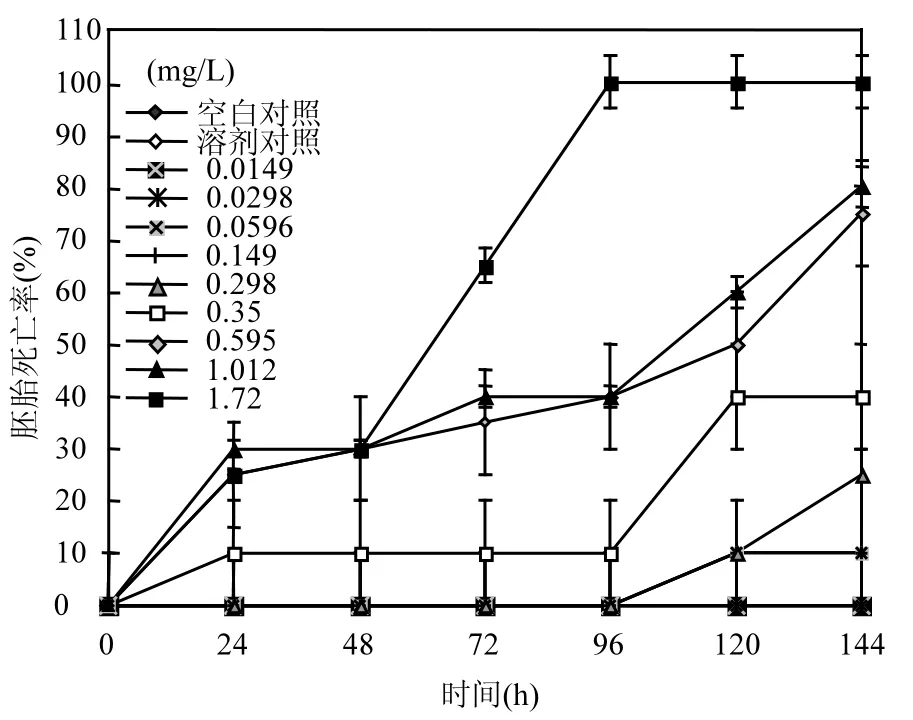
圖1 氟吡菌胺對斑馬魚胚胎的死亡率Fig.1 The Lethal toxicity of Fluopicolide to zebrafish embryo
2.3 氟吡菌胺對斑馬魚胚胎的非致死毒性效應
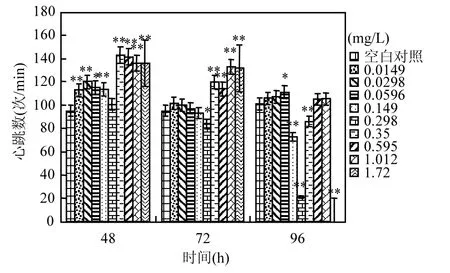
圖2 氟吡菌胺對斑馬魚胚胎心跳數(shù)的影響Fig.2 Effects of Fluopicolide to zebrafish embryo heartbeats
將斑馬魚胚胎在系列濃度氟吡菌胺中暴露48h時,空白對照胚胎有自主運動,平均心跳數(shù)在(95±1.7)次/min,同期所有濃度氟吡菌胺處理的胚胎心跳均比對照快,暴露72h和96h時,處理胚胎心跳減慢,但仍比對照胚胎心跳快(圖 2);96h時,0.149mg/L以上濃度氟吡菌胺處理胚胎所孵化仔魚均出現(xiàn)心跳無規(guī)律、忽快忽慢的癥狀.
72h時,對照胚胎全部孵化,仔魚體表黑色素比較密集,0.35mg/L濃度氟吡菌胺處理的胚胎孵化率為85.71%,1.720mg/L濃度氟吡菌胺處理的胚胎均未孵化出殼,但可見已成魚形,且均表現(xiàn)出明顯的心包囊腫;且經(jīng)氟吡菌胺處理的胚胎所孵化出的仔魚體表黑色素均比較稀少(圖3).

圖3 72h仔魚Fig.3 The zebrafish larvae at 72h
96h時,0.298mg/L及以下濃度氟吡菌胺處理的胚胎全部孵化,但均有輕微的心包囊腫和卵黃囊不吸收,0.35mg/L以上濃度氟吡菌胺處理后孵化出的仔魚均出現(xiàn)明顯心包囊腫和卵黃囊不吸收,且仔魚體表黑色素仍然比對照稀少(圖4).

圖4 96h仔魚Fig.4 The zebrafish larvae at 96h
120h時,0.0596mg/L及以下濃度的氟吡菌胺處理的胚胎孵化出的仔魚未出現(xiàn)心包囊腫的癥狀,且孵化出的仔魚平均體長都比對照長; 0.149mg/L及以上濃度的氟吡菌胺處理的胚胎孵化出的仔魚均出現(xiàn)不同程度的心包囊腫、卵黃囊不吸收和脊柱彎曲等癥狀,且孵化出的仔魚平均體長都比對照短(圖5).表明低濃度氟吡菌胺可促進斑馬魚體長增加,但高濃度氟吡菌胺可造成仔魚出現(xiàn)心包囊腫等癥狀,最終導致處理仔魚體長比對照仔魚短.
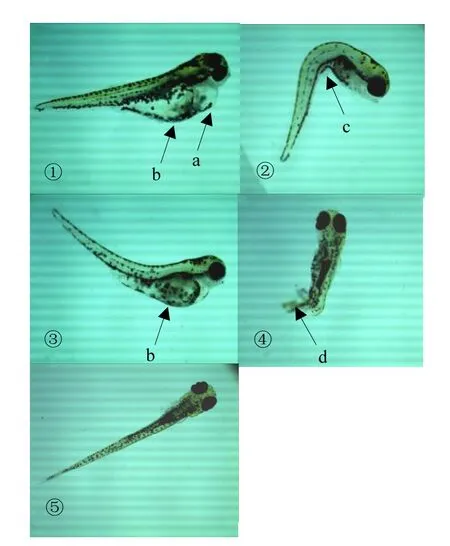
圖5 120h仔魚Fig.5 The treated zebrafish larvae at 120h
在斑馬魚胚胎暴露試驗中,可將72h孵化抑制率和120h心包囊腫作為氟吡菌胺的毒理學終點;本試驗中,72h孵化抑制率達到 100%的最低濃度為 1.720mg/L,120h時出現(xiàn)全致畸效應的最低濃度為0.149mg/L.
120h時將氟吡菌胺處理胚胎后存活仔魚放入清水中進行恢復,低濃度無中毒癥狀的仔魚均可正常生存,高濃度有中毒癥狀的仔魚其癥狀不可消除,且心跳減緩,144h后均死亡.
美國EPA數(shù)據(jù)庫中顯示氟吡菌胺的生物富集系數(shù)為 121,屬于中等富集性農(nóng)藥[18],因該藥劑主要施用于蔬菜和水果,具有強內吸性,在施用過程中,不僅通過內吸進入植株,而且還可通過各種農(nóng)耕措施和雨水沖刷流入水體,導致水體污染.目前,國內對該藥的殘留尚無報道,歐盟及韓國、日本2011年時規(guī)定氟吡菌胺最大殘留限量,其范圍在 0.01~0.3mg/kg之間[19],而本研究結果表明,0.0298mg/L的氟吡菌胺處理胚胎后,其孵化的仔魚心跳數(shù)比對照快,孵化出的仔魚體長也比對照長,說明該濃度氟吡菌胺已經(jīng)影響了斑馬魚心臟發(fā)育和仔魚體長.斑馬魚屬于脊椎動物,與人類基因的保守度高達85%[20],考慮到人類及脊椎動物的健康,應當加強對氟吡菌胺施用后相鄰水體的殘留檢測,并注意在水系統(tǒng)相鄰的作物生產(chǎn)區(qū)域慎用該農(nóng)藥.
2.4 氟吡菌胺對斑馬魚成魚的毒性效應
斑馬魚成魚暴露在不同濃度的氟吡菌胺藥液中14d后,對照組雌魚和雄魚平均體重分別增加0.1140g和0.0952g,處理組雌魚和雄魚平均體重均有減少,其中0.0298mg/L濃度處理的雌魚和雄魚體重減少最多,減少量分別達到原體重的38.36%和38.31%(圖6);
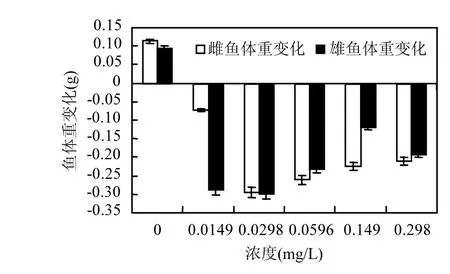
圖6 氟吡菌胺對斑馬魚成魚14d后體重的影響Fig.6 Effects of fluopicolide to the adult zebrafish body weight
暴露 14d后,處理組雌魚和雄魚均有死亡個體,死亡數(shù)與濃度成正比,且雄魚死亡數(shù)均高于雌魚(圖 7),說明氟吡菌胺對雄魚毒性高于雌魚.對照組成魚平均產(chǎn)卵量(246.3±16.1)個/對,有效卵率為95.60%,72h有效卵孵化率為100%,144h子代仔魚全部存活,無畸形.處理組成魚平均每對產(chǎn)卵量均低于對照組,無效卵量多,72h有效卵孵化率低,0.0298mg/L處理組144h子代仔魚存活率雖然比較高,但存活魚也大部分出現(xiàn)心包囊腫、體彎曲等畸形(表3).
在氟吡菌胺對斑馬魚成魚短期重復濃度試驗和胚胎體外直接染毒試驗結果中,仔魚均出現(xiàn)心包囊腫和卵黃囊不吸收,這是氟吡菌胺所致典型癥狀,可作為其毒性學觀察終點.
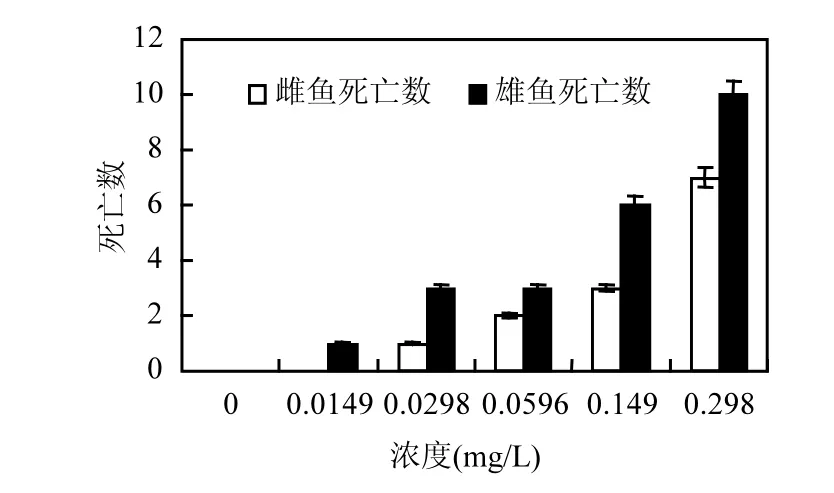
圖7 氟吡菌胺對斑馬魚成魚死亡數(shù)的影響Fig.7 Effects of Fluopicolide to the adult zebrafish mortality
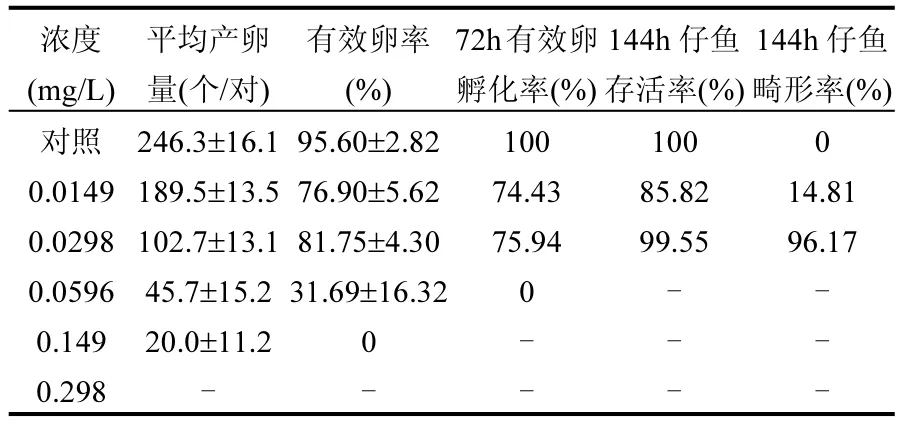
表3 氟吡菌胺對斑馬魚成魚的繁殖毒性Table 3 The reproductive toxicity of fluopicolide to the adult zebrafish
在成魚試驗中, 0.0298mg/L濃度氟吡菌胺處理的雌魚和雄魚體重減少最多,14d后親魚即出現(xiàn)3雄1雌的死亡,且有效卵率和有效卵孵化率也比對照低.由此可知,氟吡菌胺在水體中濃度超過0.0298mg/L時,即會對斑馬魚胚胎、仔魚的生長發(fā)育及成魚的繁殖造成影響.因此,建議其在近魚類養(yǎng)殖區(qū)附近的水體中最大殘留限量不要超過0.0298mg/L,約為歐盟等規(guī)定殘留限量范圍最大值的1/10.
3 結論
3.1 氟吡菌胺對斑馬魚仔魚、成魚及幼魚3個階段斑馬魚急性毒性結果為,對仔魚LC50(48h)值為0.204mg/L,成魚LC50(96h)為0.286mg/L,幼魚LC50(96h)為1.489mg/L.
3.2 當氟吡菌胺濃度達1.72mg/L時,72h可導致一半以上的受試胚胎死亡,96h受試胚胎全部死亡;氟吡菌胺處理斑馬魚胚胎后,出現(xiàn)了心包囊腫、心跳無規(guī)律、忽快忽慢、卵黃囊不吸收、黑色素沉積少及魚體彎曲等癥狀;其中,心包囊腫和卵黃囊不吸收是其典型癥狀,可作為其毒理學觀察終點.
3.3 氟吡菌胺對斑馬魚雄魚毒性高于雌魚.氟吡菌胺對斑馬魚成魚進行14d暴露后,成魚體重下降,產(chǎn)卵量減少,有效卵量降低;子代仔魚存活率下降,且存活子代仔魚大部分出現(xiàn)心包囊腫、體彎曲等畸形.
3.4 氟吡菌胺在水體中濃度超過0.0298mg/L時,即會對斑馬魚胚胎、仔魚的生長發(fā)育及成魚的繁殖造成影響.建議其在近魚類養(yǎng)殖區(qū)附近的水體中最大殘留限量不要超過0.0298mg/L.
[1] 張小軍,張宗儉,劉尚鐘,等.氟吡菌胺原藥的高效液相色譜分析[J]. 農(nóng)藥, 2011,50(9):661-662.
[2] 閆 磊,王文橋,孟潤杰,等.氟吡菌胺與吡唑醚菌酯混合物對黃瓜霜霉病菌的毒力增效及其抗藥性的影響 [J]. 農(nóng)藥, 2013, 52(1):53-56.
[3] 朱衛(wèi)剛,胡偉群,張蕊蕊,等.新型殺菌劑氟吡菌胺室內殺菌活性[J]. 農(nóng)藥, 2012,51(12):922-923.
[4] 劉春艷,郝永娟,王 勇,等.氟吡菌胺·霜霉威(銀法利)懸浮劑對番茄晚疫病和黃瓜霜霉病的防治效果 [J]. 中國蔬菜, 2008(1): 26-27.
[5] 歐陽水平,唐常勝,陳詩亮.銀法利懸浮劑防治辣椒疫病田間藥效試驗 [J]. 河北農(nóng)業(yè)科學, 2007,11(6):26-27,35.
[6] 馬光恕,徐曉東,廉 華,等.銀法利對馬鈴薯晚疫病的防治效果研究 [J]. 安徽農(nóng)業(yè)科學, 2010,38(13):6745-6746,6749.
[7] 李德建.銀法利--拜耳全新蔬菜殺菌劑 [J]. 中國農(nóng)藥, 2006(4): 54.
[8] 段麗芳(譯).美國環(huán)保署啟動更多農(nóng)藥審議 [J]. 農(nóng)藥科學與管理, 2013,34(7):11.
[9] 李 淼,李 洋,楊 浩,等.防治卵菌綱病害的新型殺菌劑氟啶酰菌胺 [J]. 農(nóng)藥, 2006,45(8):556-557.
[10] 杜青平,劉伍香,袁保紅,等.1,2,4-三氯苯對斑馬魚生殖和胚胎發(fā)育毒性效應 [J]. 中國環(huán)境科學, 2012,32(4):736-741.
[11] 李志斐,謝 駿,龔望寶,等.三甲基氯化錫對水生生物的毒性效應 [J]. 中國環(huán)境科學, 2011,31(4):642-646.
[12] 朱 琳,史淑潔.斑馬魚胚胎發(fā)育技術在毒性評價中的應用 [J].應用生態(tài)學報, 2002,13(2):252-254.
[13] OECD. OECD guidelines for the testing of chemicals. [C]//Section 2:Effects on biotic systems test No 203:Acute toxicity for fish. Paris, France: Organization for Economic Cooperation and Development, 1992.
[14] OECD. OECD Guidelines for the testing of hemicals. [C]//No. 212: Fish, short-term toxicity test on embryo and sac-fry stages, Paris, France: Organization for Economic Cooperation and Development, 1998.
[15] OECD. OECD guidelines for the testing chemicals. [C]//No. 204: fish, prolonged toxicity test: 14-day study. Paris, France: Organization for Economic Cooperation and Development, 1984.
[16] 張小軍,張宗儉,劉尚鐘,等.氟吡菌胺原藥的高效液相色譜分析[J]. 農(nóng)藥, 2011,50(9):661-662.
[17] http://sitem.herts.ac.uk/aeru/iupac/index.htm [EB/Z]. global availability of information on agrochemicals, Pesticide Properties Database, 2007.
[18] 蔡道基,楊佩芝,龔瑞忠,等.化學農(nóng)藥環(huán)境安全評價試驗準則[M]. 北京:國家環(huán)保局, 1989.
[19] European Food Safety Authority .Reasoned opinion of EFSA: Modification of the current MRLs for fluopicolide in various commodities. EFSA Journal, 2011,9(1):1977.
[20] 全珊珊,吳新榮.斑馬魚.人類疾病研究的理想模式動物 [J]. 生命的化學, 2008,28(3):260-263.
致謝:在此,謹對慕衛(wèi)老師在試驗方案和文章修改方面給予的悉心幫助表示衷心的感謝.
Toxic effects of fluopicolide on zebrafish.
LIN Jin1,2, WANG Hong-yan3, WANG Kai-yun1,2*, FAN Wei-di2, XU Hui4,
LIU Jie4(1.College of Plant Protection, Shandong Agriculture University, Taian 271018, China;2.Center of Pesticide Environmental Toxicology, Shandong Agriculture University, Taian 271018, China;3.Shandong Cotton Research Center, Jinan 250100, China;4.United Pesticide Industry Co., Ltd., Shandong Province, Jinan 250100, China). China Environmental Science, 2014,34(12):3230~3236
The zebrafish embryos technology and traditional toxicology methods were used to determined the toxicity of fluopicolide to zebrafish embryos、adult fish and larvae. Fluopicolide had lethal capabilities to the three stages of zebrafish with the LC50(48h) values to larvae and LC50(96h) to adult fish and juvenile was 0.204mg/L, 0.286mg/L and 1.489mg/L. 0.0596mg/L or more concentrations fluopicolide have a certain degree of lethal effect to zebrafish embryos, and the embryos which were treated with high concentrations displayed many of the symptoms, such as pericardial cyst, yolk sac does not absorb, less melanin deposition and fish bending. After 14days exposure with fluopicolide, the adult zebrafishs expressed the following symptoms: weight loss, reduction in fecundity, the amount of effective eggs were reduced; After treated by 0.0298mg/L fluopicolide, though 144h offspring larval’s survival relatively high, but most surviving fish has still emerged as deformity: pericardial edema and abnormal body bending, etc. Fluopicolide residue in water have the potential hazards to the growth and development of each life stage of zebrafish.
fluopicolide;zebrafish;embryo;adult fish;acute toxicity
X171.5
A
1000-6923(2014)12-3230-07
林 琎(1978-),女,四川三臺人,實驗師,山東農(nóng)業(yè)大學博士研究生,研究方向為農(nóng)藥毒理及有害生物抗藥性.發(fā)表論文8篇.
2014-03-10
國家“十二五”科技支撐計劃(2011BAE06B02)
* 責任作者, 教授, kywang@sdau.edu.cn

