短鏈脂肪酸受體GPR43的研究進展
劉鴻飛 魏云林 盧磊磊 季秀玲
摘 要:短鏈脂肪酸受體(G protein-coupled receptor43,GPR43)屬于G蛋白偶聯受體c(G protein-coupled recep-lt,tors,GPCR)家族,因其與脂肪和糖代謝相關,在過去的10年中其研究日益受到重視研究表明,GPR43不僅可以通過參與調節食欲和胃腸肽的分泌來調節脂肪的分解與形成,最終與代謝性疾病如肥胖、2型糖尿病和心血管病的密切相關:而且GPR43還參與調節人身體血脂濃度和炎癥發生過程,甚至還與細胞的癌變密切相關。(…lGPR43作為糖代謝、脂肪代謝的重要調節受體,已經成為一個重要的藥物篩選靶點。針對GPR43受體的研究現狀進行了總結并對今后的應用研究進行了展望。關鍵
關鍵詞:短鏈脂肪酸;G 蛋白偶聯受體(GPCR);短鏈脂肪酸受體(GPR43)中圖
分類號:Q955
文獻標識碼:A
文章編號:1007-7847(2014)06-0557-08
(
G蛋白偶聯受體(G protein-coupled reCeptors,GPCR)是一類具有7個螺旋跨膜結構的膜受體,主要介導大多數的激素和神經傳導引起的細胞應答,此類受體是許多新藥研發的重要靶點。絕大多數的GPCRs已去孤兒化,即找到其相應的內源性配體。游離脂肪酸受體(FFAR)是GPCRs中最大的一個家族,其配體為游離脂肪酸(free fatty acid,FFA)。根據游離脂肪酸碳鏈的長短,可將其分為短鏈脂肪酸(1~6個碳原子)、中鏈脂肪酸(7~12個碳原子)和長鏈脂肪酸(大于12個碳原子),它們在眾多生理和病理過程中都是關鍵的信號分子,并且除作為機體結構原料以及能量來源維持能量平衡外,還可影響胃腸消化系統的各種功能。其中,短鏈脂肪酸(short chain fatty acids,SCFA)包括甲酸、乙酸、丙酸、丁酸、戊酸和己酸,它們的作用涉及到影響結腸的血流量、水和電解質的攝取、通過釋放5-羥色胺(5-hvdroxytryptamine,5-HT)促進結腸蠕動和離子運輸、影響腸道菌群以及調節機體免疫。此外,短鏈脂肪酸還可作為信號分子參與調節細胞的生長、分化、分泌和遷移,在機體營養調控和健康維持方而都有著重要作用。GPCRs也是現代醫學研究最多的治療靶標之一,據估計約有半數現代藥物都是以這些受體為靶標,全球年度交易額達500億美元。
1 GPR43與GPR41是重要的短鏈脂肪酸受體
GPR43(G protein-coupled receptor 43)存在:于脂肪組織、免疫細胞、腸胃環境等不同組織和細胞中,它能被短鏈脂肪酸激活,根據其內源性配體也被稱為FFAR2。SCFA主要是由小腸厭氧細菌在對淀粉和難消化纖維的發酵過程中產生。SCFA是哺乳動物主要的能量來源,可為反芻動物和非反芻動物提供70%和5%~IO%的能量。而各種短鏈脂肪酸對GPR43活性的強弱順序依次為:丙酸(C3)≥乙酸(C2)=丁酸(C4)>戊酸(C5)>己酸(C6)-甲酸(C1);此外,這些脂肪酸也作用于同一家族的另一個受體GPR41,順序則為:戊酸(C51-丙酸(C3)-丁酸(C4》乙酸(C2)>甲酸(Cl)。這一規律可用于區分GPR41和GPR43,兩受體間的氨基酸同源性僅為43%。這兩個受體都能偶聯Gi/o誘導或抑制腺苷酸環化酶通路,但只有GPR43能偶聯Gq誘導磷脂酶C通路的激活,增加細胞內鈣離子水平。
GPR41和GPR43有重疊的配體,又共享部分信號通路,所以存在相互干擾的現象。GPR41在病理生理學中的功能已有較多報道,在此將不予討論。我們將主要闡述GPR43的研究進展。
2 GPR43和脂代謝
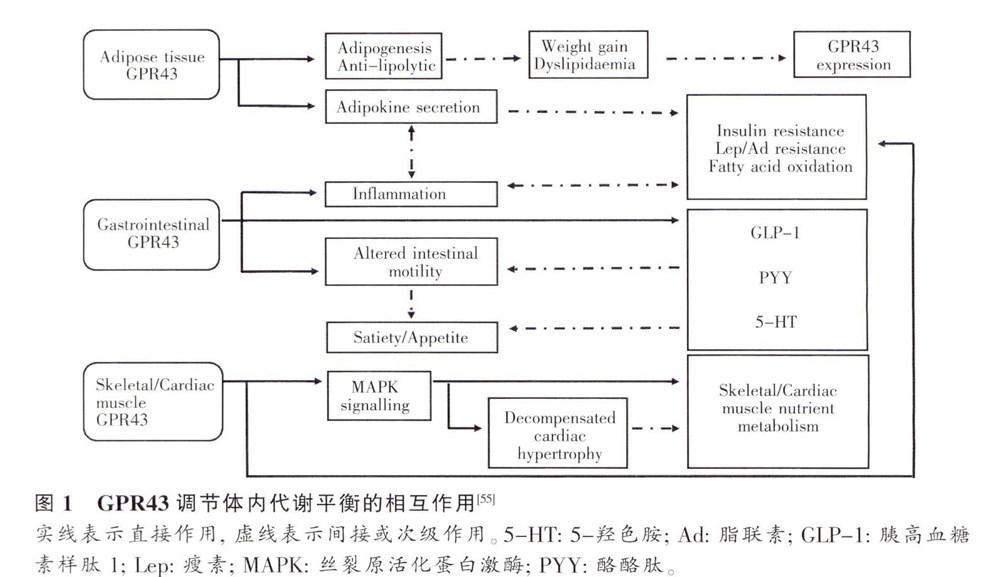
GPR43主要在小鼠白色脂肪組織(white adi-pose tissue, WAT)中表達,在脂肪細胞中的表達水平要比血管藎質細胞中高,在喂食高脂肪(HF)食物后小鼠的脂肪組織中GPR43過表達。在3T3-L1前脂肪細胞分化過程中和過氧化物酶體增殖物受體γ (peroxisome proliferator-activated recep-torg,PPARGγ)激活時,GPR43表達量均會增加。此外,乙酸和丙酸均能使已分化的細胞積累更多的脂肪,丙酸還能誘導GPR43和PPARγ在分化過程中過表達。通過RNA干擾技術證明,在3T3-L1細胞中隨著GPR43表達的抑制,PPAR-γ2和aP2的表達也會降低,最終導致細胞中脂肪的積累增加。因此GPR43及其配體在脂肪的合成中具有重要的作用。
在已分化的脂肪細胞中,乙酸和內酸均能抑制脂肪的分解。但經GPR43 siRNA抑制或經基因敲除GPR43的小鼠脂肪細胞卻不能對丙酸和乙酸的刺激作出應答,該結果表明GPR43的激活可直接抑制脂肪的降解。此外,分別對野生型和GPR43缺陷型小鼠注射乙酸,結果野生型小鼠血漿中游離脂肪酸含量明顯減少,而缺陷型小鼠則沒有變化,明確了乙酸是通過激活CPR43而在體內發揮抗脂肪降解作用。
喂食高脂飼料會導致小鼠皮下脂肪組織(subcutaneous adipose tissue, SAT)中GPR43過度表達,同時還導致幾個PPARγ靶基因的過度表達,從而證明高脂肪飲食可誘導激活PPARγ。有趣的是,通過補充菊粉類果聚糖(inulintype fructans,ITF)益生素就能減少脂肪細胞的大小和其中的脂肪量,同時CPR43和PPARγ靶基因的表達也會下調。而ITF益生素對PPARγ活性的抑制作用應該是通過腸道菌群來調節的,這一發現可能有助于用來減肥。為了闡明PPARγ的激活和GPR43表達間的關系,研究人員用不同活性PPARγ的調節劑對小鼠皮下脂肪中培育出的外植體進行了實驗,研究表明PPARγ激動劑均可導致GPR43和aP2(結合蛋白)的過表達,而PPARγ拮抗劑的作用則正好相反。
Bjursell利用GPR43基因敲除小鼠研究了高脂飼料對能量、葡萄糖和脂質代謝的影響。研究證明在經過25—30周的高脂飲食后.GPR43基因缺失的小鼠表現出體重和脂肪量減少,而食物攝入量反而增加。在這些小鼠的白色脂肪組織中葡萄糖的攝入受到控制,小鼠的血脂、甘油三酯以及巨噬細胞含量均有所減少。遺憾的是這些現象也許并不會在人類身上發生。研究表明,人的PPARγ激動劑也不會影響GPR43在人類前脂肪細胞中的表達,雖然結合蛋白(aP2)的表達會顯著增加。而且鼠GPR43的激動劑(乙酸、丙酸、苯基乙酰胺衍生物)也無法誘導人的前體脂肪細胞分化。在比較了肥胖患者和正常對象后,發現二者的GPR43表達量是相似的,并且與aP2的表達無關。但在研究中卻發現人的GPR43表達程度與腫瘤壞死因子α的表達呈正相關。
短鏈脂肪酸能刺激小鼠白色脂肪細胞分泌瘦素(一種抑制食欲的激素),一些研究表明GPR41可以調節這一作用,但另一些研究認為這個作用實際址受GR43的調控。對于這樣一些觀點,仍需進一步開發特異性更好的藥理學模型來進行驗證。
3 GPR43和腸道功能
短鏈脂肪主要由在腸道中的細菌發酵而來,不僅可以在腸道內(如丁酸)被其他器官作為營養物質吸收和利用,同時它們還能調節胃腸道對脂肪的代謝。GPR43在整個腸道的細胞中均有表達,一些研究表明某些短鏈脂肪酸的作用主要依賴與GPR43的結合。酪酪肽(peptide YY,PYY)可由短鏈脂肪酸誘導后在血液中釋放,它在腸道內的分泌能夠抑制上胃腸道的蠕動。因此,短鏈脂肪酸能通過激活GPR43來刺激L細胞釋放PYY,從而減弱腸胃運動,在人類結腸分泌L細胞中也發現有GPR43的表達。Karakiet提出短鏈脂肪酸能激活肥大細胞中的GPR43來釋放5-羥色胺(5-HT),從而對結腸的蠕動和分泌發揮作用。GPR43在整個人鼠的腸胃道中都有表達,在食道和胃中的表達水半最低,在結腸中最高。
胰高血糖素樣肽l (glucagon -likepeptidel,GLP-1)也是腸內分泌刑L細胞釋放的胃腸激素,能控制腸功能和葡萄糖代謝。給人和動物注射SCFA可導致血漿中GLP-1的釋放,研究表明人和大鼠的GPR43和GLP-1存在共定位現象。在嚙齒炎動物中,補充發酵的碳水化合物能增加GLP-I的分泌和近端結腸GPR43/GLP-1陽性細胞的密度。膳食纖維經細菌發酵后,結腸能產生更多的短鏈脂肪酸,從而通過激活細胞中的GPR43來增加GLP-l內分泌。這個結論近期已被Tolhurst等利用GPR43基因敲除的小鼠實驗所證實。
在無菌小鼠上的實驗表明腸道微生物菌群的組成與腸道自由脂肪酸受體的表達量有關,無菌小鼠肥胖增加與GPR41和GPR43在遠端小腸的表達降低相對應。與常規小鼠相比,肥胖的無菌小鼠腸道中GPR43、CPR41的表達量,以及PYY和GLP-1的含量都明顯降低,其中GPR43和GPR41的表達量分別減少了10%和70%。
Kimura等證明CPR43缺失的小鼠在正常飲食條件下會肥胖,而塒于GPR43過表達的小鼠,即使喂食高脂肪的食物電不會發生肥胖。在脂肪細胞中短鏈脂肪酸可誘導激活GPR43,從而抑制脂肪的積累,而對于其他組織,則可抑制能促進脂質和葡萄糖代謝的胰島素的分泌。所有這些研究都汪明GPR43是一個膳食過剩的能量傳感器,可以控制身體能量的利用率,使代謝環境保持穩定。
總之,這些小鼠腸道的實驗已經表明腸道微生物菌群可通過影響腸道內短鏈脂肪酸受體的表達和腸肽的分泌來調節脂肪的代謝,但因人的腸道微生物差異很大,其機制的閘叫尚前進一步的研究。
4 GPR43和炎癥
短鏈脂肪酸也能參與調節促炎和抗炎介質的產生。例如,短鏈脂肪酸能誘導前列腺素E2的產生,而且這個過程可以被百日咳下毒素抑制,表明該過程有G蛋白介導的信號系統的參與。
Maslowskiet等證明子由乙酸激活GPR43后引起結腸炎的相關炎癥應答。在急性和慢性腸炎、關節炎和哮喘病例中,GPR43基因敲除小鼠無法消除炎癥,甚至還會不斷加重。這可能與免疫細胞的聚積有關。Sina等報道,在GPR43基因敲除的小鼠急性結腸炎模型中,雖然免疫應答較弱,炎癥反應較輕,但是其死亡率更高。而在慢性結腸炎模型中,GPR43的缺失導致結腸炎癥減輕,卻沒有任何敗血癥和致死征兆。因此腸道免疫細胞具有雙向調節作用,對急性細菌入侵有很好的保護作用,但對慢性炎癥的淌除卻不利。
研究還發現GPR43在中性粒細胞、嗜酸性粒細胞和單核細胞中高表達,這些免疫細胞在各種炎癥性疾病的病理生理機制中均J非常重要。在小鼠中已證明經短鏈脂肪酸誘導激活的GPR43參與了中性粒細胞的趨化作用。但其機制仍不清楚。而比利時GalapagoS公司的GLPG0974 口服小分子CPR43抑制劑被發現可以抑制中性粒細胞的遷移,這一結果也間接證明了GPR43能參與中性粒細胞的趨化作用。當抵抗炎癥時,矩鏈脂肪酸通過激活GPR43來補充中性粒細胞,這種作用特別有助于闡明GPR43和SCFA調節炎癥的機制。 多項研究的結果顯示,不同類型的免疫細胞對同一短鏈脂肪酸能產生不同的分子免疫應答。這可能與這些細胞在炎癥反應中所擔負的作用一致。因此,GPR43不同的下游分子通路仍值得進一步研究。
在結腸炎、肥胖、糖尿病、白血病等小鼠模型中,喂食ITF益生元后均能夠控制炎癥的發生。人們推測這種益牛元應該是通過對GPR43的抑制來發揮抗炎作用的,但這樣的結論還有待更多的實驗來證實。
5 GPR43和肌肉代謝
GPR43可以通過調節機體的炎癥反應、胃腸肽的釋放和脂肪的合成與分解來調節骨骼肌和心肌的代謝功能。有證據支持PYY、GLP-1、5-HT的增加,可增強對胰島素的敏感性、肌肉對葡萄糖的攝取和脂肪酸的氧化。已知細胞脂肪代謝調節因子,如瘦素、脂聯素能促進胰島細胞對胰島素的敏感性,也能促進這些組織中脂肪酸的氧化分解。在肥胖的糖尿病小鼠模型中,脂聯素的使用可以減緩心肌肥大傾向,還能提高其肌細胞的收縮能力。但在這些過程中GPR43是如何起作用的,尚有待進一步的研究。圖1總結了GPR43可能直接或間接地調節這些組織營養代謝的機制。
6 GPR43和癌癥
已有研究表明腸道菌群對結腸癌的發生和發展過程均有影響。腸道菌群發酵產生的如丁酸和其他短鏈脂肪酸能夠影響細胞周期,抑制細胞的增殖,誘導分化和細胞死亡。Hatanaka等發現在致瘤裸鼠NIH3T3細胞中GPR43過表達,因此他們提出GPR43可能是一個致癌基因,在胃癌和大腸癌中也發現類似的結果。相反,Tang等則認為CPR43是一種腫瘤抑制基因,因為在人的結腸癌樣本細胞系中GPR43的表達沒有增加反而是減少了,并且在結腸癌細胞系中重新導入GPR43后會使癌細胞凋亡或使細胞周期停滯,在他們所建立的人類結腸癌細胞系中,只有九分之一的細胞系檢測到GPR43的轉錄。在經GPR43轉染的結腸癌細胞系HCT8中,由丙酸和丁酸引起的抗腫瘤細胞增殖作用則更顯著。
Bindels最近的證據表明,短鏈脂肪酸通過激活GPR43來抗癌細胞增殖的作用并不僅僅限于胃腸道細胞。經ITF益牛元處理的白血病小鼠,在乙酸和丁酸水平不變的情況下,伴隨著門靜脈中丙酸水平的增加,白血病細胞的增殖會受到抑制。此外,由苯乙酰胺衍生物激活GPR43后也能抑制人和小鼠白血病細胞的增殖。在體外實驗中,丙酸可以通過調節cAMP水平來抑制白血病細胞的增殖,該過程顯然涉及到G蛋白偶聯受體途徑。但是GPR43在其他癌癥中的表達水平尚有待研究。
7 GPR43作為藥物篩選新靶點的挑戰
短鏈脂肪酸能通過不同的信號通路發揮各項功能。無論是開發和研究GPR43的激動劑還是拮抗劑都需要闡明短鏈脂肪酸結合GPR43后的激活和調節機理。但目前GPR43作為一個重要的受體其藥理學研究尚存在以下缺陷:第一,短鏈脂肪酸效能低下,反應濃度甚至需達到毫摩爾數量級;第二,因為小鼠GPR41的表達也會干擾GPR43的效應,因此即使采用GPR43基因敲除小鼠也可能無法建立理想的動物模型,這種現狀給以GPR43作為靶點的新藥篩選帶來了挑戰。
從內源性和人工合成配體中篩選CPR43高特異性調節劑,需要同時比較這些配體與GPR43和GPR4l結合的特異性。通過對hCPR43和hGPR41的比較表明,兩個受體中的兩個精氨酸和一個組氨酸為重要的配體識別位點。hGPR41和hG-PR43與內源性配體結合位點的選擇主要由3個氨基酸(El66、L183和C184)所決定,這一發現已經被用于開發小羥基酸與受體結合的構效關分析。
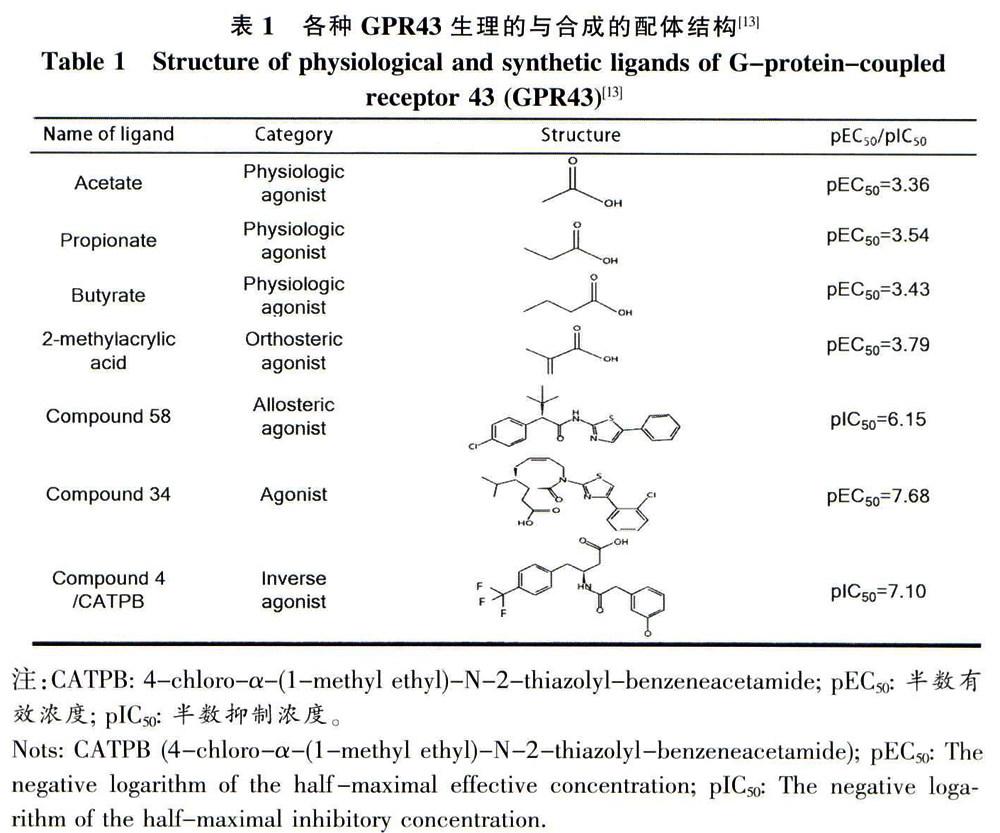
Schmidt等研究了包含額外支鏈、不飽和環狀尾的小羧酸作為配體的可能,研究證明SP或SP2雜化的α碳化合物優先激活hGPR43,而SP3雜化的α碳化合物則選擇性地優先結合hCPR41。這些小分子化合物比內酸和乙酸具有更好的選擇性(表1),但活力并不高,還有待進一步改進。
Lee等通過高通量篩選技術鑒定出苯乙酰胺1和2是GPR43的有效合成配體,二者都對GPR43具有選擇特異性,可通過Gαi途徑抑制脂肪在脂肪細胞巾的降解。GPR43還可以通過監控腸道膳食纖維代謝,調節食欲,以及SCFA對瘦素分泌的調節作用來參與機體能量與體重的調節,同時還是腸道炎癥狀態下招募嗜中性粒細胞所必需的,因此可作為篩選和開發調節機體代謝紊亂新藥的標靶。這些人工合成的內源性配體都具有不重疊的結合位點。兩年后,該團隊報告了一系列基于這兩個重要分了的GPR43激動劑及最優化的藥代動力學特性(表1)。 重要的是,這些人工合成的內源性配體也許采用了不同的途經來激活細胞內的信號通路。這些苯乙酰胺衍生物同樣作用于Gαi-cAMP和Gαq-PLC途徑,而丙酸和乙酸則主要對Gαi-cAMP起作用,其強度比Gαq-PLC途徑有效。最近,比利時Euroscreen公司已經申報了一系列有關GPR43激動劑化全物的專利,引起了人們的關注(表1)。
只能由內源性配體激活的重組受體(receptoractivated solely by synthetic ligands,RASSL)為這類受體功能的研究提供了一個非常好的工具。而RASSL的轉基因動物則更有利于對GPR43在活體內作用機制進行研。但作為潛在的新藥化合物,這些GPR43調節劑或激動劑在效率、親和力和藥代動力學特性方面都還遠遠達不到新藥的要求,仍需要進一步的改善,它們的安全性也還需要進一步的檢測。
8 結論
已有越來越多的研究表明GPR43參與了調節肥胖、腸胃活動、肌肉代謝、炎癥甚至癌癥的發生和發展過程,具有成為上述疾病藥物開發的重要靶點的極大潛力。但遺憾的是,對GPR43的研究遠遠還不夠,尤其人體內數據較為匱乏,而且一些已有的結果又與其他的動物實驗結果有所矛盾。因此對 GPR43功能的研究仍然任重而道遠。
同前我們絕大部分關于GPR43的認識是通過基因敲除小鼠的實驗來獲得的。但在這樣的動物模犁也會受到其他一些短鏈脂肪酸受體如GPR41的影響,因此在采用這種模型作結論時必須謹慎。此外,調節劑的選擇特異性也必須進一步提高,防止作用于其他受體,影響結果,甚至可能對人體有害。因此,進一步開發新的藥理學研究工具,對于確定GPR43的性質和功能至關重要。
腸道菌群會對宿主的代謝和免疫產生很大影響,GPR43作為腸源性代謝產物受體,這一發現對解釋這些相互作用提供了可能。事實上一些制藥公司已經開始了GPR43靶向藥物的研發,包括美因Amgen公司的變構激動劑,比利時Euro-screen公司的內源性激動劑和抑制劑,比利時Galapogos公司的小分子抑制劑。其中比利時GaJapogos公司末公開結構的專利GLPG0974已進入臨床I期研究。但是,對于采用何種調節方式最有益于治療這一問題目前仍有爭議。此外,GPR43的激動劑或調節劑的生物安全性也沒能完全確認,所以短時間內投入大量的資金和人員可能仔在著較高的風險。

