微囊藻毒素生物合成基因及其功能研究進展
黃 鑫 魏曉璐 馮 悅 張阿梅 夏雪山 劉 麗
摘 要:水體富營養化加劇,導致了藍藻水華在世界范圍內頻發。藍藻產生的微裳藻毒素是最常見的一種藻毒素,對人類和動物造成了很大的危害甚至導致死亡。微囊藻毒素經非核糖體合成途徑由多肽合成酶合成。對微囊藻毒素的結構與性質、微囊藻毒素合成基因的功能及其生物合成、微囊藻毒素的分子生物學檢測技術進行了評述,對未來的研究方向進行了展望。
關鍵詞:微囊藻毒素;藍藻:基因;檢測
中圖分類號:Q89
文獻標識碼:A
文章編號:1007-7847(2014)05--0445-08
隨著社會的發展,生活及工農業生產中大量含氮、磷的廢污水未經有效處理被排入水體中,導致水體富營養化,藍藻等藻類成為水體中的優勢種群,大量繁殖形成水華,藍藻水華暴發帶來的微囊藻毒素(microcystin, MC)污染已經成為全球關注的環境問題。微囊藻毒素造成了眾多中毒事件,對人類和動物的健康造成了很大的威脅。深入認識微囊藻毒素,了解微囊藻毒素的結構、編碼基因及其合成,有助于對微囊藻毒素進行有效的監測,對微囊藻毒素的合成進行干預,從而在監測、控制和消除等方面有效解決微囊藻毒素的危害問題,對水體環境的保護具有重要的現實意義。
1
微囊藻毒素的結構與性質
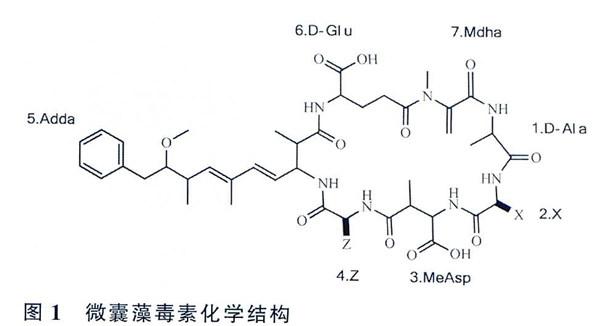
微囊藻毒素是一種單環七肽肝毒素,一般結構為環(D-Ala-X-D-MeASp/D-Asp-Z-Adda—D-Glu-Mdha)(圖1)。分子結構1位上是D-丙氨酸(D-Ala);2、4位上的X和Z分別代表不同的氨基酸;3位上是D-赤-β-甲基天冬氨酸(MeAsp);5 位上是(2S,3S,8S,9S) -3-氨基—9—甲氧基一2,6,8-3甲基-10-苯基-4,6-_烯酸(Adda);6位上是D一谷氨酸(D-Glu);7位上是N一甲基脫氫丙氨酸(Mdha)。其中.Adda是一種特殊氨基酸,是毒素活性表達所必需的基團,其結構改變會導致毒性減弱或喪失。因為結構中存在可變氨基酸,所以微囊藻毒素有多種異構體,目前發現的已經超過90種。其中最普遍、毒性較大的是MC-LR、RR和YR(L、R、Y分別代表亮氨酸、精氨酸和酪氨酸)。
微囊藻毒素對蛋門磷酸酶1和2A的活性具有抑制作用及多種毒效應。肝臟是微囊藻毒素主要的靶器官,微囊藻毒素會引起肝臟炎癥、肝損壞甚至壞死,另外其還與腫瘤促進作用有聯系。腹腔注射小鼠實驗發現MC-LR半致死率(lethal dose 50% LD50)為50 μg/kg, MC-RR和MC-YR毒性相對較低。世界衛生組織(WoI-ld Health Or-ganization,WHO)規定飲用水中微囊藻毒素的含量不得超過為1μg/L。微囊藻毒素具有較好的水溶性,在水中的溶解度大于1g/L,另外還能溶解于丙酮和甲醇。微囊藻毒素還具有很高的耐熱性,加熱煮沸都不能將其去除。由于微囊藻毒素的這些性質,常規的水處理工藝不能將其有效去除,因此對微囊藻毒素的檢測以及預防顯得尤為重要。
2 微囊藻毒素的合成基因及基因功能
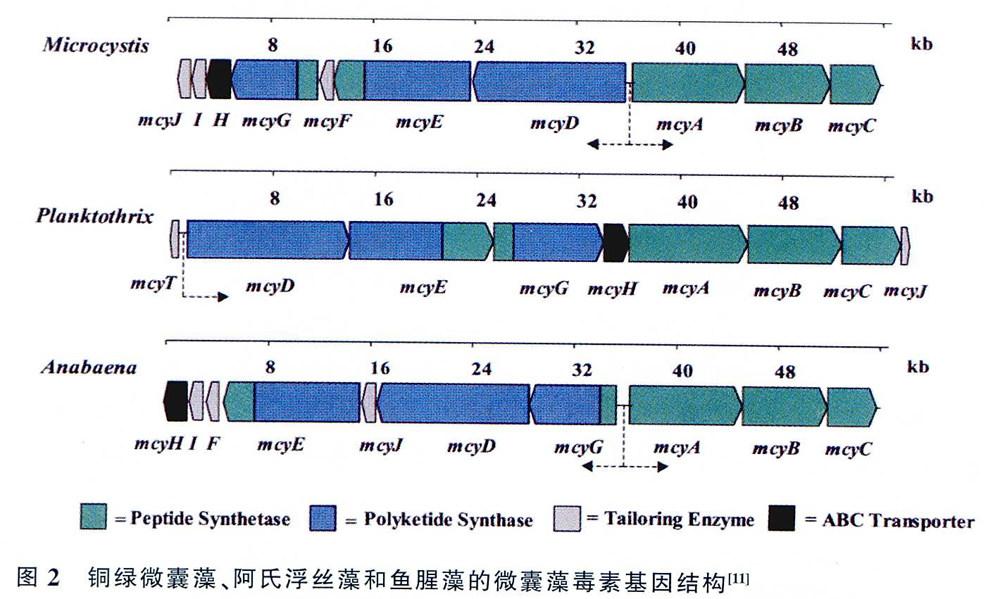
微囊藻毒素由聚酮合酶(polyketide synthase,PKS)和非核糖體合成酶(non-ribosomal peptidesynthetase,NRPS)等特殊的酶利用氨基酸或者化合物,繞開核糖體,通過非核糖體合成途徑完成合成,微囊藻毒素合成基因(microcystin syn-thetase genes,mcy),是第一個被完全測序的藍藻代謝物合成基因。Tillett等最先解析了微囊藻屬(Microcystis) PCC7806的mcy基因,基因全長55kb,包含mcyA -C和mcyD -J兩個操縱子,共有10個開放閱讀框,主要編碼PKS和NRPS。mcyD-j操縱子,編碼PKS、NRPS和PKS混合的雜交酶、剪裁酶、以及轉運酶;mcyA -C操縱子,主要編碼3個NRPS。
微囊藻毒素的主要產毒藻種為微囊藻、魚腥藻(ANABAENA)和浮絲藻(Planktothrix),3個藻屬的mcy基因均已測序和鑒定出來,各個藻屬mcy基因的基因單元在結構上是相似的,但是在基因的排列上略有不同(圖2)。在基因單元方面,對比3個藻屬可以發現,浮絲藻屬無mcyF和mcyl基因,而多了mcyT基因。在基因排列上,微囊藻屬和魚腥藻屬的兩個操縱子呈相反方向排列,而浮絲藻屬的操縱子呈單向排列(mcyT除外)。
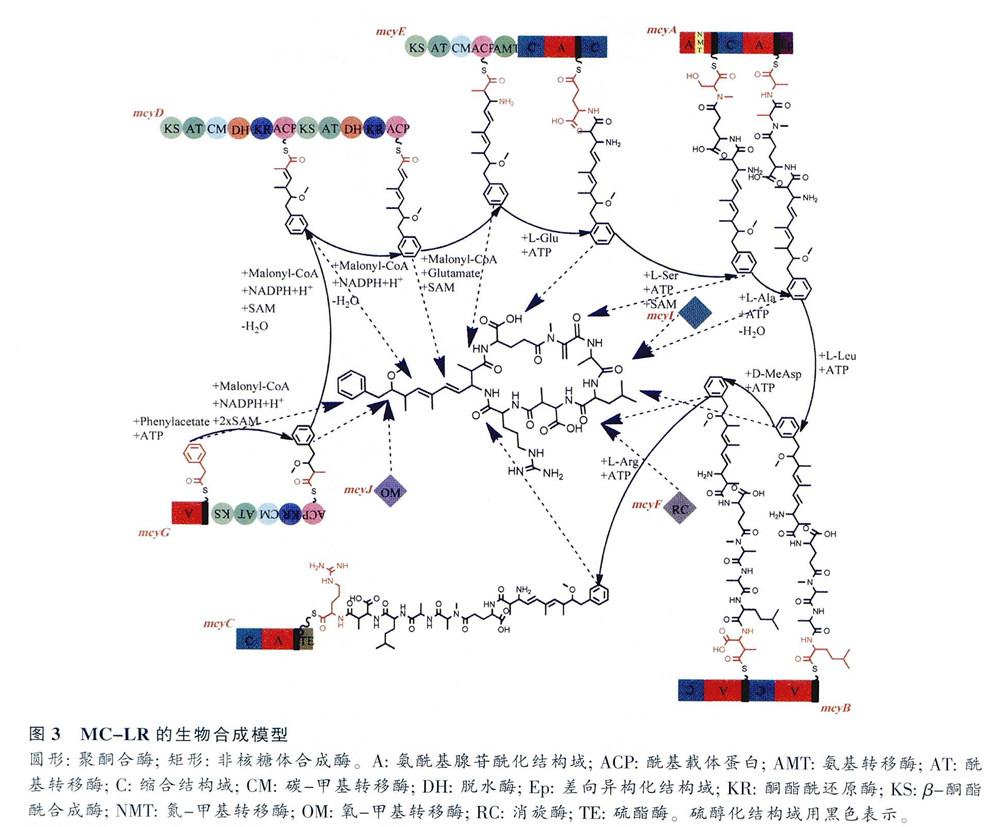
下面以微囊藻PCC7806合成微囊藻毒素(MC-LR)為例,根據mcy基因參與合成的順序詳細介紹這10個基因以及它們在合成中的作用(圖3)。mcyG、mcyD和mcyE共同完成Adda的合成;mcyE還參與D—谷氨酸和L-絲氨酸的加入;mcyA參與Mdha的加入;mcyB參與L一亮氨酸和MeAsp的加入;mcyC參與L-精氨酸的加入,并完成環化,最終完成MC-LR的合成。
2.1 mcyG
Adda是微囊藻毒素毒性表達所必需的基團,根據相關酶的同源性和生物信息學的分析,Adda在,mcyG、mcyD、mcyE和mcyJ的共同作用下合成,mcyG完成其第一步合成。mcyG位于mcyF上游,全長7 896 bp,編碼294 266 D的多肽,為PKS和NRPS。mcyG氨基末端的NRPS模塊含有氨酰基腺苷酰化結構域(amiinoacyl adenylation,A),利用ATp,活化苯丙素,活化的苯丙素被轉移至硫醇化結構域(thiolation),之后進入PKS通路。活化的苯丙素單元隨后在丙二酰輔酶A (malonyl-CoA)的延伸作用以及mcyD、E、G的PKS通路的修飾下逐漸延伸。PKS含有β一酮酯酰合成酶(β -keloacyl synthase,KS)、酰基轉移酶(acyltransferase,AT)、C-甲基轉移酶(C-methyltransferase,CM)、酮酯酰還原酶(β-ketoacyl reductase,KR)和酰基載體蛋白(acyl carrier protein,ACP)結構域。Moore等研究發現,AT結構域可能與丙二酰輔酶A的接收有關。在AT結構域的作用下,丙二酰輔酶A上的丙二酰基團被轉移到ACP結構域上,依次經KS結構域進行脫羧縮合反應、CM結構域編碼C-甲基轉移酶對S-腺苷甲硫氨酸(S-adenosyl-L-methionine, SAM)進行甲基化作用、KR結構域進行州還原作用,完成第一個丙二酰輔酶A延伸,從而完成Adda的第一步合成。
2.2 mcyJ
mcyJ與mcyG的PKS協同完成Adda第一步合成,位于mcyI上游,全長837 bp,編碼31 904D的多肽。mcyJ包含一個O-甲基轉移酶(O-melllyltransferase,OM)結構域。該結構域編碼O-甲基轉移酶,將SAM上的甲基催化轉移到Adda的側鏈上。
2.3 mcyD
mcyD進行Adda合成的第二步,是mcyD-J中第一個開放閱讀框,位于mcyA上游,全長11 721 bp,編碼435 714 D的多肽,具有PKS的功能。mcyD上有著兩組PKS模塊,都包含KS、AT、KR、脫水酶(dehydratase,DH)和ACP結構域,另外在第一個PKS模塊上還有一個CM結構域。第一個PKS模塊中,第一步合成產物被運送至ACP結構域上,AT結構域進行丙二酰基團的添加,KS、DH和KR結構域分別進行脫羧、脫水和酮還原作用.再加上CM結構域對SAM進行的甲基化作用,完成這一階段的修飾。之后產物被轉移至第2個PKS模塊的ACP結構域卜,經AT、KS、DH和KR域的再次作用,完成在mcyD上鏈的延伸步驟,完成Adda的第二步合成
2.4 mcyE
mcyE完成對Adda的合成,并將D-谷氨酸結合到Adda上。mcyE位于mcyD上游,全長10 464 bp,編碼392 703 D的多肽,具有PKS和NRPS的功能。mcyE的氨基端帶有一組含有KS、AT、CM和ACP結構域的PKS模塊,以及mcyE所特有的氨基轉移酶(aminotransferase,AMT)結構域。mcyE上還有一個NRPS模塊,包含兩個A結構域、一個C結構域和一個硫醇化結構域。mcyD上合成的產物轉移至mcyE上ACP結構域,在AT結構域作用下完成最后一次的丙二酰集團的添加,加上KS結構域的脫羧反應,以及CM結構域對SAM的甲基化作用,完成Adda的合成AMT結構域大約430個氨基酸,主要作用是將氨基運送到Adda 上,將Adda 由L一酮酯酰鏈經轉氨反應轉換成L-氨酰基硫酯鏈,定位于NRPS模塊的硫醇化結構域。對NRPS模塊的A結構域進行分析,發現其類似于脂肽和地衣芽孢桿菌索合成酶中的谷氨酸激活域。第一個C結構域催化了Adda和D-谷氨酸上α-氨基之間肽鍵的形成,從而使D -谷氨酸和Adda結合;第二個C結構域與mcyA上的結構域合作,是用來催化D一谷氨酸和N-甲基化絲氨酸之間肽鍵的形成,使L一絲氨酸加到合成鏈上。mcyE上帶有整個mcy基因簇上獨有的AMT結構域,與其他部位的同源性較低,在PCR擴增時不容易導致錯配情況的發生,因此微囊藻毒素分子檢測常針對mcyE設計引物。
2.5 mcyF
mcyF完成對MeAsp的異構化,位于mcyE上游,全長756 bp,編碼28 192 D的多肽。mcyF包含一個消旋酶(racemase,RC)結構域,最初認為其編碼谷氨酸消旋酶,負責L-谷氨酸的異構化。然而,后期研究發現其編碼的是天冬氨酸消旋酶,作用于MeAsp的異構化。而L一谷氨酸的異構化被確認是由mcy基因簇外的一個谷氨酸消旋酶完成的,此谷氨酸消旋酶存在于所有的藍藻之中。
2.6 mcyA
mcyA使Mdha加入合成鏈,是mcyA -C操縱子中第一個開放閱讀框,全長8 388 bp,編碼315 717 D的多肽,具有NRPS功能,包含兩個A結構域和硫醇化結構域,一個C結構域,一個mcyA特有的N-甲基轉移酶(N-methyltransferase,NMT)結構域,以及一個差向異構化結構域(epimerization,Ep)。NMT結構域在一些真菌和細菌中也存在,比較發現微囊藻毒素的NMT域與它們有著高度同源性。NMT結構域編碼N-甲基轉移酶.使L-絲氨酸和L-丙氨酸甲基化,成為N -甲基化絲氨酸和N一甲基化脫氫丙氨酸,另外其還作用于SAM。第1個A結構域作用是活化L-絲氨酸,NMT結構域對其進行N-甲基化作用,L-絲氨酸變為N-甲基化絲氨酸,再由第一個硫醇化結構域轉運,最后經mcyE的C結構域作用,加入合成鏈;第2個A結構域參與L一丙氨酸的活化,經Ep結構域的異構化作用成D一丙氨酸,再經NMT域的甲基化作用,mcyl的脫氫作用,由第2個硫醇化結構域轉運,最后mcyA的C結構域完成對N-甲基化脫氫丙氨酸的縮合,Mdha加到合成鏈上。NMT結構域與mcyE的AMT結構域情況類似,也是分子檢測中選擇比較多的檢測區域。但是由于真菌和細菌中也存在NMT結構域,因此一般在利用分子技術檢測微囊藻毒素的初期較為常見,近年來針對mcyE的AMT結構域的分子檢測更為普遍。
2.7 mcyI
mcyI位于mcyH上游,傘長1 014 bp,編碼36 838 D的多肽,其對mcyA上N-甲基化丙氨酸的進行脫氫作用。
2.8 mcyB
mcyB使L-亮氨酸和MeAsp加入合成鏈,位于mcyA下游,全長6 318 bp,編碼242 334 D的多肽,具有NRPS功能,包含兩個NPRS模塊,每個模塊都有一個A、硫醇化和C結構域。微囊藻PCC7806產生的MC-LR在可變氨基酸的位置是L-亮氨酸和L-精氨酸,在mcyB的作用下L-亮氨酸加入到合成鏈上。第1個A結構域的作用就是激活L-亮氨酸,第1個C結構域接收來自mcyA的D-丙氨酰基中間體,催化L-亮氨酸和D-丙氨酰基中問體之問肽鍵的形成,從而使L-亮氨酸加入到合成鏈上。第2個A結構域激活MeAsp,而第2個C結構域完成對MeAsp的縮合,使其加到多肽鏈上。正是由于mcyB作用下加入到合成鏈上的氨基酸有所不同,微囊藻毒素的異構體高達90多種。而不同的異構體也給微囊藻毒素的檢測帶來了很大的麻煩,高效液相色譜法(high performance liquid chromatography, HPLC)檢測微囊藻毒素,一般只是針對毒性較大且常見的MC-LR、RR和YR 3種異構體進行的。
2.9 mcyC
mcyC使L-精氨酸加入合成鏈,并完成環化步驟。mcyC位于mcyB下游,全長3 876 bp,編碼147 781 D的多肽,具有NRPS功能,包含C、A和硫醇化結構域,另外在羧基末端還有mcyC所特有的約240個氨基酸的硫酯酶(thioesterase,TE)結構域。A結構域活化L-精氨酸,C結構域將其最終連接到多肽鏈上。最后在TE結構域作用下,進行縮合反應,完成最后環化的步驟,從而完成MC-LR的合成。
2.10 mcyH
mcyH位于rncyG上游,全長1 617 bp,編碼67 100 D的多肽,為跨膜蛋白,屬于ABC轉運蛋門家族。mcyH的作用仍不明確,推測其可能在類囊體定位方面或者是在微囊藻毒素的的釋放上起著重要作用。
微囊藻毒素合成基因以一定的順序排列,每個基因由不同作用的結構域組成,通過一步步的反應,協同作用最終完成微囊藻毒素的合成。微囊藻毒素的生物合成共需要48個反應,其中45個反應是由mcyA-E和mcyC完成的,另外的4個mcy基因也各自起著重要的作用。其中mcyD-J操縱子主要完成毒性基團Adda的形成,而mcyA一C操縱子主要完成氨基酸的加入以及環化的步驟。對微囊藻毒素合成基因以及基因功能的充分研究,為利用PCR技術檢測微囊藻毒素奠定了堅實的基礎。
3 微囊藻毒素的分子檢測
目前,微囊藻毒素的檢測方法主要有HPLC和酶聯免疫吸附法(enzyme linked immunosorbentassay,ELISA),兩者都能有效地檢測出微囊藻毒素的情況,但是對設備、技術以及資金的要求較高。隨著聚合酶鏈式反應(polymerase chain reac-tion,PCR)技術的發展,同時微囊藻毒素的毒基因mcy也已經被研究分析得比較透徹,數據庫中存在各個產毒藻屬mcy基因的序列,為運用分子生物學的方法研究產毒藍藻提供了很好的基礎利用PCR技術檢測微囊藻毒素的研究已經有很多,并取得了一定的成果。該方法能夠迅速、靈敏可靠的完成對微囊藻毒素的檢測,相較于HPLC和ELISA方法,PCR方法更經濟,且對技術的要求較低。綜合諸多優勢,運用PCR技術榆洲微囊藻毒素具有良好的發展前景,但還需要更深入的研究。
3.1 普通PCR檢測方法
PCR技術是一種體外快速擴增特定DNA片段的方法,已經廣泛運用于產毒藍藻的檢測中,相比于HPLC和ELISA等方法,該技術靈敏度更高,檢測速度更快,還能夠在毒素釋放前進行預測。通過對mcy基因片段設計特異性引物,運用PCR技術擴增目的片段,根據是否能夠得到目的片段來定性檢測藍藻是否具有產毒能力。運用PCR技術檢測產毒藍藻是從檢測產毒微囊藻開始的,后運用到產毒魚腥藻和產毒浮絲藻的檢測,以及多種產毒藍藻的同時檢測。Tillett等研究了微囊藻產毒和進化之間的關系,分別針對mcyA的NMT結構域、16S rRNA和PC-IGS設計引物,對純培養的37株微囊藻進行PCR擴增,發現其中18株包含產毒基因。將NMT基因與l6S rRNA和PG-IGS基因擴增出的序列分別建樹分析,發現產毒藍藻和非產毒藍藻無規律分布于樹上。Kurmayer等對澳大利亞Irrsee和Mondsee湖分離純培養的浮絲藻進行PCR擴增,發現49株紅色浮絲藻(Planktothrix Rubescens)都包含mcy基因,而23株阿氏浮絲藻(Planktothrix agardhii)中,有的包含mcy基因,有的沒有。在PCR檢測結果陽性的情況下,進行HPLC、MALDI-TOF質譜以及蛋白磷酸酶抑制實驗,發現在兩個藻種中都存在假陽性情況,即PCR檢測陽性,而實際并未產生微囊藻毒素。這種情況的出現可能是基因存在部分缺失,或者是環境因素對基因表達造成了抑制,從而無法完成微囊藻毒素的合成。Hisbergues等針對mcyA的縮合結構域設計引物,對52株純培養的藍藻進行擴增,包含24株微囊藻、8株魚腥藻、11株浮絲藻、2株念珠藻和7株節球藻。結果發現11株微囊藻、6株魚腥藻、8株浮絲藻和1株念珠藻,共26株藍藻PCR檢測結果為陽性,其方法適用于同時檢測微囊藻屬、魚腥藻屬以及浮絲藻屬中的產毒情況。在方法上,除了常規的PCR方法,還有多重PCR和全細胞PCR的方法運用到產毒藍藻的檢測上。潘卉等針對mcyB設計引物.對30株純培養的微囊藻進行全細胞PCR擴增.其中18例陽性,與HPLC和ELISA檢測結果一致。該實驗在方法上進行了創新,水樣不進行任何前處理,不需要提取藻的DNA,直接進行全細胞PCR。同時,該研究發現在每毫升微囊藻細胞數在2 000左右時該方法仍能靈敏檢測:Rinta-Kanto等運用微囊藻16S rDNA、mcyB和mcyD的引物,對來自美國Erie湖以及加拿大共16個采樣點的水樣進行多重PCR,檢測微囊藻以及產毒微囊藻的存在情況,發現所有水樣3個基因的檢測結果都為陽性。
3.2 定量PCR檢測方法
定量PCR,是在普通PCR的基礎上,在反應過程中加入熒光染料或熒光標記的特異性探針,通過對熒光信號的監測,根據熒光信號來精確定量起始模板數。運用定量PCR的方法,不僅能夠定性檢測藍藻是否產毒,還能夠對產毒藍藻進行定量分析.預測水體的產毒能力。Vaitomaa等通過定量PCR的方法研究芬蘭的Tuusulanjarvi和Hiidenvesi湖中產毒藻屬和mcy的拷貝數。研究發現.Tuusulanjarvi湖的主要微囊藻毒素生產者是微囊藻屬.微囊藻屬的mcyE基因拷貝數在魚腥藻屬的30倍以上,而Hiidenvesi湖中產毒微囊藻和產毒魚腥藻的拷貝數比較接近。兩湖的微囊藻毒素濃度與微囊藻和魚腥藻mcyE基因拷貝數呈正相關.因此,認為mcyE基因拷貝數能夠用來表示產毒微囊藻和產毒魚腥藻的數量。Ha等研究魚塘中產毒微囊藻以及微囊藻總體的變化,分別針對mcyA和16S rRNA基因進行定量PCR。通過細胞顯微計數以及定量PCR的方法,對銅綠微囊藻(Microcystis aeruginosa) NIES 102進行純培養研究發現,兩種基因拷貝數與細胞數量有一定對應關系。因此.通過16S rRNA和mcyA 基因拷貝數預估了魚塘中的微囊藻和產毒微囊藻數量,發現微囊藻毒素的濃度與mcyA的拷貝數有著高度聯系,產毒微囊藻大約占微囊藻總體的80%,.Fortin 等運用定量PCR方法研究2006年和2007年夏天加拿大Missisquoi灣的產毒藍藻情況,發現2006年8月mcyDKS基因為6.5 xl0 4copies/mL,9月為4.Oxl0 4 copies/mL,而此時微囊藻毒素濃度分別為4μg/L和2μg/L。2007年的水樣中mcyDKS只有3x10 2 copies/mL,而微囊藻毒素濃度通過HPLC幾乎檢測不到。由此可見,當微囊藻毒素濃度低于HPLC的檢測限度時,HPLC很難完成對湖水情況的分析.而此時定量PCR方法依然能夠很好地檢測到產毒藍藻的情況-Sipari等在Tuusulanjarvi湖的水樣中鑒定出產毒微囊藻和產毒魚腥藻,針對mcyE基因運用探針法的定量PCR技術進行檢測,提取藻樣DNA檢測產毒藍藻存在情況,提取藻樣RNA檢測產毒藍藻的表達情況。結果發現,在8、9月份微囊藻毒素濃度達到最大,同時水體中mcyE的拷貝數也達到最大,并且mcyE在表達水平上也是如此。在7月初,微囊藻毒素濃度最低時,末發現mcyE的表達。
3.3 基因芯片檢測方法
基因芯片將大量探針分子同定于支持物上,再與樣品分子進行雜交,通過檢測每個探針分子的雜交信號強度從而得到樣品分子的數量和序列信息。由于基因芯片技術同時固定了大量的探針分子,因此其可以一次性對樣品中大量的基因序列進行檢測。Rantala等針對微囊藻、魚腥藻、浮絲藻以及念珠藻(No.s toc)的mcyE基因和節球藻的ndaF基因設計多對探針,將其固定在基因芯片上。檢測10個湖泊的水樣,發現6對探針能夠可靠地檢測出對應的產毒藍藻基因,并且具有很高的靈敏度。基因芯片的特異性、靈敏度以及同時檢測多種產毒藍藻的能力使其能夠加快對大樣本量水樣的檢測,能夠用于同時檢測大量的產毒藍藻,為產毒藍藻檢測提供了高通量平臺。
4 展望
微囊藻毒素由于其危害巨大,受到國內外廣泛關注和研究。微囊藻毒素合成基因的成功測序,為產毒藻的生態研究提供了理論基礎,并為新檢測技術的開發奠定基礎。微囊藻毒素的分子檢測已經從最初的PCR檢測技術,發展到基因芯片進行高通量的檢測。分子檢測相對于HPLC和ELLSA檢測有很多優勢,即使在產毒藍藻濃度很低的情況下,也能夠靈敏可靠檢測到產毒藍藻的情況,實施對水體的實時監控,從而對微囊藻毒素進行提前預警,對微囊藻毒素進行有效的預防。目前利用分子檢測只能量化產毒微囊藻的數量以及其在種群中所占比例.預測的是潛在的產毒能力。如何利用分子生物學技術,進行水體中微囊藻毒素濃度的檢測,還需要進一步的研究。微囊藻毒素的分子檢測方法目前還多應用于實驗室研究階段,我們需要發展一種快速、簡便、高通量、低成本的微囊藻毒素的檢測方法,能夠很好地應用于各水質監測中心,這將是未來研究努力的方向。另一方面,微囊藻毒素合成機制已經研究得很透徹,針對這方面設計出相應的阻斷方法,比如破壞合成酶的活性,沉默合成基因等,從而控制甚至消除微囊藻毒素,是未來研究的新方向。這都需要更多科研工作者的努力,從而能夠更好地監測水體微囊藻毒素的情況,為微囊藻毒素的治理奠定更好的基礎。

