新型生物可降解雷帕霉素藥物洗脫輸尿管支架的構建及性能評估
王忠新,譚海頌,曹 磊,許永德,李 鋼,符偉軍,王曉雄
(1.中國人民解放軍總醫院海南分院泌尿外科,海南 三亞 572014;2.中國人民解放軍總醫院泌尿外科,北京 100853;3.中國人民解放軍第309醫院泌尿外科,北京 100091)
新型生物可降解雷帕霉素藥物洗脫輸尿管支架的構建及性能評估
王忠新1,2,譚海頌2,曹 磊2,許永德2,李 鋼3,符偉軍1,2,王曉雄2
(1.中國人民解放軍總醫院海南分院泌尿外科,海南 三亞 572014;2.中國人民解放軍總醫院泌尿外科,北京 100853;3.中國人民解放軍第309醫院泌尿外科,北京 100091)
目的 構建一種新型生物可降解雷帕霉素藥物洗脫輸尿管支架并評估其機械性能及藥物釋放特性。方法 采用聚乳酸為原料,將其溶于氯仿后加入雷帕霉素粉末,通過溶液揮發法構建螺旋形生物可降解雷帕霉素藥物洗脫輸尿管支架。通過萬能壓力機檢測新型生物可降解雷帕霉素輸尿管支架力學性能,并分別在3周、6周、9周和12周時通過色譜分析儀評估其藥物釋放特性。結果 成功構建的生物可降解雷帕霉素藥物洗脫輸尿管支架,長度為50 mm,內徑為0.8 mm,外徑1.4 mm,厚度為200 μm,帶寬為1 mm。支架不僅具有良好的力學性能,并可有效持續釋放藥物,支架平均雷帕霉素含量為2 755 μg,3周后支架平均含藥量為2 670 μg,6周后支架平均含藥量為2 533 μg,9周后支架平均含藥量為1 541 μg,12周后支架平均含藥量為744 μg。結論 構建的生物可降解雷帕霉素藥物洗脫輸尿管支架具有良好的機械性能,可有效釋放藥物,有望為輸尿管損傷或狹窄的治療提供一種新的簡單有效的材料和方法。
生物可降解;藥物洗脫支架;輸尿管支架
1978年,現代化的雙豬尾支架被Finney首次報道,隨后各種類型的輸尿管支架廣泛應用于泌尿外科多個領域[1]。輸尿管損傷或狹窄可能會造成損傷側上尿路的梗阻,從而導致腎積水及腎功能受損等一系列并發癥發生。輸尿管支架廣泛應用于輸尿管損傷或狹窄治療中,其可用來恢復并維持上尿路的通暢引流。雙J管是目前臨床上應用最廣泛的一種輸尿管支架類型,它可有效維持尿路通暢引流。但隨著輸尿管支架的廣泛應用,支架相關的一些并發癥,如腰背痛、血尿、尿頻、尿急以及膀胱輸尿管返流、支架移位、被覆皮殼、尿路感染甚至上皮細胞增生和纖維化導致再狹窄等,嚴重影響患者的生活質量,已成為制約支架進一步應用的主要因素[2-3]。
為了盡可能地避免這些支架相關并發癥的發生,各種類型的材料被嘗試用于構建輸尿管支架,包括生物可降解材料、各種涂層材料及藥物緩釋材料等。藥物緩釋支架技術近來取得了顯著的進展,有望顯著降低支架相關并發癥發生率[4]。因此,本研究在前期成功構建的單純生物可降解輸尿管支架基礎上,進一步探討生物可降解藥物洗脫輸尿管支架的構建,期望為輸尿管損傷和狹窄的治療提供一種新的材料,不僅可有效恢復并維持輸尿管管腔通暢,還能顯著降低支架相關并發癥的發生。
1 材料與方法
1.1 新型生物可降解藥物洗脫輸尿管支架制備 將黏度分子量為15×104g/mol的左旋聚乳酸(L-polylactic acid,PLLA)和消旋聚乳酸(PDLLA)按2:1的比例混合后,聚乳酸混合物溶于氯仿,配制成2%(g/ml)的溶液,加入雷帕霉素純品粉末。攪拌24 h后,將懸濁液按照1 ml/cm3的比例傾倒在玻璃模具中,在23℃~28℃、相對濕度20%的條件下揮發形成薄膜,薄膜被進一步塑形成約1 mm寬度帶狀結構,再將其纏繞定形為螺旋型結構。后放入真空烘箱,65℃干燥21 d,包裝后60Co滅菌,備用。
1.2 新型生物可降解藥物洗脫輸尿管支架的力學性能測定 調定萬能壓力機(INSTRON),以10 mm/min的加壓速度,勻速壓縮螺旋形支架。當被測試支架管壓縮形變達到25%時,測量所得壓力為支架側壓25%變形時的力,測量3次,取平均值。
1.3 藥物洗脫支架有效藥物釋放量測定 將12根生物可降解雷帕霉素輸尿管支架隨機分為三組,每組4根。在3周、6周、9周、12周時,分別從三組中各選取一根支架測定其有效藥物釋放量。將雷帕霉素藥物洗脫支架放于離心管中,用足量氯仿溶解。開口通風干燥72 h使氯仿完全揮發,用甲醇20 ml完全溶解離心管中的雷帕霉素。標準品用甲醇溶解成10μg/ml。使用HPLC(Aglient l100,Agilent Technologies)色譜分析儀檢測支架的藥物釋放情況。HPLC檢測條件:色譜柱,Alltech C18反相性;流動相,乙腈:水=60:40;檢測波長,278 nm;恒溫箱,30℃;流速,l.2 ml/min。進樣量:標準品進樣10μl,測試樣品進樣10μl。計算公式:支架載藥量(μg)=200×樣品檢測值/標準品檢測值。取3次測試的平均值為支架藏藥量。
2 結果
2.1 生物可降解藥物洗脫輸尿管支架的構建 制備的新型生物可降解藥物洗脫輸尿管支架長度為50 mm,外徑為1.4 mm,內徑為0.8 mm,厚度為200μm,帶寬1 mm(圖1)。

圖1 新型生物可降解雷帕霉素輸尿管支架實物圖及示意圖
2.2 生物可降解藥物洗脫輸尿管支架的力學性能測定結果 新型生物可降解藥物洗脫輸尿管支架管發生25%形變時,需要的平均載荷壓力為174 N(見圖2)。

圖2 新型生物可降解藥物洗脫輸尿管支架3次25%形變時的載荷壓力
2.3 支架有效藥物釋放量測定結果 采用HPLC(Aglient 1100)色譜分析儀檢測支架含藥量,測試的平均值見圖3~圖8。新型生物可降解藥物洗脫輸尿管支架含有雷帕霉素2 755μg,3周后支架含藥量為2 670μg,6周后支架含藥量為2 533μg,9周后支架含藥量為1 541 ug,12周后支架含藥量為744μg。可見,生物可降解雷帕霉素藥物輸尿管支架成功構建,支架可有效釋放藥物,早期藥物釋放平緩,后期快速釋放。

圖3 標準樣品檢測圖

圖4 測試樣品檢測圖:雷帕霉素含量為2 755 μg

圖5 3周時測試樣品檢測圖:雷帕霉素含量為2 670 μg
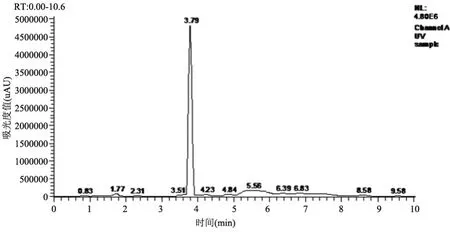
圖6 6周時測試樣品檢測圖:雷帕霉素含量為2 533 μg

圖7 9周時測試樣品檢測圖:雷帕霉素含量為1 541 μg

圖8 12周時測試樣品檢測圖:雷帕霉素含量為744 μg
3 討論
各種類型的輸尿管支架目前已被廣泛用于輸尿管損傷或狹窄的治療中,因為無論輸尿管管腔阻塞是由于外源性因素還是內源性因素導致,支架都是一種最簡單的恢復并維持腎盂輸尿管通暢引流的微創手段。但前期研究表明局部尿路上皮增生是支架植入后最主要的問題,支架植入后的長期慢性刺激會影響到輸尿管的尿路上皮、黏膜層及肌肉層,嚴重制約支架的長期應用。隨著生物材料和組織工程技術的發展進步,心血管領域應用的支架很好地將藥物緩釋與各種涂層技術結合在一起,試圖來預防心血管支架最常見的并發癥,即內皮增生和再狹窄的發生,并表現出不錯的應用前景[5]。但目前關于生物可降解藥物輸尿管支架的研究仍處于嘗試階段,因此本研究擬探討一種新型生物可降解雷帕霉素輸尿管支架的構建,進而評估其力學性能和藥物釋放特性。
藥物緩釋支架通常由支架平臺、藥物載體和荷載藥物三部分組成[6]。支架平臺和藥物載體在實現藥物可控釋放的同時,也可能會誘導機體促炎癥反應,因此需要探索生物相容性更佳的材料來構建支架平臺和藥物載體。完全生物可降解聚合物材料,比如聚乳酸(PLA)和聚乳酸-羥基乙酸共聚物(PLGA),在機體內最終都可降解代謝為二氧化碳和水,具有很好的生物相容性。本研究中構建的新型藥物洗脫輸尿管支架,其支架平臺和藥物載體采用的材料均為聚乳酸。聚乳酸廣泛分布在自然界中,因其有不對稱取代的碳原子,因而以左旋聚乳酸(L)和消旋聚乳酸(D)兩種對映異構體形式存在。PLLA是半結晶性,其力學強度大,而PDLLA為無定形形態,其力學強度低,因而這兩種異構體在降解速度上有明顯差異[7]。本研究中支架構建所采用的材料為PLLA和PDLLA的共聚物,其物理特性取決于這兩種異構體形態的相對含量。隨著PDLLA含量的增加,這種共聚物材料的無定形部分和降解速度也會隨之增加。生物可降解聚合物聚乳酸(PLA)已被證實具有很好的生物相容性,它被用于制作縫合材料已經30多年[8]。本研究中構建的新型生物可降解藥物輸尿管支架是以PLLA和PDLLA按比例混合作為原材料,這樣不僅保證了支架的機械強度,以實現對輸尿管腔的有效支撐作用,同時調控了支架的降解速度。
多種活性藥物被作為荷載藥物來構建藥物緩釋支架,包括紫杉醇和雷帕霉素等。雷帕霉素是一種大環內酯類免疫抑制劑,能阻斷細胞由G1期向S期轉化,從而抑制細胞增殖和遷移,使細胞靜止在增殖周期的早期階段但并不破壞細胞。這些特點使得雷帕霉素能成為一種較為理想的支架荷載藥物。一個理想的藥物緩釋支架,其藥物釋放動力學應與再狹窄形成過程相一致,因此,一個可控的藥物釋放系統是藥物緩釋支架構建過程中的重要組成部分。目前常用的可控給藥系統包括擴散控制或聚合物降解和滲透壓控制或離子交換等。基于支架的給藥方法也有很多種,主要包括非聚合物藥物涂層、藥物共價附著(交聯劑)、聚合物涂層藥物浸泡、非吸收性或吸收性的聚合物載體[9]。采用生物可吸收性聚合物作為載體來運載藥物通常可獲得最佳的和持續的藥物釋放。將活性藥物摻和到生物可降解藥物載體基質聚合物中,實現將藥物裝載到支架上。生物可降解聚合物交聯的程度提供了調控藥物釋放速度的一種方法。生物可降解載體基質形成互聯孔隙,便于藥物微小顆粒的溶解,實現藥物從聚合物上可控的釋放[10]。生物可降解聚合物降解的同時釋放藥物,而聚合物的降解物最終通過代謝途徑排出機體[11]。支架的降解速度由聚合物鏈的水解作用決定,而藥物的釋放速度則由支架的降解速度決定。這樣,通過調控支架的降解速度,便能控制藥物的釋放速度,支架的降解速度以及藥物支架的藥物釋放特性應與愈合過程相一致[12]。
本研究構建的生物可降解雷帕霉素輸尿管支架即采用將藥物與載體基質摻和的方法實現藥物裝載。同時根據輸尿管損傷或狹窄治療中,輸尿管支架管通常留置3個月左右的臨床實際,本研究中構建的生物可降解藥物輸尿管支架預期降解時間為12周。支架有效藥物釋放量測定結果表明,隨著支架的降解,藥物可有效從支架上釋放出來,前6周時釋放的藥物量占總藥量的10%左右,后6周時釋放的藥物量占總藥量的70%。由此可見,支架上的藥物釋放特征是早期緩慢釋放,后期快速釋放。藥物的釋放可以通過溶出、溶蝕及擴散等機制實現。本研究中,生物可降解支架載荷藥物的釋放是通過擴散機理和支架的不斷降解溶蝕實現的。后期隨著聚合物材料的降解加速,藥物被快速釋放出來。這種藥物釋放特性避免了早期藥物突然釋放對輸尿管損傷處黏膜愈合的影響,同時后期藥物快速釋放可有效降低支架相關性上皮增生反應,從而降低輸尿管再狹窄的發生。
此外,前期上尿路壓力流率研究表明在支架植入后的輸尿管,當排尿等動作引起膀胱內壓增加時,其膀胱內壓會直接傳導至腎盂,因此長段輸尿管支架,比如雙J管可能會增加腎盂內壓力,導致輸尿管積水和膀胱輸尿管返流。短段的支架構型會提供更好的抗返流效果。本研究構建的新型生物可降解藥物輸尿管支架采用短段構型,并未直接完全破壞腎盂及輸尿管的蠕動和抗返流機制,可能會預防膀胱輸尿管返流,但需進一步相應研究來證實。
由上可見,新型生物可降解藥物輸尿管支架采用具有良好生物相容性的聚乳酸為原料來構建支架平臺和藥物載體,不僅具有良好的機械性能及可自行降解避免二次手術取出等優點,還可有效持續釋放藥物,有望為輸尿管損傷或狹窄的治療提供一種新的簡單有效的材料和微創方法。
[1]Chew BH,Duvdevani M,Denstedt JD.New developments in ureteral stent design,materials and coatings[J].Expert Rev Med Devices, 2006,3(3):395-403.
[2]Ozgur BC,Ek?c? M,Yuceturk CN,et al.Bacterial colonization of double J stents and bacteriuria frequency[J].Kaohsiung J Med Sci, 2013,29(12):658-661.
[3] Soria F,Morcillo E,Pamplona M,et al.Evaluation in an animal model of a hybrid covered metallic ureteral stent:a new design[J]. Urology,2013,81(2):458-463.
[4]Lange D,Chew BH.Update on ureteral stent technology[J].Ther Adv Urol,2009,1(3):143-148.
[5]Schurtz G,Delhaye C,Hurt C,et al.Biodegradable polymer Biolimus-eluting stent(Nobori?)for the treatment of coronary artery lesions:review of concept and clinical results[J].Med Devices (Auckl),2014,27(7):35-43.
[6]Kukreja N,Onuma Y,Daemen J,et al.The future of drug-eluting stents[J].Pharmacol Res,2008,57(3):171-180.
[7]Cutright DE,Perez B,Beasley JD,et al.Degradation rates of polymers and copolymers of polylactic and polyglycolic acids[J].Oral Surg Oral Med Oral Pathol,1974,37(1):142-152.
[8]Kulkarni RK,Pani KC,Neuman C,et al.Polylactic acid for surgical implants[J].Arch Surg,1966,93(5):839-843.
[9]Acharya G,Park K.Mechanisms of controlled drug release from drug-eluting stents[J].Adv Drug Deliv Rev,2006,58(3):387-401.
[10]Lewis AL,Willis SL,Small SA,et al.Drug loading and elution from a phosphorylcholine polymer-coated coronary stent does not affect long-term stability of the coating in vivo[J].Biomed Mater Eng,2004,14(4):355-370.
[11]Tesfamariam B.Drug release kinetics from stent device-based delivery systems[J].J Cardiovasc Pharmacol,2008,51(2):118-125.
[12]Wykrzykowska JJ,Onuma Y,Serruys PW.Advances in stent drug delivery:the future is in bioabsorbable stents[J].Expert Opin Drug Deliv,2009,6(2):113-126.
Construction and performance evaluation of a new biodegradable rapamycin-eluting ureteral stent.
WANG Zhong-xin1,2,TAN Hai-song2,CAO Lei2,XU Yong-de2,LI Gang3,FU Wei-jun1,2,WANG Xiao-xiong2.1.Department of Urology,Hainan Branch of Chinese PLA General Hospital,Sanya 572014,Hainan,CHINA;2.Department of Urology, Chinese PLA General Hospital,Beijing 100853,CHINA;3.Department of Urology,the 309thHospital of Chinese People's Liberation Army,Beijing 100091,CHINA
Objective To construct a new biodegradable rapamycin-eluting ureteral stent and to evaluate its mechanical property and drug-eluting characteristics.Methods Polylactic was selected as the stent material and dissolved by chloroform.The rapamycin powder was added into the solution.Then,a new helical biodegradable rapamycin-eluting ureteral stent was made by volatilization method.The mechanical property of the stent was measured by universal tension tester,while the drug-eluting characteristic was evaluated by chromatographic analysis machine.Results The new biodegradable rapamycin-eluting ureteral stent had good mechanical property with length in 50 mm,inner diameter in 8 mm,outer diameter in 1.4 mm,thickness in 200 μm and width in 1 mm.The stent can continuously release drug.The mean amount of rapamycin of the stent was 2 755 μg.After 3 weeks,the remained mean amount of rapamycin was 2 670 μg.At 6 weeks,it was 2 533 μg and 1 541 at 9 weeks.Eventually,it was decreased to 744 μg at 12 weeks.Conclusion The new biodegradable rapamycin-eluting ureteral stent made of polylactic acid not only has good mechanical property,but also can release drug efficiently,which may provide a new material for the treatment of ureteral strictures.
Biodegradable;Drug-eluting stent;Ureteral stent
R693
A
1003—6350(2014)18—2663—04
10.3969/j.issn.1003-6350.2014.18.1046
2014-07-01)
國家自然科學基金(編號:81070555);北京市自然科學基金資助項目(編號:7142145和2092029);軍隊臨床高新技術重點項目(編號:413DG63J)
符偉軍。E-mail:wangzx301@163.com