一則海洋微生物天然藥物化學(xué)綜合實(shí)驗(yàn)的教學(xué)設(shè)計(jì)
李春遠(yuǎn),丁唯嘉,王秀芳,羅志剛,谷文祥
(1.華南農(nóng)業(yè)大學(xué) 理學(xué)院,廣東 廣州 510642;2.廣東藥學(xué)院 藥科學(xué)院,廣東 廣州 510006)
天然藥物化學(xué)是運(yùn)用現(xiàn)代科學(xué)技術(shù)和方法研究天然產(chǎn)物中活性成分的學(xué)科[1],是中藥學(xué)、藥學(xué)、制藥工程、有機(jī)化學(xué)、應(yīng)用化學(xué)等藥學(xué)或化學(xué)類相關(guān)專業(yè)本科或碩士研究生的一門專業(yè)課,具有很強(qiáng)的實(shí)踐性,其中的天然藥物主要是指陸生中草藥。隨著研究的深入,藥物資源從陸地拓展到海洋,為適應(yīng)這種新的進(jìn)展,《天然藥物化學(xué)》(第5版,人民衛(wèi)生出版社)教材新增了第十章“海洋天然產(chǎn)物”[2]。天然藥物化學(xué)實(shí)驗(yàn)課程在天然藥物化學(xué)教學(xué)中占有重要的地位,是理論知識(shí)和實(shí)際操作的紐帶,通過實(shí)驗(yàn)不僅能夠使學(xué)生掌握天然藥物有效成分提取、分離和結(jié)構(gòu)鑒定的基本操作技能,而且能夠更好地培養(yǎng)學(xué)生的科學(xué)思維以及創(chuàng)新意識(shí)與創(chuàng)新能力[3]。然而目前國內(nèi)各高校開設(shè)的天然藥物化學(xué)成分提取分離實(shí)驗(yàn)的研究對(duì)象主要包括大黃、槐米、漢防己、麻黃、肉蓯蓉等,幾乎全部為陸生植物,少有報(bào)道在天然藥物化學(xué)實(shí)驗(yàn)教學(xué)中開設(shè)有關(guān)微生物或海洋天然產(chǎn)物的實(shí)驗(yàn)內(nèi)容,學(xué)生缺乏對(duì)微生物及海洋天然產(chǎn)物研究意義和研究方法的直觀認(rèn)識(shí),不利于對(duì)天然藥物化學(xué)課程相關(guān)內(nèi)容的學(xué)習(xí)。我們提出在天然藥物化學(xué)、天然有機(jī)化學(xué)等相關(guān)專業(yè)的實(shí)驗(yàn)課程中,優(yōu)選實(shí)驗(yàn)內(nèi)容開設(shè)海洋微生物天然產(chǎn)物提取分離綜合性實(shí)驗(yàn),以充分發(fā)揮實(shí)驗(yàn)教學(xué)平臺(tái)的作用,促進(jìn)學(xué)生對(duì)天然藥物化學(xué)更加全面深刻的認(rèn)識(shí)。
1 優(yōu)選實(shí)驗(yàn)對(duì)象及實(shí)驗(yàn)?zāi)繕?biāo)產(chǎn)物
傳統(tǒng)海洋天然產(chǎn)物的研究對(duì)象海藻、海綿等無脊椎動(dòng)物[4],數(shù)量有限,采集會(huì)對(duì)生態(tài)平衡造成一定破壞,而以海洋微生物為對(duì)象則具有成本低、可人工發(fā)酵、環(huán)境友好等特點(diǎn)[5]。海洋微生物包括海洋真菌、細(xì)菌等,其中海洋真菌發(fā)酵耗時(shí)長,靜置培養(yǎng)通常需要25d左右,搖床培養(yǎng)也需要14d左右,而細(xì)菌發(fā)酵周期則較短,搖床培養(yǎng)僅需3~7d。因此,從學(xué)生實(shí)驗(yàn)的時(shí)效性考慮,海洋細(xì)菌成為首選。另一方面,作為學(xué)生實(shí)驗(yàn),不宜以未研究過的新奇菌株為對(duì)象。
Bacillus sp.是一類在自然界分布廣泛的革蘭氏陽性菌,其代謝產(chǎn)物絕大多數(shù)為生物堿,種類相對(duì)單一,主要包括環(huán)二肽和大環(huán)脂肽類化合物[6-9]。其中環(huán)二肽等小分子生物堿不僅具有廣泛的抗菌、抗腫瘤等生物活性[10],而且組成單元相對(duì)固定,結(jié)構(gòu)鑒定和分離純化等實(shí)驗(yàn)流程易于重復(fù)。因此,在任課教師科研項(xiàng)目研究成果的基礎(chǔ)上,我們選擇一株分離自湛江海岸泥沙的芽孢桿菌Bacillus sp.ms12為對(duì)象。該菌主要代謝產(chǎn)物為色氨酸和環(huán)(苯丙-脯)二肽,我們以這2種物質(zhì)為目標(biāo)產(chǎn)物,優(yōu)化菌株發(fā)酵條件、優(yōu)選提取分離純化方法,設(shè)計(jì)了適合于相關(guān)專業(yè)本科生和研究生開設(shè)的綜合性實(shí)驗(yàn)方案。
2 優(yōu)化發(fā)酵條件
為提高學(xué)生實(shí)驗(yàn)的效率,先通過單因素法結(jié)合正交試驗(yàn)優(yōu)化了菌株Bacillus sp.ms12的發(fā)酵條件。優(yōu)化后的實(shí)驗(yàn)發(fā)酵條件為:蛋白陳7g,酵母粉3g,牛肉膏3g,葡萄糖2g,海鹽25g,水1 000mL,接種量5%,搖床振蕩培養(yǎng)7d。在上述發(fā)酵條件下,每實(shí)驗(yàn)小組僅需發(fā)酵0.6L即可分別成功分離到10mg左右的色氨酸和環(huán)(苯丙-脯)二肽。無論是發(fā)酵量、發(fā)酵時(shí)間還是目標(biāo)產(chǎn)物產(chǎn)率等,都十分適合學(xué)生綜合性實(shí)驗(yàn)開設(shè)的要求。
3 優(yōu)選提取、分離及純化方法
3.1 采用大孔吸附樹脂進(jìn)行提取
微生物代謝產(chǎn)物提取實(shí)驗(yàn)通常使用有機(jī)溶劑如乙酸乙酯、正丁醇等直接對(duì)發(fā)酵液萃取的方法[11-12],該方法消耗溶劑量大[13]、萃取時(shí)間長、收率低[14],在萃取過程中還經(jīng)常由于相分離不完全而產(chǎn)生乳化現(xiàn)象[15]等。相對(duì)于傳統(tǒng)的有機(jī)溶劑液液提取方法,大孔吸附樹脂由于具有低消耗、高效率、高選擇性、后續(xù)處理簡單并且可再生等優(yōu)勢,在農(nóng)藥、生化藥物的分離純化以及中成藥的制備等方面的應(yīng)用越來越廣泛[16-19]。因此,從學(xué)生實(shí)驗(yàn)高效化、綠色化的角度考慮,我們采用了大孔吸附樹脂法替代有機(jī)溶劑提取法。
根據(jù)文獻(xiàn)報(bào)道,4g的XAD-16型大孔樹脂可吸附高達(dá)1L海洋微生物Chromocleista sp.發(fā)酵液中的環(huán)二肽等小分子含氮化合物[20],表明該樹脂對(duì)小分子生物堿具有優(yōu)秀的吸附能力。我們的預(yù)實(shí)驗(yàn)表明XAD-16樹脂應(yīng)用于菌株Bacillus sp.ms12,對(duì)發(fā)酵液中代謝物質(zhì)的靜態(tài)吸附量可達(dá)到樹脂體積的7~10倍,并且所吸附的生物堿物質(zhì)較易被無毒的洗脫劑乙醇水溶液解吸出來,用2~3倍樹脂體積的70%乙醇的水溶液即可使其基本解吸完全。該方法既克服了液液萃取過程中溶劑揮發(fā)對(duì)環(huán)境的污染,又節(jié)省大量的有機(jī)溶劑,并且樹脂再生后可以繼續(xù)使用,既節(jié)能又環(huán)保。
3.2 引入超聲波法進(jìn)行洗脫分離。
目前對(duì)飽和大孔吸附樹脂解吸主要有動(dòng)態(tài)洗脫和靜態(tài)洗脫2種方式[21]。其中動(dòng)態(tài)洗脫采用飽和樹脂裝柱,然后用蒸餾水及不同洗脫劑將吸附物洗脫出來。這種洗脫方式由于樹脂置于色譜柱中無法使用超聲等加速解吸,需要消耗相對(duì)較多的溶劑和時(shí)間以保證洗脫完全。超聲提取技術(shù)利用超聲波的空化作用可加速欲提取成分的溶出,另外超聲波的次級(jí)效應(yīng),如機(jī)械振動(dòng)、乳化、擴(kuò)散、擊碎、化學(xué)效應(yīng)等,也能加速欲提取成分的擴(kuò)散釋放并充分與溶劑混合,利于提取[22]。因此,有必要在解吸過程中使用超聲波輔助以提高效率。
我們?cè)O(shè)計(jì)采用了動(dòng)靜態(tài)洗脫相結(jié)合的方式:將飽和樹脂置于三角瓶中,先用蒸餾水浸泡,超聲5min,用布氏漏斗抽濾,濾液保留備用;然后將樹脂重新轉(zhuǎn)移至三角瓶中,依次用50%乙醇水(用來除去非目標(biāo)產(chǎn)物的干擾雜質(zhì))、70%乙醇水(洗脫出目標(biāo)產(chǎn)物)及乙醇(洗脫出柱中的其他成分)洗脫劑重復(fù)上述步驟。與普通動(dòng)態(tài)洗脫相比,本方法只用1/3的溶劑即可洗脫出相同的提取量,同時(shí)還節(jié)省了大量的時(shí)間和能源。本步完成后繼續(xù)用蒸餾水對(duì)樹脂進(jìn)行洗滌至無醇味,樹脂即可再次循環(huán)使用。對(duì)于收集到不同洗脫溶劑的濾液采用旋轉(zhuǎn)蒸發(fā)儀代替普通蒸餾裝置進(jìn)行減壓蒸餾,可以在較低的溫度下溫和又快速地對(duì)樣品進(jìn)行濃縮,同時(shí)又減少了因試劑揮發(fā)到空氣中而污染環(huán)境,收集到的試劑還可以回收再利用。
3.3 利用制備薄層純化單體化合物
制備薄層層析原理與柱層析相似,都是利用硅膠吸附性能使得不同物質(zhì)在各種極性溶劑條件下解吸能力差異而進(jìn)行分離純化[23]。在具體實(shí)驗(yàn)操作上,柱層析需要經(jīng)過裝柱、壓柱、上樣、不同溶劑洗脫及洗脫液濃縮檢識(shí)合并等步驟,由于樣品從柱底流出且柱體積相對(duì)較大,導(dǎo)致解吸過程緩慢,需要消耗大量溶劑,耗時(shí)較長。制備薄層層析使用自制或購置的薄層板,由于薄層均勻嚴(yán)實(shí),不存在氣泡,其分離效果要優(yōu)于柱層析。同時(shí)制備薄層置于展開缸中層析,所需溶劑量大大減少,展開后可根據(jù)紫外或顯色劑檢視刮取目標(biāo)物色帶,直接用少量大極性溶劑在短柱中洗出即可。因此相對(duì)而言,制備薄層層析更加簡便快速且綠色化,更適合學(xué)生實(shí)驗(yàn)少量樣品的分離純化。
點(diǎn)樣是制備薄層層析操作的關(guān)鍵,由于分離的樣品量大,一般不使用圓點(diǎn)點(diǎn)樣而采用條帶點(diǎn)樣。若用常規(guī)的玻璃毛細(xì)管或滴管帶狀點(diǎn)樣,容易劃傷薄層,且常出現(xiàn)上樣濃度分布不均勻、上樣帶太寬或不齊等情況,影響分離效果。對(duì)此,我們采取的解決措施為在滴管頭處塞上一小段脫脂棉,慢慢將樣品刷到制備薄層板上。制備薄層層析方法對(duì)菌株Bacillus sp.ms12的70%乙醇水分段提取物進(jìn)行純化,效果良好,在1.5h內(nèi),只用100mL試劑即可獲得15mg色氨酸和8mg環(huán)(苯丙-脯)二肽2種目標(biāo)產(chǎn)物。
4 用核磁共振氫譜法(HNMR)對(duì)實(shí)驗(yàn)產(chǎn)品進(jìn)行表征
核磁共振是天然產(chǎn)物結(jié)構(gòu)鑒定及化學(xué)反應(yīng)機(jī)理研究等最常用的工具之一[24-25],但現(xiàn)有教材提供的天然產(chǎn)物的核磁共振譜圖數(shù)量很少,且多數(shù)比較陳舊,同時(shí)由于不是自己分離得到,學(xué)生在學(xué)習(xí)結(jié)構(gòu)解析時(shí)普遍缺乏興趣,積極性不高。在此現(xiàn)狀下,我們把HNMR融入到海洋微生物代謝產(chǎn)物分離純化實(shí)驗(yàn)教學(xué)中,引導(dǎo)學(xué)生利用所學(xué)的理論知識(shí)解析自己所分離的化合物的結(jié)構(gòu)。
學(xué)生首先對(duì)薄層純化所得產(chǎn)品進(jìn)行薄層檢視,選取薄層層析中斑點(diǎn)單一、純度高的樣品。樣品真空干燥后,裝入核磁管,隨后放入核磁共振儀,依次輸入進(jìn)樣、鎖場、勻場、采樣等指令得到譜圖。教師引導(dǎo)學(xué)生從峰的種類與質(zhì)子、積分高度與質(zhì)子數(shù)、化學(xué)位移數(shù)值與官能團(tuán)(基團(tuán))關(guān)系等幾處入手,學(xué)生通過認(rèn)真觀察分析得出結(jié)果。分析圖1,鑒定出化合物1為環(huán)(苯丙-脯)二肽,分析數(shù)據(jù)與文獻(xiàn)[26]基本一致。分析圖2,推測分子是色氨酸,數(shù)據(jù)與色氨酸標(biāo)準(zhǔn)品HNMR數(shù)據(jù)符合。
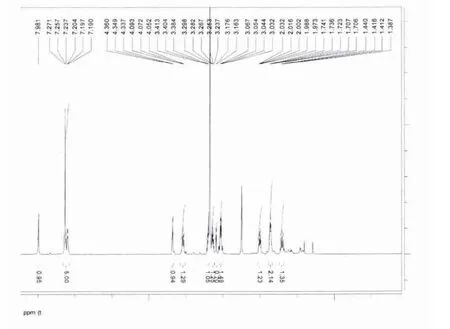
圖1 實(shí)驗(yàn)分離到的環(huán)(苯丙-脯)二肽的HNMR譜

圖2 實(shí)驗(yàn)分離到的色氨酸的HNMR譜
學(xué)生完成上述結(jié)構(gòu)解析后,教師引導(dǎo)學(xué)生依次思考如下問題:
(1)如何運(yùn)用HNMR判斷所分離物質(zhì)中有無雜質(zhì)?
(2)自己所分離的化合物的純度情況如何?
(3)雜質(zhì)未被充分除去的原因?
(4)如何進(jìn)一步增加所分離化合物的純度?
學(xué)生運(yùn)用學(xué)到的知識(shí)結(jié)合教師提示和自己的實(shí)驗(yàn)操作等環(huán)節(jié)解決問題,給出答案。此步驟由學(xué)生在撰寫實(shí)驗(yàn)報(bào)告階段完成。學(xué)生為用HNMR譜表征自己分離得到的產(chǎn)品結(jié)構(gòu)而感到高興,整個(gè)過程激發(fā)了學(xué)生的成就感與創(chuàng)新欲望,使學(xué)生較好地掌握了HNMR譜表征與推知天然產(chǎn)物結(jié)構(gòu)的方法。
5 結(jié)束語
與陸源生物的次生代謝產(chǎn)物相比,海洋生物由于生活環(huán)境更加復(fù)雜、物種更加多樣,使得其天然產(chǎn)物具有很多新型的骨架和獨(dú)特的化學(xué)結(jié)構(gòu),在生物活性方面也具有更強(qiáng)烈的作用。近年來,國內(nèi)外天然產(chǎn)物學(xué)家普遍認(rèn)為從海洋微生物發(fā)掘活性物質(zhì)是利用海洋天然產(chǎn)物結(jié)構(gòu)多樣性,同時(shí)解決生物資源難再生、保護(hù)生態(tài)環(huán)境的最佳選擇。海洋微生物已成為尋找藥物先導(dǎo)化合物的一個(gè)新的源泉[27]。與此大背景不相符的是當(dāng)前國內(nèi)高校極少開設(shè)海洋微生物天然產(chǎn)物提取分離實(shí)驗(yàn),究其原因,主要是因?yàn)槲⑸锇l(fā)酵周期長、代謝產(chǎn)物成分復(fù)雜,同時(shí)提取分離純化過程需消耗大量溶劑,耗資且耗時(shí)。針對(duì)上述困難,我們依托于自身科研項(xiàng)目,精選一株代謝產(chǎn)物較為簡單的海洋細(xì)菌為實(shí)驗(yàn)對(duì)象,限定目標(biāo)產(chǎn)物,以綠色化學(xué)思想為指導(dǎo)設(shè)計(jì)實(shí)驗(yàn)方案,通過優(yōu)化菌株發(fā)酵條件、優(yōu)選提取分離純化方法,不僅使實(shí)驗(yàn)學(xué)時(shí)、菌株發(fā)酵量、溶劑消耗、環(huán)境污染等降到最低,而且確保高效率地分離純化出目標(biāo)產(chǎn)物,并指導(dǎo)學(xué)生運(yùn)用HNMR鑒定產(chǎn)物結(jié)構(gòu)。該實(shí)驗(yàn)有助于學(xué)生全面深刻地認(rèn)識(shí)海洋微生物天然產(chǎn)物的科學(xué)研究流程、增加學(xué)生學(xué)習(xí)興趣、提升學(xué)生操作技能和創(chuàng)新能力。實(shí)驗(yàn)所積累的大量單體化合物還可以進(jìn)一步加以利用,進(jìn)行各種生物活性測試或開展結(jié)構(gòu)修飾研究,成為大學(xué)生研究性或設(shè)計(jì)性實(shí)驗(yàn)項(xiàng)目的原料,衍生出更多新的創(chuàng)新內(nèi)容。
(
)
[1]姜茹,李曉曄,劉雪英,等.天然藥物化學(xué)教學(xué)模式探索[J].山西醫(yī)科大學(xué)學(xué)報(bào):基礎(chǔ)醫(yī)學(xué)教育版,2007,10(1):35-36.
[2]劉俊康,劉艷霞,劉蕾,等.天然藥物化學(xué)課程中《海洋天然產(chǎn)物》一章互動(dòng)式教學(xué)初探[J].中國醫(yī)藥導(dǎo)報(bào),2011,8(35):129-130.
[3]曲瑋,梁敬鈺.天然藥物化學(xué)實(shí)驗(yàn)教學(xué)改革探索[J].西北藥學(xué)雜志,2013,28(2):211-212.
[4]薛多清,王俊杰,劉海利,等.海洋天然產(chǎn)物研究進(jìn)展[J].中國天然藥物,2009,7(2):150-160.
[5]林永成.海洋微生物及其代謝產(chǎn)物[M].北京:化學(xué)工業(yè)出版社,2003.
[6]高昊,陳國棟,唐金山,等.海洋細(xì)菌Bacillus sp.次生代謝產(chǎn)物的分離與鑒定[J].沈陽藥科大學(xué)學(xué)報(bào),2010,27(1):69-74.
[7]劉濤,李占林,王宇,等.海洋細(xì)菌Bacillus subtilis.次級(jí)代謝產(chǎn)物的研究[J].沈陽藥科大學(xué)學(xué)報(bào),2009,28(5):1-6.
[8]Pathak K V,Keharia H,Gupta K,et al.Lipopeptides from the banyan endophyte,Bacillus subtilis K1:mass spectrometric charac-terization of a library of Fengycins[J].Journal of the American Society for Mass Spectrometry,2012,23(10):1716-1728.
[9]Chen H,Wang L,Su C X,et al.Isolation and characterization of lipopeptide antibiotics produced by Bacillus subtilis[J].Letters in Applied Microbiology,2008,47(3):180-186.
[10]郭秀春,鄭立,周文輝,等.海洋微生物中二酮哌嗪類化合物的研究進(jìn)展[J].微生物學(xué)通報(bào),2009,36(10):1596-1603.
[11]李春遠(yuǎn),龔兵,黃素萍,等.紅樹林內(nèi)生真菌K38和E33共培養(yǎng)代謝產(chǎn)物研究[J].中山大學(xué)學(xué)報(bào):自然科學(xué)版,2013,52(2):66-69.
[12]李斌,陳剛,白皎,等.海洋放線菌Streptomyces sp.次級(jí)代謝產(chǎn)物的研究[J].中國藥物化學(xué)雜志,2011,21(3):227-231.
[13]Casey J T,Walsh P K,Oshea D G.Characterisation of adsorbent resins for the recovery of geldanamycin from fermentation broth[J].Separation and Purification Technology,2007,53(3):281-288.
[14]Payne G F,Payne N N,Ninomiya Y,et al.Adsorption of nonpolarsolutes onto neutral polymeric sorbents[J].Separatation Science Technology,1989(24):457-465.
[15]Ghosh A C,Mathur R K,Dutta N N.Extraction and purification of cephalosporin antibiotics[J].Advanced Biochemical Engineering Biotechnology,1997,56(1):111-145.
[16]Ribeiro M,Ribeiro I.Modelling the adsorption kinetics of erythromycin onto neutral and anionic resins [J].Bioprocess Biosystems Engineering,2003,26(1):49-55.
[17]高芬,盧賽飛,王夢亮.鏈霉菌182-2抗菌活性物質(zhì)的分離及抑菌特性的初步研究[J].植物保護(hù),2012,38(1):71-75.
[18]劉祝祥,李銘剛,李勇,等.Amberchrom TM 161C 與 Amberlite XAD-16在微生物發(fā)酵產(chǎn)物預(yù)處理過程中的比較研究[J].中國抗生素雜志,2003,28(9):572-575.
[19]陳敏,盧其明,羅志剛.化學(xué)開放實(shí)驗(yàn)教學(xué)綠色化的探索與實(shí)踐[J].實(shí)驗(yàn)室研究與探索,2013,32(4):135-139.
[20]Young C P,Sarath P G,Jose V L,et al.Metabolites from the marine-derived fungus Chromocleista sp.isolated from a deep-water sediment sample collected in the gulf of Mexico[J].Journal of natural products,2006,69(4):580-584.
[21]張智聰,鄭珩料,顧覺奮.大孔吸附樹脂LX20從發(fā)酵液中分離純化維生素B12[J].離子交換與吸附,2011,27(4):368-374.
[22]謝鳳霞,邱祖民,涂盛輝,等.浸提法與超聲波提取法提取梔子黃色素的比較[J].南昌大學(xué)學(xué)報(bào):理科版,2005,29(3):278-281.
[23]方玉春,劉培培,朱偉明,等.天然藥物化學(xué)實(shí)驗(yàn)教學(xué)的改進(jìn)[J].實(shí)驗(yàn)室研究與探索,2007,26(1):89-90.
[24]陳彬,孔繼烈.天然產(chǎn)物結(jié)構(gòu)分析中質(zhì)譜與核磁共振技術(shù)應(yīng)用新進(jìn)展[J].化學(xué)進(jìn)展,2004,16(6):863-870.
[25]鄭秋闿,范晶晶,陳鳴才,等.核磁共振氫譜研究二氫楊梅素的抗氧化機(jī)理[J].實(shí)驗(yàn)技術(shù)與管理,2013,30(4):30-32.
[26]Wang G H,Dai S K,Chen M J,et al.Two diketopiperazine cyclo(pro-phe)isomers from marine bacteria Bacillus subtilis sp.13-2[J].Chemistry of Natural Compounds,2010,46(4):583-585.
[27]譚仁祥.海洋微生物:新天然藥物的重要源泉[J].中國天然藥物,2006,4(1):1-4.

