創(chuàng)新藥物技術(shù)轉(zhuǎn)移模式探索
程永浩
(中國醫(yī)學(xué)科學(xué)院、北京協(xié)和醫(yī)學(xué)院藥物研究所,北京 100050)
創(chuàng)新藥物技術(shù)轉(zhuǎn)移模式探索
程永浩
(中國醫(yī)學(xué)科學(xué)院、北京協(xié)和醫(yī)學(xué)院藥物研究所,北京 100050)
創(chuàng)新藥物研發(fā)能力標(biāo)志著一個國家生物醫(yī)藥產(chǎn)業(yè)發(fā)展水平的高低。隨著“十一五”重大新藥創(chuàng)制措施的實(shí)施,我國的創(chuàng)新藥物研究開發(fā)有了重大的進(jìn)展,但是與世界醫(yī)藥強(qiáng)國相比還有很多差距。通過與西方發(fā)達(dá)國家對比分析,發(fā)現(xiàn)我國創(chuàng)新藥物研究開發(fā)及技術(shù)轉(zhuǎn)移存在的問題和原因,建議發(fā)揮我國天然藥物研究得天獨(dú)厚的優(yōu)勢,建立有中國特色的創(chuàng)新藥物研究開發(fā)體系,逐步形成以企業(yè)投入為主、政府扶持為輔、科研單位積極支持的產(chǎn)、學(xué)、研相結(jié)合,與國際接軌的創(chuàng)新藥物研發(fā)體系和創(chuàng)新藥物的技術(shù)轉(zhuǎn)移產(chǎn)業(yè)化模式,必將加快我國創(chuàng)新藥物的研究開發(fā)及技術(shù)轉(zhuǎn)移。
創(chuàng)新藥物;研究開發(fā);技術(shù)轉(zhuǎn)移;研發(fā)體系
生物醫(yī)藥產(chǎn)業(yè)是一項(xiàng)重要的高新技術(shù)產(chǎn)業(yè),體現(xiàn)了多學(xué)科交叉的高新技術(shù)創(chuàng)新與集成,是新世紀(jì)科技和經(jīng)濟(jì)國際競爭的戰(zhàn)略制高點(diǎn)之一,是繼信息產(chǎn)業(yè)之后世界經(jīng)濟(jì)中又一個新的戰(zhàn)略主導(dǎo)產(chǎn)業(yè)。生物醫(yī)藥產(chǎn)業(yè)受到各國政府和企業(yè)界的高度關(guān)注,全球醫(yī)藥市場多年來呈現(xiàn)持續(xù)快速發(fā)展態(tài)勢,從2001年的3 930億美元增長到2009年的8 200億美元,增速顯著高于同期國內(nèi)生產(chǎn)總值(GDP)[1]。據(jù)艾美仕預(yù)測,我國生物醫(yī)藥市場到2020年將成為僅次于美國的全球第二大生物醫(yī)藥市場。近年來,隨著國家一系列鼓勵自主研發(fā)、創(chuàng)新藥物政策的相繼出臺,生物醫(yī)藥產(chǎn)業(yè)面臨著前所未有的發(fā)展機(jī)遇。尤其是國家生物醫(yī)藥重大專項(xiàng)的提出,實(shí)現(xiàn)了中國藥物研究和醫(yī)藥產(chǎn)業(yè)由仿制為主向自主創(chuàng)新為主的歷史性、戰(zhàn)略性轉(zhuǎn)變。“十一五”是我國新藥創(chuàng)制的重要拐點(diǎn),研制出一批具有自主知識產(chǎn)權(quán)的重大創(chuàng)新藥物品種,部分創(chuàng)新藥物品種質(zhì)量明顯提升,接近國際先進(jìn)水平。筆者就我國創(chuàng)新藥物研究開發(fā)和技術(shù)轉(zhuǎn)移模式加以探討。
1 創(chuàng)新藥物研究開發(fā)過程及特點(diǎn)
1.1 創(chuàng)新藥物研究開發(fā)4階段
1.1.1 新藥發(fā)現(xiàn)研究 靶標(biāo)研究:確定治療的疾病目標(biāo)和作用的環(huán)節(jié)和靶標(biāo),是創(chuàng)制新藥的出發(fā)點(diǎn);藥物篩選:靶標(biāo)選定以后,要建立生物學(xué)模型,以篩選和評價化合物的活性;先導(dǎo)化合物發(fā)現(xiàn):先導(dǎo)化合物又稱新化學(xué)實(shí)體,是指通過各種途徑和方法得到的具有某種生物活性或藥理活性的化合物;先導(dǎo)化合物優(yōu)化:由于發(fā)現(xiàn)的先導(dǎo)化合物可能具有作用強(qiáng)度或特異性不高、藥動學(xué)性質(zhì)不適宜、毒副作用較強(qiáng)、化學(xué)或代謝上不穩(wěn)定、成藥性差等缺陷,需要對其結(jié)構(gòu)進(jìn)行優(yōu)化;候選化合物確認(rèn):經(jīng)過對先導(dǎo)化合物優(yōu)化,最終獲得優(yōu)良的化合物,即候選藥物而進(jìn)入開發(fā)階段。
1.1.2 臨床前研究 候選化合物確定后就進(jìn)入正式臨床前研究開發(fā)階段。藥學(xué)研究:包括藥物的合成工藝、提取方法、理化性質(zhì)及純度、劑型選擇、處方篩選、制備工藝、檢驗(yàn)方法、質(zhì)量控制指標(biāo)、穩(wěn)定性等研究。藥效學(xué)研究:研究藥物的生化、生理效應(yīng)及機(jī)制以及劑量與效應(yīng)之間的關(guān)系,確定藥物預(yù)期用于臨床治療目的的藥理作用,闡明藥物作用部位和機(jī)制,內(nèi)容包括藥物作用基本類型、藥物作用的選擇性、藥物作用的量效關(guān)系、藥物的治療作用與不良反應(yīng)、藥物的作用機(jī)制。藥物代謝研究:通過動物體內(nèi)、外和人體外的研究方法,揭示藥物在體內(nèi)動態(tài)的變化規(guī)律,闡明藥物的吸收、分布、代謝和排泄的過程及特點(diǎn)。毒理學(xué)研究:即藥物非臨床安全性評價,包括急性毒性實(shí)驗(yàn)、長期毒性實(shí)驗(yàn)、特殊毒性實(shí)驗(yàn)、局部毒性實(shí)驗(yàn)、免疫原性實(shí)驗(yàn)、藥物依賴性實(shí)驗(yàn)、毒代動力學(xué)實(shí)驗(yàn)等相關(guān)的實(shí)驗(yàn)。旨在通過實(shí)驗(yàn)找出藥物的毒性劑量,確定藥物安全劑量范圍,發(fā)現(xiàn)毒性反應(yīng),找出毒性靶器官,為下一步臨床試驗(yàn)提供依據(jù)。臨床試驗(yàn)申請:完成藥物臨床前研究后,申請人向所在地的省級食品藥品監(jiān)督管理部門報送申請藥物臨床試驗(yàn)的申報資料。如果申報資料真實(shí),符合相關(guān)規(guī)定,經(jīng)國家食品藥品監(jiān)督管理總局技術(shù)審評、現(xiàn)場核查及檢驗(yàn),符合相關(guān)規(guī)定發(fā)給藥物臨床試驗(yàn)批件,允許藥物進(jìn)行Ⅰ期臨床試驗(yàn)。
1.1.3 臨床試驗(yàn)研究[2]
1.1.3.1 Ⅰ期臨床試驗(yàn) 初步的臨床藥理學(xué)及人體安全性評價試驗(yàn),觀察人體對試驗(yàn)藥物的耐受程度和藥代動力學(xué),為制定給藥方案提供依據(jù)。一般要求最低病例數(shù)20~30例,試驗(yàn)確定藥物的安全劑量范圍,以及藥物在體內(nèi)的吸收、分布、代謝和排泄、藥物的作用持續(xù)時間等項(xiàng)目。
1.1.3.2 Ⅱ期臨床試驗(yàn) 初步評價藥物對目標(biāo)適應(yīng)證患者的治療作用和安全性,為Ⅲ期臨床試驗(yàn)研究設(shè)計(jì)和給藥劑量方案的確定提供依據(jù)。一般要求最低病例數(shù)100例,分兩個階段進(jìn)行。第一階段是劑量探索階段,初步確定安全、有效的劑量;第二階段是按照隨機(jī)盲法對照的臨床試驗(yàn),確定藥物的有效性,并初步確定不良反應(yīng)。
1.1.3.3 Ⅲ期臨床研究 藥物治療作用確證階段:該階段進(jìn)一步驗(yàn)證對目標(biāo)適應(yīng)證患者的治療作用和安全性,評價利益與風(fēng)險關(guān)系,為藥物最終注冊申報獲得批準(zhǔn)上市,提供充分的依據(jù)。Ⅲ期臨床是擴(kuò)大的臨床試驗(yàn),要求具有足夠樣本量的隨機(jī)盲法對照試驗(yàn),一般受試藥最低病例數(shù)為300例。
1.1.3.4 新藥上市申請 完成Ⅰ、Ⅱ、Ⅲ期臨床試驗(yàn)后,統(tǒng)計(jì)、分析綜合所有的臨床試驗(yàn)數(shù)據(jù),申請人向所在地的省級食品藥品監(jiān)督管理部門報送申請新藥證書及生產(chǎn)批件的申報資料。如果數(shù)據(jù)能夠證明藥物的安全性和有效性,經(jīng)國家食品藥品監(jiān)督管理總局技術(shù)審評、現(xiàn)場核查及檢驗(yàn),符合相關(guān)規(guī)定發(fā)給新藥證書,批準(zhǔn)新藥正式上市。
1.1.4 新藥上市、臨床應(yīng)用 獲得新藥證書及生產(chǎn)批件后,新藥可以被醫(yī)師用于處方,應(yīng)用于臨床。生產(chǎn)企業(yè)需要向國家食品藥品監(jiān)督管理總局提交階段性報告,包括所有的不良反應(yīng)報告和一些質(zhì)量控制記錄。同時要求新藥做進(jìn)一步的Ⅳ期臨床試驗(yàn)研究,考察在廣泛性使用的條件下的療效和不良反應(yīng),評價藥物的長期療效。見圖1。
1.2 創(chuàng)新藥物研究開發(fā)特點(diǎn)[3]
1.2.1 周期長 從以上創(chuàng)新藥物研究開發(fā)過程可以看出,創(chuàng)新藥物從發(fā)現(xiàn)先導(dǎo)化合物到最后批準(zhǔn)投產(chǎn)上市需要經(jīng)過漫長的過程,而且,研究開發(fā)的周期越來越長。新藥研發(fā)一般需要10~15年。
1.2.2 高投入 由于創(chuàng)新藥物研究開發(fā)過程復(fù)雜漫長,加之對新藥的安全性要求越來越高,使得新藥研究開發(fā)的資金投入不斷升高。在美國開發(fā)一個創(chuàng)新藥物往往要投入8~10億美元,中國創(chuàng)新藥物研究開發(fā)也在千萬元人民幣以上。
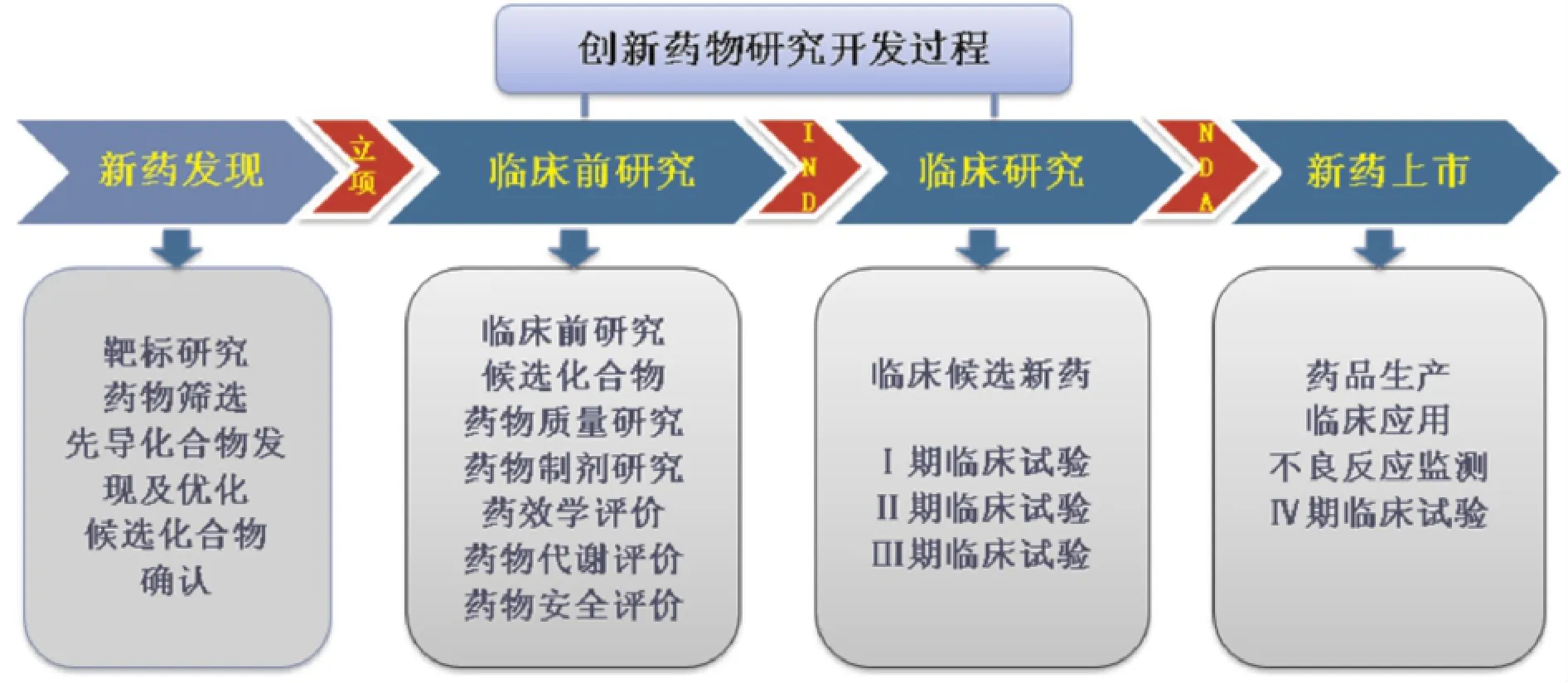
圖1 創(chuàng)新藥物研究開發(fā)過程
1.2.3 高風(fēng)險 創(chuàng)新藥物研發(fā)風(fēng)險大,淘汰率高。一個化合物從初篩到最后批準(zhǔn)上市并占領(lǐng)市場,一般都是從上萬個化合物中篩選出來的。因此,一旦新藥項(xiàng)目開發(fā)失敗,上億的研發(fā)投入無法挽回,對企業(yè)的影響巨大。
1.2.4 高收益 創(chuàng)新藥物研究開發(fā)雖然風(fēng)險很大,新藥項(xiàng)目成功上市,就會給企業(yè)帶來巨大的經(jīng)濟(jì)效益,藥品實(shí)行專利保護(hù),企業(yè)享受定價權(quán),獨(dú)家生產(chǎn)占領(lǐng)市場。一般一種新藥品上市后2~3年即可收回投資,形成技術(shù)壟斷優(yōu)勢,利潤回報能高達(dá)10倍以上。
2 創(chuàng)新藥物技術(shù)轉(zhuǎn)移的特點(diǎn)及存在的問題
2.1 創(chuàng)新藥物原始創(chuàng)新不足,基礎(chǔ)研究缺乏 我國目前政府投資基礎(chǔ)研究與國外相比較低,基礎(chǔ)研究薄弱,創(chuàng)新性不足,雖然創(chuàng)新藥物相關(guān)的研究論文逐年上升,但創(chuàng)新藥物上市及處于各期臨床研究的候選藥物數(shù)量很少。1998年至2008年間,美國、歐盟、中國及印度創(chuàng)新藥物研發(fā)上市數(shù)據(jù)可以看出[4],美國一直保持領(lǐng)先地位,歐盟國家緊隨其后,我國創(chuàng)新藥物研發(fā)有了一定進(jìn)展。隨著“十一五”重大新藥創(chuàng)制措施的實(shí)施,我國的創(chuàng)新藥物研究開發(fā)有了重大的進(jìn)展,現(xiàn)正處在由模仿創(chuàng)新向自主創(chuàng)新轉(zhuǎn)變過渡階段。
2.2 創(chuàng)新藥物研發(fā)投入嚴(yán)重不足 現(xiàn)階段,創(chuàng)新藥物研發(fā)投入逐年上升,1975年一個新藥產(chǎn)品的研發(fā)費(fèi)用為1.38億美元,2006年卻高達(dá)13.18億美元,為1975年的約10倍。2004年至2009年間,全球藥品研發(fā)費(fèi)用也呈上升趨勢,2004年為476億美元,而2009年增至653億美元。2009年美國制藥企業(yè)研發(fā)費(fèi)用為458億美元,研發(fā)占銷售額比例自2000年以來在18%以上,且自2003年起一直呈上升趨勢。歐洲制藥行業(yè)協(xié)會聯(lián)盟成員企業(yè)研發(fā)費(fèi)用占銷售額比例近年來也都在17%以上[5]。2008年,中國研發(fā)費(fèi)用占GDP的百分比為1.34%,醫(yī)藥制造業(yè)研發(fā)經(jīng)費(fèi)投入強(qiáng)度(與主營業(yè)務(wù)收入之比)為1.74%。
我國的創(chuàng)新藥物研發(fā)投入存在著巨大的差距。我國政府資助創(chuàng)新藥物研發(fā)相對西方發(fā)達(dá)國家支持力度低。我國生物醫(yī)藥企業(yè)規(guī)模小、數(shù)量多、行業(yè)集中度低、經(jīng)濟(jì)效益較為低下,年銷售額上百億元人民幣的企業(yè)很少,投入創(chuàng)新藥物的研究開發(fā)的資金不足,嚴(yán)重制約我國創(chuàng)新藥物研究開發(fā)。其次,我國風(fēng)險投資、社會融資發(fā)展時間短,不敢貿(mào)然投入資金進(jìn)入生物醫(yī)藥產(chǎn)業(yè)。這就導(dǎo)致我國創(chuàng)新藥物研究開發(fā)投入不完整,沒有形成優(yōu)勢互補(bǔ)的投入支撐體系,經(jīng)費(fèi)投入嚴(yán)重的不足,無法滿足創(chuàng)新藥物研發(fā)高額、長期的經(jīng)費(fèi)需求。難以形成創(chuàng)新藥物研發(fā)的技術(shù)鏈條,即最終新藥上市,獲得利潤回報給投資者,從而形成互惠互利、多贏的投入、開發(fā)、上市、獲利的完整、良性投入體系。
2.3 創(chuàng)新藥物研發(fā)主體錯位 醫(yī)藥企業(yè)是美國醫(yī)藥產(chǎn)業(yè)創(chuàng)新體系的主體,是美國醫(yī)藥產(chǎn)業(yè)創(chuàng)新的主力軍[6]。據(jù)美國藥品研究和制造商協(xié)會(the Pharmaceutical Research and Manufacturers of America, PhRMA)和美國投資咨詢公司(Burrill&Company)的報道,2006年美國制藥公司和生物技術(shù)公司研究開發(fā)投入高達(dá)552億美元,較2005年的518億美元增長了34億美元,創(chuàng)造了歷史新高。PhRMA 2007年度報告, 2006年其成員公司新藥研究開發(fā)投入約430億美元,占美國全國新藥研發(fā)投入的約80%,2005年新藥研究開發(fā)投入為399億美元,2006年的投入比2005年增長31億美元。全球制藥十強(qiáng)研發(fā)投入,1997年為154億美元,2007年達(dá)560億美元,2008年達(dá)562億美元,2009年達(dá)626億美元,2010年646達(dá)億美元,2011年達(dá)657億美元,2011年比1997年增長3.3倍。
2006年世界研發(fā)投入最多的前10位制藥公司中有5個美國制藥公司,分別是輝瑞、強(qiáng)生、先靈、安進(jìn)和禮來。這10家制藥公司新藥研發(fā)的平均強(qiáng)度為25.93%,其中先靈公司研發(fā)強(qiáng)度高達(dá)47.06%。由此可見美國制藥公司在創(chuàng)新藥物研發(fā)的主體地位。
我國制藥企業(yè)研發(fā)投入雖然有所增加,但創(chuàng)新藥物研發(fā)投入強(qiáng)度卻一直徘徊在3%。2001年至2004年醫(yī)藥制造業(yè)R&D強(qiáng)度平均值為2.6%,遠(yuǎn)遠(yuǎn)低于發(fā)達(dá)國家10%~20%的水平。2005年,我國醫(yī)藥行業(yè)全部研發(fā)經(jīng)費(fèi)內(nèi)部支出只有43.4億元人民幣。而美國輝瑞公司當(dāng)年的研發(fā)投入就達(dá)到74.42億美元,這一家公司的研發(fā)投入是我國全部產(chǎn)業(yè)研發(fā)投入的約12倍。
由此可見,發(fā)達(dá)國家創(chuàng)新藥物研究開發(fā)的主體是制藥企業(yè),大學(xué)、科研機(jī)構(gòu)關(guān)注基礎(chǔ)研究。但我國生物醫(yī)藥的基礎(chǔ)研究及創(chuàng)新藥物研究開發(fā)主要集中在大學(xué)、科研機(jī)構(gòu)。主要原因:我國的醫(yī)藥工業(yè)實(shí)力薄弱,無力投入巨資進(jìn)行創(chuàng)新藥物研究開發(fā)。另外,高層次人才主要集中在大學(xué)科研院所。創(chuàng)新主體的錯位,造成了創(chuàng)新藥物研究開發(fā)嚴(yán)重的脫離市場,致使制藥企業(yè)創(chuàng)新藥物研究開發(fā)嚴(yán)重滯后,制約我國創(chuàng)新藥物研究開發(fā)及技術(shù)轉(zhuǎn)移。
2.4 創(chuàng)新藥物市場轉(zhuǎn)化、產(chǎn)業(yè)化機(jī)制體系不完善 由于我國科研院所承擔(dān)的科研項(xiàng)目基本是國家重大項(xiàng)目、自然基金,與市場需求相差較遠(yuǎn),我國生物醫(yī)藥科研機(jī)構(gòu)與制藥企業(yè)之間聯(lián)系合作相對過少,缺乏市場機(jī)制及相關(guān)溝通平臺支持,同時科研機(jī)構(gòu)產(chǎn)業(yè)化資金和市場運(yùn)作能力及機(jī)制缺乏,使得創(chuàng)新藥物研究開發(fā)產(chǎn)業(yè)化滯后,導(dǎo)致很多研究停留在科研成果及論文階段,沒有及時的產(chǎn)業(yè)化進(jìn)入市場而形成新藥品種和現(xiàn)實(shí)的生產(chǎn)力。
3 創(chuàng)新藥物技術(shù)轉(zhuǎn)移模式探討與對策
3.1 建立中國特色的創(chuàng)新藥物研發(fā)體系,促進(jìn)創(chuàng)新藥物技術(shù)轉(zhuǎn)移產(chǎn)業(yè)化 我國中醫(yī)藥學(xué)以及各少數(shù)民族醫(yī)藥歷史悠久,天然植物資源豐富,我國天然藥物研究有得天獨(dú)厚的優(yōu)勢。像青蒿素、雙環(huán)醇、丁苯酞研究開發(fā),就是以中藥和天然植物為基礎(chǔ),進(jìn)行有效成分分離提取,進(jìn)一步結(jié)構(gòu)優(yōu)化研究開發(fā)成創(chuàng)新藥物。
芹菜籽古醫(yī)書記載具有降血壓作用,中國醫(yī)學(xué)科學(xué)院藥物研究所科研人員對其有效成分進(jìn)行全面研究,分離提取出丁苯酞,并進(jìn)行了全合成,發(fā)現(xiàn)其具有治療缺血性腦卒中的藥理作用。臨床試驗(yàn)進(jìn)一步證明,丁苯酞治療缺血性腦卒中療效顯著,毒副作用小,與目前國內(nèi)外上市及文獻(xiàn)報道的新藥相比有著獨(dú)特的優(yōu)勢,成為繼青蒿素、雙環(huán)醇之后中國第三個擁有自主知識產(chǎn)權(quán)的創(chuàng)新藥物。
這些創(chuàng)新藥物充分發(fā)揮我國中藥的優(yōu)勢,集合分子生物學(xué)、生物合成、結(jié)構(gòu)生物學(xué)、蛋白組學(xué)、功能基因?qū)W、計(jì)算機(jī)和生物信息學(xué)等學(xué)科建立有中國特色的創(chuàng)新藥物研究開發(fā)體系,從而加快我國藥物研究平臺建設(shè)與國際接軌,使我國的創(chuàng)新藥物臨床前研究及臨床試驗(yàn)規(guī)范化并與國際接軌,得到國際的認(rèn)可。
通過我國“十一五”“十二五”國家“重大新藥創(chuàng)制”專項(xiàng)的實(shí)施,截至2010年9月底,在“重大新藥創(chuàng)制”專項(xiàng)支持下,我國已有16個品種獲得新藥證書,20個品種提交新藥注冊申請;10多個自主研發(fā)的新藥在發(fā)達(dá)國家進(jìn)行了臨床試驗(yàn),18個品種完成全部研究工作,36個品種處于Ⅲ期臨床研究階段,96個品種處于Ⅰ、Ⅱ期臨床研究階段;近200個品種處于臨床前研究階段,近500個候選藥物正在研究之中。部分新藥研發(fā)的創(chuàng)新性和質(zhì)量明顯提升,已接近國際先進(jìn)水平。其中,近2/3的新藥是我國在世界上首次確定化學(xué)結(jié)構(gòu)、作用靶點(diǎn)的一類新藥[7]。初步達(dá)到自主研制的創(chuàng)新藥物走向國際,創(chuàng)新藥物研發(fā)平臺與國際互認(rèn),大幅度提升我國創(chuàng)新藥物研究開發(fā)及產(chǎn)業(yè)化水平,造就了一批藥物研究開發(fā)人才,初步形成了擁有近5 000人的國家藥物創(chuàng)新體系與隊(duì)伍。為形成中國特色的創(chuàng)新藥物創(chuàng)新體系打下堅(jiān)實(shí)基礎(chǔ),促進(jìn)了創(chuàng)新藥物的技術(shù)轉(zhuǎn)移和產(chǎn)業(yè)化,加速了我國生物醫(yī)藥產(chǎn)業(yè)的快速發(fā)展。
3.2 建立以市場為導(dǎo)向、企業(yè)為主體的創(chuàng)新藥物研究開發(fā)、技術(shù)轉(zhuǎn)移新模式 創(chuàng)新藥物研究開發(fā)一定要符合市場的需求,為臨床應(yīng)用服務(wù),才能為市場所接納,成功轉(zhuǎn)化為生產(chǎn)力。科研院所必須加強(qiáng)與國內(nèi)外生物醫(yī)藥企業(yè)的合作,了解企業(yè)真實(shí)的需求,做好國內(nèi)外生物醫(yī)藥市場調(diào)查研究工作。從開發(fā)立項(xiàng)開始,強(qiáng)調(diào)立項(xiàng)依據(jù)的科學(xué)性,把市場需求和社會需求放在首位,減少盲目性;在項(xiàng)目實(shí)施過程中,根據(jù)市場需求,適時調(diào)整研發(fā)方向及研發(fā)策略,提高創(chuàng)新藥物技術(shù)轉(zhuǎn)移產(chǎn)業(yè)轉(zhuǎn)化能力。根據(jù)我國制藥企業(yè)創(chuàng)新研究開發(fā)現(xiàn)狀,從科研院所為新藥研發(fā)主體向以制藥企業(yè)為新藥研發(fā)主體轉(zhuǎn)化,不能一蹴而就。近期內(nèi),應(yīng)堅(jiān)持品種開發(fā)以企業(yè)為主、技術(shù)平臺建設(shè)以科研院所為主的體系,并以科研院所改制為契機(jī),促進(jìn)大院大所與大企業(yè)的有機(jī)結(jié)合和重組,優(yōu)勢互補(bǔ),集新藥開發(fā)所需的技術(shù)、人才、資金、管理等要素為一體,形成新藥創(chuàng)新的中堅(jiān)力量,改變企業(yè)技術(shù)開發(fā)力量薄弱落后的局面。通過國家政策導(dǎo)向,利用政策促進(jìn)企業(yè)的研發(fā)與效益的良性循環(huán),最終促使企業(yè)成為新藥開發(fā)和創(chuàng)新的主體,發(fā)揮企業(yè)創(chuàng)新研究開發(fā)的主體作用,企業(yè)依靠科技進(jìn)步和創(chuàng)新產(chǎn)品,促進(jìn)長遠(yuǎn)發(fā)展,激發(fā)企業(yè)對科技成果應(yīng)用的內(nèi)在需求,最終形成以市場為導(dǎo)向、企業(yè)為主體的創(chuàng)新藥物技術(shù)轉(zhuǎn)移模式,加快創(chuàng)新藥物技術(shù)的產(chǎn)業(yè)化,促進(jìn)我國生物醫(yī)藥產(chǎn)業(yè)的可持續(xù)發(fā)展。
3.3 建立產(chǎn)、學(xué)、研結(jié)合的中國特色創(chuàng)新藥物的技術(shù)轉(zhuǎn)移模式 我國產(chǎn)、學(xué)、研聯(lián)合模式應(yīng)是企業(yè)與科研院所按照“利益共存、風(fēng)險共擔(dān)、優(yōu)勢互補(bǔ)、共同發(fā)展”的原則,在發(fā)揮各方優(yōu)勢的情況下,雙方長期合作研究開發(fā)。其特點(diǎn)是科研院所與企業(yè)之間是長期、連續(xù)、緊密的合作。產(chǎn)、學(xué)、研聯(lián)合體應(yīng)有一個良好的運(yùn)行機(jī)制,各方責(zé)、權(quán)、利明確到位,真正使合作各方風(fēng)險共擔(dān)、利益共享、協(xié)同發(fā)展。國內(nèi)外實(shí)踐表明產(chǎn)、學(xué)、研聯(lián)合體是一種行之有效模式。制藥企業(yè)與國家級科研院所形成產(chǎn)、學(xué)、研緊密的有機(jī)的結(jié)合,集合創(chuàng)新藥物研究開發(fā)所需的科研、技術(shù)、人才、產(chǎn)業(yè)、市場、資金及管理等要素為一體,促進(jìn)制藥企業(yè)人才技術(shù)開發(fā),使制藥企業(yè)真正成為創(chuàng)新藥物開發(fā)和創(chuàng)新的主體,形成研究-開發(fā)-臨床-申報-生產(chǎn)-市場的良性循環(huán)的開發(fā)聯(lián)合體,極大地加快了創(chuàng)新藥物研究開發(fā)及技術(shù)轉(zhuǎn)移和產(chǎn)業(yè)化。
例如:中國醫(yī)學(xué)科學(xué)院藥物研究所與江蘇恒瑞制藥集團(tuán)長期合作成立聯(lián)合實(shí)驗(yàn),雙方共同確定研究開發(fā)環(huán)氧化酶2抑制藥。中國醫(yī)學(xué)科學(xué)院藥物研究所負(fù)責(zé)目標(biāo)化合物設(shè)計(jì)合成,初步生物活性評價;江蘇恒瑞制藥集團(tuán)負(fù)責(zé)動物體內(nèi)活性評價、后續(xù)開發(fā)及臨床試驗(yàn)工作。恒瑞醫(yī)藥股份有限公司具有市場、產(chǎn)業(yè)、資金管理的優(yōu)勢,保障技術(shù)及資金的充分投入;中國醫(yī)學(xué)科學(xué)院藥物研究所發(fā)揮人才及技術(shù)儲備的優(yōu)勢,把握目標(biāo)化合物的活性、藥代學(xué)及安全性等成藥性評價。雙方充分發(fā)揮各自的優(yōu)勢,共擔(dān)風(fēng)險。企業(yè)作為創(chuàng)新藥物開發(fā)主體,主導(dǎo)研究開發(fā)及產(chǎn)業(yè)化的進(jìn)程,加快了創(chuàng)新藥物研究開發(fā)和技術(shù)轉(zhuǎn)移。經(jīng)過十余年合作研究開發(fā)的藥物艾瑞昔布已于2011年成功上市,成為產(chǎn)學(xué)研合作研究開發(fā)創(chuàng)新藥物及技術(shù)轉(zhuǎn)移成功案例。
3.4 建立完善創(chuàng)新藥物研究開發(fā)的投融資體系,促進(jìn)創(chuàng)新藥物技術(shù)轉(zhuǎn)移 創(chuàng)新藥物研究開發(fā)具有高投入、高風(fēng)險、高回報和周期長的特點(diǎn),因此在創(chuàng)新藥物研究開發(fā)投入中,政府的公益性資助起著非常重要的基礎(chǔ)和引領(lǐng)作用。制藥企業(yè)作為創(chuàng)新主體研發(fā)投入金額巨大,有時亦無法滿足創(chuàng)新藥物研發(fā)的費(fèi)用需求。當(dāng)今,科技創(chuàng)新已經(jīng)進(jìn)入市場化和金融投資機(jī)構(gòu)相結(jié)合的時代,除了政府和企業(yè)科研投入以外,需要風(fēng)險投資、天使基金等各種方式募集的社會資金,形成政府、企業(yè)、風(fēng)投相互補(bǔ)充,多元化、多層次的創(chuàng)新藥物研發(fā)經(jīng)費(fèi)投入體系,才能有效地保障創(chuàng)新藥物研發(fā)的高額、長期的經(jīng)費(fèi)投入需求。
隨著我國“重大新藥創(chuàng)制”重大專項(xiàng)的實(shí)施,政府的投入,帶動引導(dǎo)科研院所和制藥企業(yè)開展創(chuàng)新藥物研究。在此基礎(chǔ)上,應(yīng)該進(jìn)一步完善我國創(chuàng)新藥物研發(fā)投入體系,建立政府、企業(yè)、風(fēng)險投資及社會資金多渠道的投融資體系。進(jìn)一步改革“國家科技重大專項(xiàng)”“973”“863”和“科技支撐計(jì)劃”,以及“自然科學(xué)基金”的科技經(jīng)費(fèi)投入機(jī)制,優(yōu)化資源配置。完善稅收激勵機(jī)制,實(shí)施有利于加強(qiáng)自主創(chuàng)新基地能力建設(shè)的財(cái)稅、金融政策,從經(jīng)濟(jì)上鼓勵企業(yè)實(shí)施創(chuàng)新開發(fā)。完善風(fēng)險投資、天使基金等投融資體系,積極探索引導(dǎo)社會資金投入的長效機(jī)制,發(fā)揮資本市場對創(chuàng)新藥物的研究開發(fā)的促進(jìn)作用。通過建立多元化的創(chuàng)新藥物研發(fā)的投融資體系,必將加快我國創(chuàng)新藥物的研究開發(fā)及技術(shù)轉(zhuǎn)移。
4 結(jié)束語
發(fā)揮我國天然藥物研究有得天獨(dú)厚的優(yōu)勢,集合分子生物學(xué)、生物合成、結(jié)構(gòu)生物學(xué)、蛋白組學(xué)、功能基因?qū)W、計(jì)算機(jī)和生物信息學(xué)等學(xué)科建立有中國特色的創(chuàng)新藥物研究開發(fā)體系,加快我國藥物研究平臺建設(shè)與國際接軌。引導(dǎo)社會資金投入的長效機(jī)制,發(fā)揮資本市場對創(chuàng)新藥物的研究開發(fā)的促進(jìn)作用,建立政府、企業(yè)、風(fēng)投及社會資金相互補(bǔ)充的的創(chuàng)新藥物研發(fā)的投融資體系,逐步形成以企業(yè)投入為主、政府扶持為輔、科研單位積極支持的產(chǎn)、學(xué)、研相結(jié)合,與國際接軌的創(chuàng)新藥物研發(fā)體系和創(chuàng)新藥物的技術(shù)轉(zhuǎn)移產(chǎn)業(yè)化模式。必將加快我國創(chuàng)新藥物的研究開發(fā)及技術(shù)轉(zhuǎn)移。
[1] 陳凱先.創(chuàng)新藥物研究的趨勢和對策思考[J].齊魯藥事, 2010,29(10):577-579.
[2] 張淑秀,曹志勝,惠秋莎.最新藥品注冊工作指南[M].北京:中國醫(yī)藥科技出版社,2008:194-195.
[3] 張立明,羅臻.藥事管理學(xué)[M].北京:清華大學(xué)出版社, 2011:99-100.
[4] 姚雪芳,丁錦希,邵蓉,等.中外創(chuàng)新藥物研發(fā)能力比較分析[J].中國新藥雜志,2010,19(24):2231-2239.
[5] 王華,楊悅.醫(yī)藥產(chǎn)業(yè)及藥品研發(fā)的現(xiàn)狀與思考[J].中國新藥雜志,2011,20(6):1490-1498.
[6] 阿麗塔,汪楠,田玲.中美醫(yī)藥產(chǎn)業(yè)創(chuàng)新體系對比分析[J].中國藥房,2009,23(1):18-22.
[7] 胡芳.創(chuàng)新藥市場轉(zhuǎn)化待破局[N].中國醫(yī)藥報,2011-03-24(B05).
DOI 10.3870/yydb.2014.08.041
R951
C
1004-0781(2014)08-1113-05
2014-01-13
2014-02-17
程永浩(1963-),男,河北靈壽人,副研究員,博士,研究方向:藥物研究開發(fā)。電話:(0)13269163139,E-mail: chengyh@imm.ac.cn。

