三種小鼠骨質疏松模型骨組織形態計量學觀察與評價
司徒永立,柯 行,劉 義,呂思敏,鐘月春,崔 燎,吳 鐵
(1.廣東醫學院病原生物學與免疫學研究所,2.廣東醫學院藥理學教研室,3.廣東天然藥物研究與開發重點實驗室,廣東湛江 524023)
骨質疏松是一種以骨量減少和骨微結構退變為特征,致使骨脆性和骨折危險性增加的系統性骨骼疾病[1]。絕經后骨質疏松主要是由于隨著年齡的增長,女性絕經后雌激素缺乏所引起,它是絕經后婦女常見病、多發病。目前骨質疏松動物模型的建立有多種方法,如去卵巢致骨質疏松動物模型、糖皮質激素性骨質疏松動物模型、環磷酰胺誘導骨質疏松動物模型等,各種骨質疏松動物模型都有其特點,可用于相應骨質疏松癥的研究,但其不足之處我們必須引起重視。
D-半乳糖常用于衰老動物模型的建立,近年來,D-半乳糖對小鼠骨組織的研究已有一些報道,但研究發現D-半乳糖對小鼠骨量的影響結果不一,覃冬云等[2]研究發現D-半乳糖能導致♀小鼠發生骨質疏松;但羅紅梅等[3]研究發現D-半乳糖可提高♀小鼠礦化程度。本研究旨在探討D-半乳糖對♀小鼠是否會產生骨質疏松,這種骨質疏松與去卵巢導致的骨質疏松有何異同?去卵巢后再加上D-半乳糖是否會加速加重骨質疏松的進展?補充雌激素對這些骨質疏松是否有預防作用?
1 材料與方法
1.1 藥物與試劑 己烯雌酚片:合肥久聯有限公司,批號:20100920;D-半乳糖:天津市光復精細化工研究所,批號:20090921;鈣黃綠素、鹽酸四環素:美國Sigma公司。
1.2 動物分組、給藥及實驗方法 60只2月齡SPF級昆明♀小鼠,由廣東醫學院實驗動物中心提供,動物合格證號:SCXK(粵)2008-0008。動物適應性喂養1周后,按體重隨機分成6組,分別為假手術組(S)、D-半乳糖組(D)、去卵巢組(O)、去卵巢 +D-半乳糖組(O+D)、去卵巢+D-半乳糖+己烯雌酚組(O+D+d)和D-半乳糖+己烯雌酚組(D+d)。O組、O+D組、O+D+d組進行雙側去卵巢手術,其余組做假手術對照,休養2 d后給藥。D組和O+D組皮下注射D-半乳糖120 mg·kg-1·d-1,O+D+d組和D+d組皮下注射D-半乳糖120 mg·kg-1·d-1,灌胃給予己烯雌酚 0.038 mg·kg-1·d-1,其余組皮下注射、灌胃給予等量蒸餾水,所有小鼠于處死前d 10~11和d 3~4分別皮下注射鹽酸四環素35 mg·kg-1、鈣黃綠素7.5 mg·kg-1,進行熒光標記,全程自由飲食,每周稱重1次,實驗周期為70 d。實驗結束當天,頸椎脫臼處死小鼠,右脛骨按文獻[4]步驟,進行不脫鈣包埋切片、染色,并以生長板下0.5 mm到2 mm為測量范圍,對上述范圍的松質骨進行測量、計算和分析。
1.3 統計學處理 使用SPSS 16.0軟件進行ANOVA單因素方差分析,所有數據以ˉx±s表示。
2 結果
2.1 各組小鼠體重觀察 各組小鼠體重見Fig 1,由Fig 1可見:與D組比較,D+d組第3、5、8周體重降低(P<0.05)。與O+D組比較,O+D+d組第7、8、9周體重降低(P<0.01)。
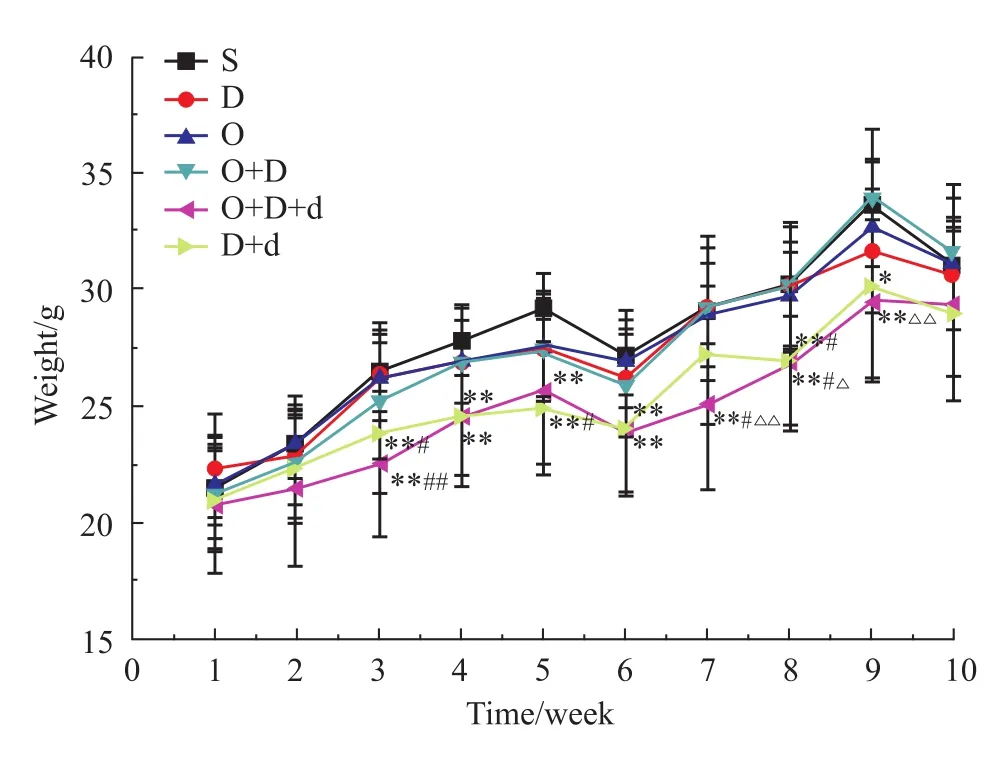
Fig 1 Body weight in m ice(±s,n=10)*P<0.05,**P<0.01 vs S group,#P<0.05,##P<0.01 vs D group;ΔP<0.05;ΔΔP<0.01 vs O+D group
2.2 各組小鼠脛骨上段骨小梁面積與骨小梁形態觀察 從Fig 2可見,S組骨小梁結構緊密、粗而均勻,連續性好,數量多;D組骨小梁結構稀疏,變細、斷裂,不連續,數量減少;O組只剩下一小部分的斷裂骨小梁,出現大量無骨小梁骨髓區;O+D組也只剩下一小部分的斷裂骨小梁,出現大量無骨小梁骨髓區;O+D+d組較O+D組骨小梁面積有所增大,數量有所增加,但結構較稀疏;D+d組骨小梁較D組結構緊密,明顯增粗、增大,連續性較好,數量明顯增加。
2.3 各組小鼠脛骨上段骨形態計量學靜態指標觀察 從Tab 1可見:與S組比較,O組骨小梁面積百分數(%Tb.Ar)、骨小梁厚度(Tb.Th)、骨小梁數量(Tb.N)分別降低了50.4%、25.4%、50.9%(P<0.01),骨小梁分離度(Tb.Sp)升高了169.4%(P<0.05)。O+D組%Tb.Ar、Tb.N、Tb.Th分別減低了46.2%(P<0.01)、48.6%(P<0.01)、21.0%(P<0.05),Tb.Sp升高了131.7%(P<0.05)。與 O+D組比較,O+D+d組%Tb.Ar、Tb.N、Tb.Th分別升高了 122.3%(P<0.01)、79.1%(P<0.01)、27.5%(P<0.05),Tb.Sp降低了 54.2%(P<0.05)。與 D組比較,D+d組%Tb.Ar、Tb.N分別升高了108.8%(P<0.01)、68.4%(P<0.05),Tb.Sp降低了57.5%(P<0.01)。
Tab 1 Static parameters of bonemorphology in tibia(±s,n=10)
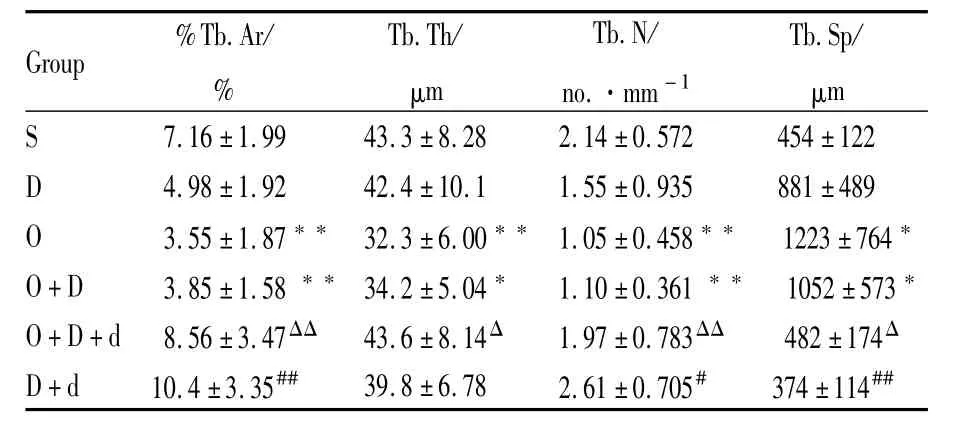
Tab 1 Static parameters of bonemorphology in tibia(±s,n=10)
*P<0.05,**P<0.01 vs Sgroup;#P<0.05,##P<0.01 vs D group;ΔP<0.05,ΔΔP<0.01 vs O+Dgroup
G r o u p %T b.A r/%T b.T h/μ m T b.N/n o.·m m-1 T b.S p/μ m S 7.1 6±1.9 9 4 3.3±8.2 8 2.1 4±0.5 7 2 4 5 4±1 2 2 D 4.9 8±1.9 2 4 2.4±1 0.1 1.5 5±0.9 3 5 8 8 1±4 8 9 O 3.5 5±1.8 7**3 2.3±6.0 0**1.0 5±0.4 5 8** 1 2 2 3±7 6 4*O+D 3.8 5±1.5 8**3 4.2±5.0 4* 1.1 0±0.3 6 1**1 0 5 2±5 7 3*O+D+d 8.5 6±3.4 7 ΔΔ 4 3.6±8.1 4 Δ 1.9 7±0.7 8 3 ΔΔ 4 8 2±1 7 4 Δ D+d 1 0.4±3.3 5## 3 9.8±6.7 8 2.6 1±0.7 0 5# 3 7 4±1 1 4##
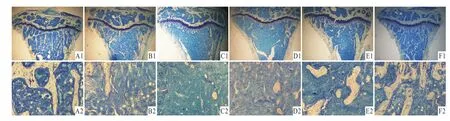
Fig 2 Trabecular area and trabecular morphology in tibiaSgroup:A1,A2;D group:B1,B2;O group:C1,C2;O+D group:D1,D2;O+D+d group:E1,E2;D+d group:F1,F2;Toluidine blue staining,A1~F1:4×,A2~F2:20×
2.4 各組小鼠脛骨上段破骨細胞形態及骨吸收靜態指標觀察
2.4.1 各組小鼠脛骨上段破骨細胞形態觀察 從Fig 3可見,S組破骨細胞附著骨表面,未發生極化現象,并未開始侵蝕骨小梁。D組破骨細胞已附著骨表面,與骨表面處較模糊,出現極化、皺褶緣或偽足,開始侵蝕骨小梁。O組破骨細胞位于Howship陷窩的骨表面,與骨表面處模糊不清,出現極化、皺褶緣或偽足,較深地侵蝕骨表面。O+D組破骨細胞位于Howship陷窩的骨表面,與骨表面處模糊不清,出現極化、皺褶緣或偽足,較深地侵蝕骨表面。O+D+d組破骨細胞附著骨表面,形成Howship陷窩不明顯,極化、皺褶緣或偽足跡象較弱。D+d組破骨細胞附著骨表面,形成Howship陷窩不明顯,極化、皺褶緣或偽足跡象較弱。
2.4.2 各組小鼠脛骨上段骨吸收的靜態指標觀察各組小鼠脛骨上段骨吸收的靜態指標見Tab 2,由Tab 2可見:與S組比較,D組破骨細胞周長(Oc.Pm)、破骨細胞數(Oc.No.)、破骨細胞周長百分數(%Oc.S)、每毫米破骨細胞數(Oc.N/mm)分別升高了 105.7%(P<0.01)、109.2%(P<0.05)、125.8%(P<0.05)、139.2%(P<0.05)。O組 Oc.Pm、Oc.No.、%Oc.S、Oc.N/mm 分 別 升 高 了204.3%、248.7%、389.6%、508.4%(P<0.01)。O+D組 Oc.Pm、Oc.No.、%Oc.S、Oc.N/mm分別升高了 227.2%、327.4%、268.7%、410.2%(P<0.01)。與D組比較,O組Oc.Pm、Oc.No.、%Oc.S、Oc.N/mm分別升高了47.9%(P<0.01)、66.7%(P<0.01),116.8%(P<0.05)、154.4%(P<0.05)。O+D組Oc.Pm升高了59.1%(P<0.05)。D+d組 Oc.Pm、%Oc.S、Oc.N/mm分別降低了57.5%、79.9%、66.2%(P<0.01)。與O+D組比較,O+D+d組 Oc.Pm、Oc.No.、%Oc.S、Oc.N/mm分別降低了59.1%、47.4%、74.2%、65.6%(P<0.01)。
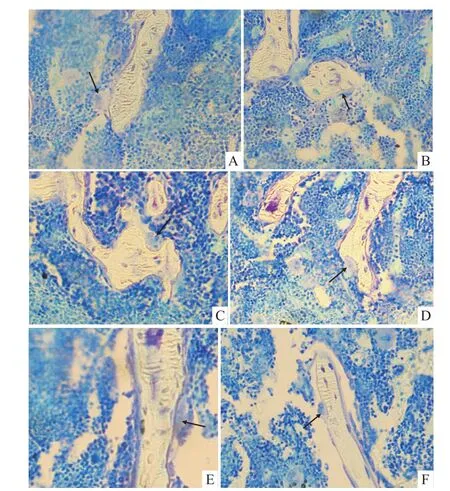
Fig 3 M orphology of osteoclast in tibiaSgroup:A;D group:B;O group:C;O+D group:D;O+D+d group:E;D+d group:F;Toluidine blue staining(20×)
Tab 2 Static parameters of bone resorption in tibia(±s,n=10)

Tab 2 Static parameters of bone resorption in tibia(±s,n=10)
*P<0.05,**P<0.01 vs Sgroup;#P<0.05,##P<0.01 vs Dgroup;ΔΔP<0.01 vs O+D group;□□P<0.01 vs O+D+d group.
G r o u p O c.P m/m m O c.N o./N o. %O c.S/% O c.N/m m/N·m m-1 S 0.0 4 3 7±0.0 3 2 8 0.8 8 9±0.7 3 7 0.8 6 8±0.7 4 3 0.1 6 6±0.1 3 2 D 0.0 8 9 9±0.0 2 2 5**1.8 6±0.6 3 9* 1.9 6±0.9 6 9* 0.3 9 7±0.2 0 5*O 0.1 3 3±0.0 2 8 3**##3.1 0±0.9 4 3**## 4.2 5±2.2 6**# 1.0 1±0.5 8 8**#O+D 0.1 4 3±0.0 3 2 9**# 3.8 0±1.0 8** 3.2 0±1.1 7** 0.8 4 7±0.3 1 4**O+D+d 0.0 5 8 5±0.0 2 4 5#ΔΔ 2.0 0±0.6 6 7**ΔΔ 0.8 2 6±0.2 9 7##ΔΔ 0.2 9 1±0.0 8 9 9*ΔΔ D+d 0.0 3 8 2±0.0 3 3 8## 1.3 0±1.1 0 0.3 9 4±0.2 9 9##□□ 0.1 3 4±0.0 9 6 5##□□
2.5 各組小鼠脛骨上段成骨細胞形態觀察 各組小鼠脛骨上段成骨細胞形態見Fig 4,由Fig 4可見,S組成骨細胞在骨表面排列緊密,呈圓柱形,其下面貼近骨表面處可見一層較厚嗜酸性的類骨質。D組成骨細胞在骨表面排列稀疏,呈扁平狀,其分泌嗜酸性類骨質較少。O組成骨細胞在骨表面排列稀疏,呈扁平狀,其分泌嗜酸性類骨質少。O+D組成骨細胞在骨表面排列稀疏,呈扁平狀,其分泌嗜酸性類骨質少。O+D+d組成骨細胞在骨小梁表面排列較緊密,呈圓柱形,其分泌嗜酸性類骨質較多。D+d組成骨細胞在骨小梁表面排列較緊密,呈圓柱形,其分泌嗜酸性類骨質較多。
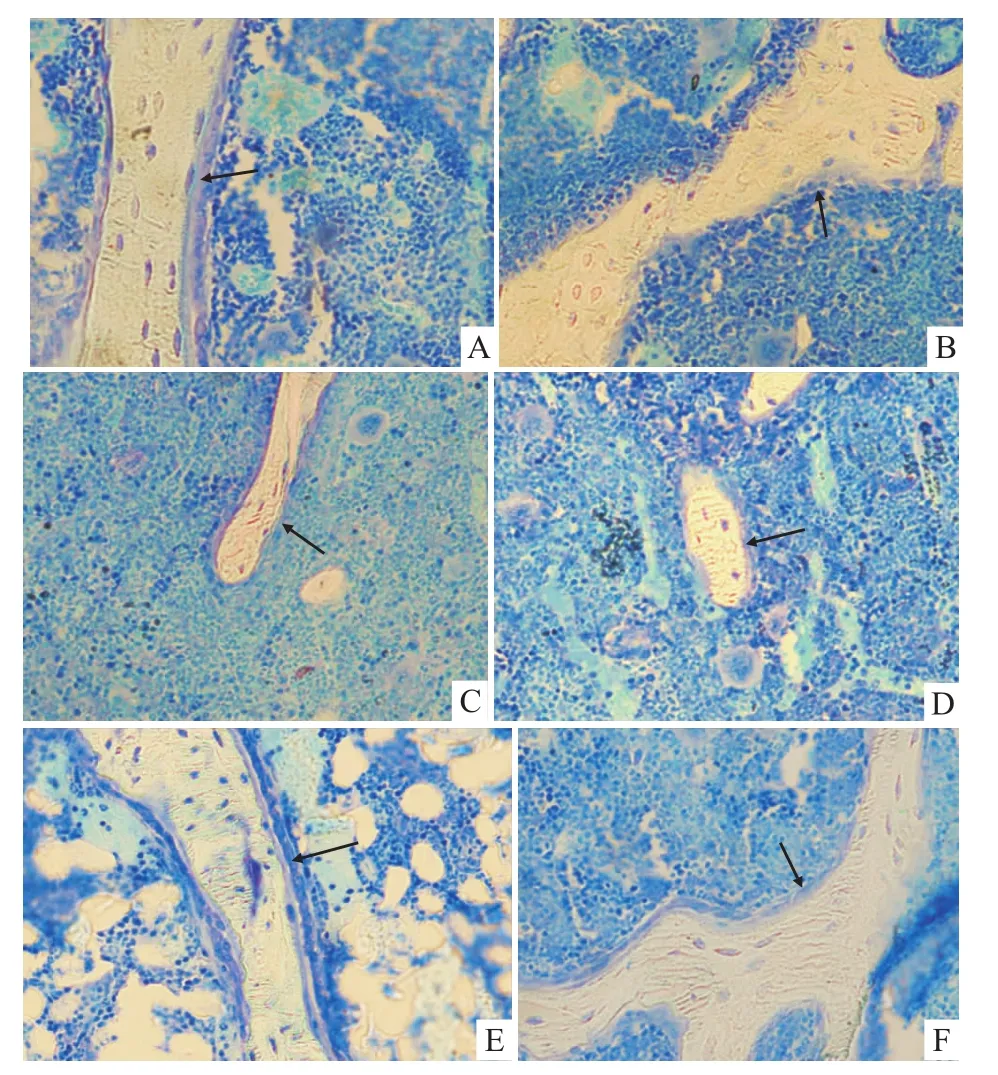
Fig 4 M orphology of osteoblast in tibiaSgroup:A;D group:B;O group:C;O+D group:D;O+D+d group:E;D+d group:F;Toluidine blue staining(20×)
2.6 各組小鼠脛骨上段骨形成動態指標觀察 與S組比較,O組單標記周長(sL.Pm)、雙標記周長(dL.Pm)、雙標記間距(Ir.L.Wi)、標記周長百分數(%L.Pm)分別降低了 77.3%、91.7%、68.9%、73.4%(P<0.01)。O+D組 sL.Pm、dL.Pm、Ir.L.Wi、%L.Pm分別降低了 56.6%、74.2%、34.4%、46.1%(P<0.05)。與D組比較,O組 sL.Pm、dL.Pm、Ir.L.Wi、%L.Pm分別降低了 64.5%(P<0.01)、68.8%(P<0.01)、59.2%(P<0.01)、59.5%(P<0.05)。O+D組sL.Pm降低了32.1%(P<0.05),D+d組 sL.Pm、dL.Pm分別升高了104.7(P<0.01)、99.0%(P<0.05)。與 O+D組比較,O+D+d組 sL.Pm、dL.Pm、Ir.L.Wi、%L.Pm分別升高了 118.0%(P<0.01)、106.4%(P<0.01)、46.6%(P<0.05)、49.4%(P<0.05),見Tab 3。
Tab 3 Dynam ic parameters of bone formation in tibia(±s,n=10)
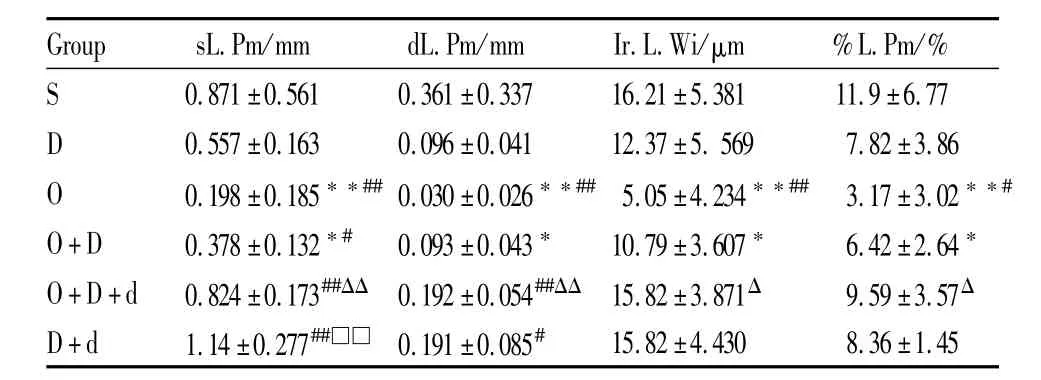
Tab 3 Dynam ic parameters of bone formation in tibia(±s,n=10)
*P<0.05,**P<0.01 vs Sgroup;#P<0.05,##P<0.01 vs Dgroup;ΔP<0.05,ΔΔP<0.01 vs O+Dgroup;□□P<0.01 vs O+D+d group.
Group sL.Pm/mm dL.Pm/mm Ir.L.Wi/μm %L.Pm/%S 0.871±0.561 0.361±0.337 16.21±5.381 11.9±6.77 D 0.557±0.163 0.096±0.041 12.37±5.569 7.82±3.86 O 0.198±0.185**##0.030±0.026**## 5.05±4.234**## 3.17±3.02**#O+D 0.378±0.132*# 0.093±0.043* 10.79±3.607* 6.42±2.64*O+D+d 0.824±0.173##ΔΔ 0.192±0.054##ΔΔ 15.82±3.871Δ 9.59±3.57Δ D+d 1.14±0.277##□□ 0.191±0.085#15.82±4.430 8.36±1.45
2.7 各組小鼠脛骨上段骨形成熒光及動態指標觀察
2.7.1 各組小鼠脛骨上段骨形成熒光觀察 S組熒光多、亮,雙熒光間距較大。D組熒光少,比較暗淡,只見單熒光。O組和O+D組熒光少且弱。O+D+d組較O+D組熒光有所改善,雙熒光間距較小,但比較模糊、暗淡。D+d組較D-半乳糖組有所改善,可見雙熒光且間距較大,但還是比較模糊、暗淡,見 Fig 5。
2.7.2 各組小鼠脛骨上段骨生長的動態指標觀察與S組比較,D組骨礦化沉積率(MAR)、骨形成率(BFR/TV、BFR/BV、BFR/BS)分別降低了44.4%、77.0%、78.2%、74.6%(P<0.05)。O組MAR、BFR/TV、BFR/BV、BFR/BS分別降低了73.2%、95.7%、93.5%、94.1%(P<0.01)。O+D組 MAR、BFR/TV、BFR/BV、BFR/BS分別降低了40.1%(P<0.05)、79.0%(P<0.01)、73.0%(P<0.05)、63.6%(P<0.01)。與D組比較,O組MAR、BFR/TV、BFR/BV、BFR/BS分別降低了 51.9%(P<0.05)、81.1%(P<0.05)、70.3%(P<0.01)、76.7%(P<0.01)。D+d組 MAR、BFR/TV、BFR/BV、BFR/BS分 別 升 高 了 75.2%、416.1%、195.8%、174.8%(P<0.01)。與 O+D組比較,O+D+d組 MAR、BFR/TV、BFR/BV、BFR/BS分別升高了 62.6%(P<0.01)、287.6%(P<0.01)、217.1%(P<0.05)、120.1%(P<0.05),見 Tab 4。
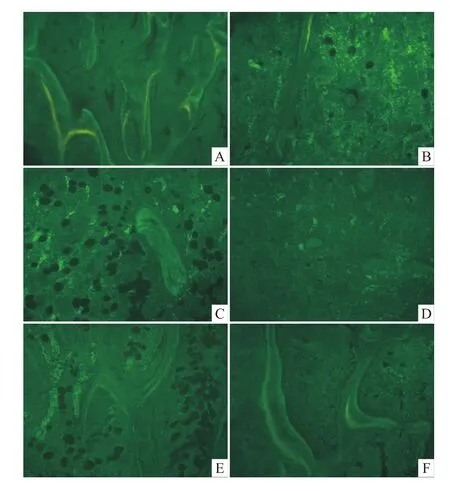
Fig 5 Fluorescent of bone formation in tibiaSgroup:A;D group:B;O group:C;O+D group:D;O+D+d group:E;D+d group:F;Thick slices with fluorescence photographs without staining(20×)
Tab 4 Dynam ic parameters of bone formation in tibia(±s,n=10)

Tab 4 Dynam ic parameters of bone formation in tibia(±s,n=10)
*P<0.05,**P<0.01 vs Sgroup;#P<0.05,##P<0.01 vs D group;ΔP<0.05,ΔΔP<0.01 vs O+Dgroup
Group MAR/μm·d-1 BFR/TV/%·yr-1 BFR/BV/%·yr-1 BFR/BS/%·yr-1 S 2.32±0.769 26.9±18.9 455±320 10.0±5.79 D 1.29±0.274* 6.20±5.32* 99.4±27.4* 2.54±0.867*O 0.621±0.553**# 1.17±1.17**# 29.5±29.1**## 0.593±0.590**##O+D 1.39±0.673* 5.65±3.07** 123±97.4* 3.64±2.93**O+D+d 2.26±0.553##ΔΔ 21.9±8.27##ΔΔ 390±269#Δ 8.01±3.86##Δ D+d 2.26±0.633## 32.0±13.9## 294±104## 6.98±2.52##
3 討論
3.1 小鼠去卵巢骨質疏松模型的骨形態學特點與S組比較,O組骨小梁數量與面積明顯減少,結構斷裂、稀疏,出現大片骨小梁缺失的骨髓區域,%Tb.Ar、Tb.Th、Tb.N降低,Tb.Sp升高,說明去卵巢致小鼠骨量丟失嚴重,骨小梁密度降低,分離度增加,呈現典型的骨質疏松形態學特點。破骨細胞較深地侵蝕骨表面,骨吸收參數升高,表明破骨細胞活性和數量增加,骨吸收功能活躍。成骨細胞在骨表面排列稀疏,呈扁平狀,分泌嗜酸性類骨質少,熒光少且弱,骨形成參數降低,表明成骨細胞數量少,功能不活躍、骨形成功能降低。綜上所述,本實驗去卵巢模型骨形成降低,骨吸收增加,符合低轉換型骨質疏松,與張延嬌等[5]研究發現不一致,這可能與實驗周期有關,張延嬌等實驗周期為42 d,本實驗周期為70 d,去卵巢屬于快速骨丟失,破骨細胞活性增加,骨吸收功能活躍,可能越到后期骨量丟失越多,本實驗發現O組骨量丟失嚴重,破骨細胞數量多、活性強,熒光標記部分的骨表面被破骨細胞快速侵蝕,導致骨量明顯減少。這些結果提示,去卵巢初期成骨細胞的功能是活躍的,表現為高轉換型骨質疏松,隨著成骨細胞功能的衰退,后期則出現低轉換型的骨質疏松,對此有待進一步觀察。
去卵巢致骨質疏松的發生是一個相當復雜的過程,有多種刺激因素的作用和眾多調節因子參與了骨質疏松的發病機制,在這些因素的相互作用和共同影響下最終導致骨質疏松的發生,其中氧化應激是絕經期婦女骨質疏松的一個重要發病機制[6]。近年來研究表明,去卵巢導致骨質疏松的發生的機制與OPG/RANKL/RANK系統密切相關[7]。Wnt/β-catenin信號通路也參與了去卵巢致骨質疏松的發生過程,通過調節成骨細胞的功能,從而間接調節骨形成[8]。
3.2 小鼠D-半乳糖骨質疏松模型的骨形態學特點及雌激素的影響 與S組比較,D組%Tb.Ar、Tb.Th、Tb.N有減少的趨勢,Tb.Sp有增加的趨勢,但均無統計學意義。雖然從Fig 2-B1、B2中可以看出骨小梁結構稀疏、變細、斷裂等變化,但并不能呈現出典型的骨質疏松形態學改變。破骨細胞在骨表面開始侵蝕骨小梁,骨吸收參數升高,表明破骨細胞數量和活性增加,骨吸收功能活躍。成骨細胞在骨表面排列稀疏,呈扁平狀,分泌嗜酸性類骨質較少,熒光少、暗淡,只見單熒光,骨形成參數降低,說明成骨細胞功能不活躍,骨形成功能降低。綜上所述,D-半乳糖屬于低轉換型骨丟失,與羅紅梅等[9]研究發現一致。與O組比較,骨吸收參數降低,說明D組骨吸收功能較O組弱,而骨形成參數升高,說明D組比O組骨形成功能強。給予雌激素后,D+d組骨小梁數量明顯增加,連續性較好,骨小梁分離度減少,破骨細胞數量減少,骨吸收活性降低,成骨細胞活性和骨形成功能增強,并降低該模型體重。
D-半乳糖是一種還原性單糖,在細胞醛糖還原酶的作用下,轉化為不能被機體進一步代謝的半乳糖醇,堆積在細胞內,導致細胞腫脹、功能障礙、代謝紊亂,短時間內引起機體衰老。實驗動物長期注射D-半乳糖會產生一系列與自然衰老相似的病理變化,有研究表明[10]男性骨質疏松不僅與雄性激素減少有關,與衰老的發生過程也有關,是一種低轉換的骨丟失,與本實驗研究結果一致,故D-半乳糖對研究老年性骨質疏松可能有重要意義。雖然D-半乳糖對雌性小鼠骨量的影響存在不一致的結果,作者認為該結果與劑量、給藥時間和年齡有關。羅紅梅等[3]D-半乳糖劑量為 600 mg·kg-1和 1200 mg·kg-1,給藥2個月,發現D-半乳糖提高♀小鼠骨礦程度。覃冬云等[11]D-半乳糖劑量為 1000 mg·kg-1,給藥42 d,發現 D-半乳糖對3月齡♀小鼠發生骨質丟失,而對1月齡♀小鼠無影響。本實驗給藥劑量為120mg·kg-1,給藥時間70 d,發現♀小鼠脛骨上段骨吸收活躍,骨形成降低,如果適當延長給藥時間,應該可以造成典型老年性骨質疏松模型。有研究報道[9],D-半乳糖致骨質疏松機制可能與因腦老化導致腦-垂體-性腺功能紊亂有關。本實驗研究表明,雌激素對半乳糖致小鼠骨質疏松具有預防作用,故D-半乳糖致骨質疏松機制可能與引起體內激素水平下降有關。
3.3 小鼠去卵巢加D-半乳糖骨質疏松模型的特點及雌激素的影響 與S組比較,O+D組骨小梁大量丟失,骨小梁間隙增大,%Tb.Ar、Tb.N、Tb.Th降低,Tb.Sp升高,說明骨量丟失嚴重,骨微結構破損,骨小梁厚度和數量降低,分離度增加。破骨細胞較深地侵蝕骨表面,骨吸收參數升高,表明破骨細胞數量增加,骨吸收功能活躍。成骨細胞在骨表面排列稀疏,呈扁平狀,其分泌嗜酸性類骨質少,熒光少且弱,骨形成參數降低,表明成骨細胞功能不活躍,骨形成降低。與O組比較,O+D組骨吸收與骨形成參數沒有統計學意義,可知去卵巢后再給予D-半乳糖并不能加重骨質疏松的進程,其原因可能是小鼠去卵巢70 d后,兩組小鼠骨量已經丟失很嚴重,D組比O組骨吸收弱,而骨形成比去卵巢強,其骨量減少程度遠不如去卵巢,故即使去卵巢聯合D-半乳糖也不能得到明顯的統計學意義。或者70 d這不是最適合觀察時間點,因為這時兩組骨量都已經嚴重丟失。與D組比較,O+D組小鼠骨形態計量學參數均無統計學意義,說明兩組骨量變化無明顯差異。補充雌激素后,骨量、骨小梁厚度、數量增加,分離度降低,破骨細胞骨吸收功能降低,數量減少,成骨細胞活性增加,促進骨形成,降低該模型體重。
去卵巢加D-半乳糖致小鼠骨質疏松模型目前未見研究報道,本課題組為模擬正常婦女絕經期與衰老同時發生的生理過程來更好地模擬骨質疏松的發生過程,利用D-半乳糖所致衰老與去卵巢模擬絕經期雌激素缺乏的基本原理來聯合制模。本實驗研究發現去卵巢合并D-半乳糖確實能明顯地減低小鼠脛骨上段骨量,可以作為一種新的骨質疏松動物模型。本實驗研究發現己烯雌酚能改善該模型的骨丟失。其抗骨質疏松機制可能與以下幾點有關。(1)通過誘導破骨細胞的凋亡,抑制成骨細胞的凋亡[12]。(2)直接作用成骨細胞,促進骨形成[13]。(3)提高機體抗氧化能力[14]。
去卵巢、D-半乳糖、去卵巢聯合D-半乳糖均能建立小鼠骨質疏松模型,相對去卵巢小鼠骨質疏松模型而言,D-半乳糖小鼠骨質疏松模型骨形成活性較高,骨吸收活性較低,雌激素能有效預防D-半乳糖和去卵巢聯合D-半乳糖致小鼠骨質疏松模型的骨丟失,可作為研究抗骨質疏松藥物的陽性對照藥。
參考文獻:
[1] Brown JP,Fortier M,Frame H,et al.Canadian consensus conference on osteoporosis[J].JObstet Gynaecol Can,2006,28:95-112.
[2] 覃冬云,吳 鐵,崔 燎,等.D-半乳糖導致小鼠骨丟失及其機制初探[J].中國藥理學通報,2003,19(9):1017-9.
[2] Qin D Y,Wu T,Cui L,et al.The effect of D-galactose on bone metabolism inmice and itsmechanism[J].Chin Pharmacol Bull,2003,19(9):1017-9.
[3] 羅紅梅,崔 燎,吳 鐵.D-半乳糖對不同性別小鼠骨的影響[J].微量元素與健康研究,2012,29(1):4-7.
[3] Luo H M,Wu T,Cui L.Effectof D-galactose on bone of different gendermouse[J].Stud Trace Elements Health,2012,29(1):4-7.
[4] 崔 燎,吳 鐵.骨質疏松藥理學-動物實驗與圖譜[M].北京:科學出版社,2011:43-4.
[4] Cui L,Wu T.Pharmacological studiesof anti-Osteoporosisand the atlas[M].Beijing:Science Press,2011:43-4.
[5] 張延嬌,李紹新,陳 博.哌嗪雌酚酮對生長期去卵巢小鼠脛骨骨形態計量學的影響[J].廣東醫學院學報,2010,28(2):125-8.
[5] Zhang Y J,Li SX,Chen B.The effect of piperazinyl estrone on bone histomorphometry of tibia in developing OVX mice[J].J Guangdong Med Coll,2010,28(2):125-8.
[6] Yin H,Shi ZG,Yu Y S,etal.Protection againstosteoporosis by statins is linked to a reduction of oxidative stress and restoration of nitric oxide formation in aged and ovariectomized rats[J].Eur J Pharmacol,2012,674:200-6.
[7] Roggia C,Gao Y,Cenci S,etal.Up-regulation of TNF-producing T cells in the bone marrow:a key mechanism by which estrogen deficiency induces bone loss in vivo[J].Proc Natl Acad Sci USA,2001,98:13960-5.
[8] Bodine P V,Komm B S.Wnt signaling and osteoblastogenesis[J].Rev Endocr Metab Disord,2006,7(1-2):33-9.
[9] 羅紅梅,崔 燎,吳 鐵,等.D-半乳糖致雄性大鼠的骨丟失[J].中國組織工程研究與臨床康復,2011,15(7):1146-9.
[9] Luo H M,Cui L,Wu T.D-galactose induced bone loss in male rats[J].JClin Rehab Tissue Engin Res,2011,15(7):1146-9.
[10]Drake M T,Khosla S.Male osteoporosis[J].Endocrinol Metab Clin North Am,2012,41(3):629-41.
[11]覃冬云,吳 鐵,崔 燎.D-半乳糖對不同月齡雌性小鼠骨代謝的影響[J].中國骨質疏松雜志,2004,10(1):27-9.
[11]Qin D Y,Wu T,Cui L.The effectof D-galactose on bonemetabolism in different-month-old mice[J].Chin J Osteoporos,2004,10(1):27-9.
[12]Kameda T,Mano H,Yuasa T,et al.Estrogen inhibits bone resorption by directly inducing apoptosisof the bone-resorbing osteoclasts[J].JExp Med,1997,186:489-95.
[13]Ikegami A,Inoue S,Hosoi T,et al.Immunohistochemical detection and northern blot analysis of estrogen receptor in osteoblastic cells[J].JBone Miner Res,1993,8:1103-9.
[14]Tang X L,Liu X J,Tian Q,et al.Dynamic oxidative stress and DNA damage induced by oestrogen deficiency and protective effects of puerarin and 17β-oestradiol in ovariectomized rats[J].Basic Clin Pharmacol Toxicol,2012,111(2):87-91.