香榧天然群體遺傳多樣性分析與評價研究
程詩明,閔 會,康志雄,梁君瑛
(1. 浙江省林業科學研究院,浙江 杭州 310023;2. 浙江現代中藥與天然藥物研究所,浙江 杭州 310052;3. 浙江省林業廳,浙江 杭州 310020)
香榧天然群體遺傳多樣性分析與評價研究
程詩明1,閔 會2,康志雄3,梁君瑛1
(1. 浙江省林業科學研究院,浙江 杭州 310023;2. 浙江現代中藥與天然藥物研究所,浙江 杭州 310052;3. 浙江省林業廳,浙江 杭州 310020)
選取香榧(Torreya grandis cv. Merrillii)主要分布區具有代表性的6個群體共92個個體的葉片和果實為實驗材料,采用表型和分子標記(AFLP)兩種不同的方法分別從不同層次來揭示香榧天然群體的遺傳多樣性。結果表明:表型與DNA水平多樣性分析兩種方法在揭示香榧遺傳多樣性水平上是一致的,相關系數為0.9783,具有較高的相關吻合性。二者均證實了香榧天然群體具有較高的遺傳豐富度,且遺傳變異主要集中在群體內。
香榧;表型;AFLP分析;遺傳多樣性
香榧(Torreya grandis cv. Merrillii)系裸子植物紅豆杉科(Taxaceae)榧屬(Torreya)常綠喬木。其全身是寶,是集果用、油用、藥用、材用、綠化、觀賞為一體的多用途經濟樹種,尤其以其名貴干果著稱中外。近年來,香榧干果市場緊俏,價格堅挺,加上其優良的材用價值,不少地區香榧天然群體遭到嚴重的人為破壞,因此急需對其開展遺傳多樣性研究以便進行種質資源保存,搶救基因資源。
本文采用表型及AFLP分子標記方法對香榧主要分布區6個主要群體進行遺傳多樣性研究,探討其遺傳結構及遺傳多樣性分布特點,為香榧遺傳多樣性保護策略的提出、種質資源保存及優異種質篩選提供科學合理的理論依據。
1 材料與方法
1.1 實驗材料
收集香榧主要分布區資料,進行香榧主要分布區的隨機分組取樣。分別采集了浙江省諸暨東白湖、鐘家嶺、磐安、紹興、嵊州和安徽省黃山地區六個主要群體共92個個體的葉片和果實作為實驗材料,每個群體覆蓋其分布區全部類型。
1.2 實驗方法
參照Falkenhagen、Putenikhin、Li等、羅建勛等[1~4]表型測定方法進行香榧表型性狀測定。
針葉測定:每單株隨機選取15枚針葉用直尺測定針葉的長度、寬度(中央)。
果實和種子測定:游標卡尺測定果實長度、寬度(中央直徑),每單株測定30個果實,同時測定單果重(不重復隨機抽樣)。種子測定方法同果實,長寬測量單位為cm,精度均為0.01 cm。質量測量單位為g,精度為0.01 g。
以香榧葉片為實驗材料,參考梁丹等[6]的實驗方法,進行相關AFLP分析。按有或無對每個樣品的擴增條帶進行記錄,選取片段大小在200 ~ 900 bp的清晰條帶為有效條帶。擴增條帶存在時記為1,無帶時記為0。運用POPGENE3.2計算多態性條帶(N)、多態位點百分率(P)、觀測等位基因數(Na)、有效等位基因數(Ne)、Nei基因多樣性指數(H)和Shannon信息指數(I)以及種群內總遺傳變異Ht、各種群內遺傳變異Hs、種群間遺傳分化系數Gst和種群間基因流動系數Nm。運用ARLEQUIN3.01進行種群間遺傳差異的分子方差分析;基于0/1矩陣運用NTSYS-pc 2.02進行UPGMA聚類分析。
2 結果與分析
2.1 香榧天然群體表型多樣性分析
2.1.1 各性狀的方差分析 對6個群體的92個香榧個體的針葉長、針葉寬、果實長、果實寬、單果重、種子長、種子寬、單粒重8個表型性狀進行巢式設計方差分析(表1),8個表型性狀在群體間和群體內都存在極顯著差異,說明香榧的表型性狀在群體間和群體內存在著廣泛的變異。
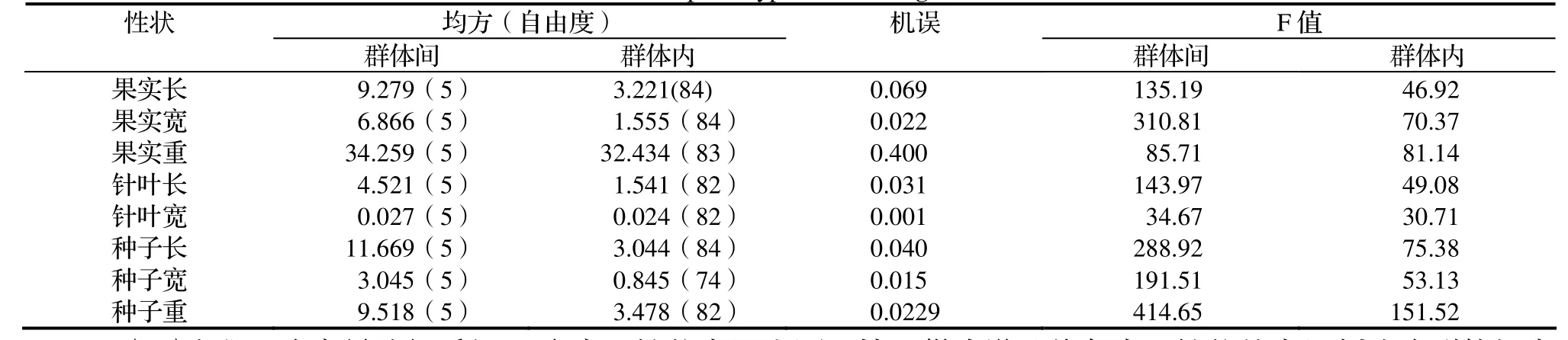
表1 香榧各表型性狀的方差分析Table 1 ANOVA on phenotypic traits in T. grandis cv. Merrillii
2.1.2 表型分化 為定量分析香榧8個表型性狀變異來源,按照巢式設計將各表型性狀的變異剖分為群體間變異、群體內變異和個體內變異(機誤),各層次上的方差分量百分比是說明變異來源的一個重要指標[5]。由表2可以看出,群體間方差分量百分比的平均值為8.7%,群體內方差分量百分比的平均值為72.8%。各表型性狀的表型分化系數(Vst)平均值為10.8%,群體內占89.2%,說明絕大多數變異存在于群體內,群體內多樣性大于群體間多樣性。
2.1.3 香榧表型變異的多重比較 用變異系數(CV)表示性狀值離散性特征,變異系數越大,性狀的測量值離散程度越大[6]。對測定所得數據進行分析,計算樣本平均數、標準差(表3)及變異系數(表4)。6個香榧群體各形態性狀的平均變異系數為20.28%,其中東白湖群體15.83%、黃山群體27.68%、磐安群體23.03%、紹興群體15.24%、鐘家嶺群體18.49%、嵊州群體21.43%。香榧不同形態性狀的平均變異程度由大到小的順序為:單粒重、單果重、針葉長、種子寬、針葉寬、種子長、果實長、果實寬。說明各性狀中,果實寬相對穩定。不同群體各形態性狀平均變異系數由大到小順序為:黃山、磐安、嵊州、鐘家嶺、諸暨東白湖、紹興。初步判斷遺傳多樣性豐富區在黃山、磐安一帶。
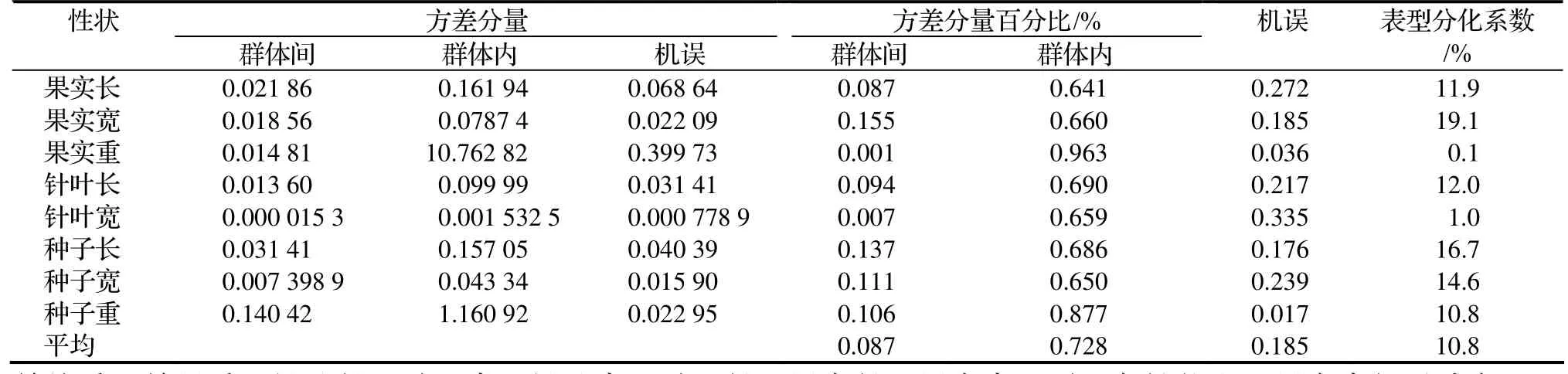
表2 香榧表型性狀方差分量及群體間與群體內表型分化系數Table 2 Variance component and differentiation coefficients of phenotypic traits in T. grandis cv. Merrillii
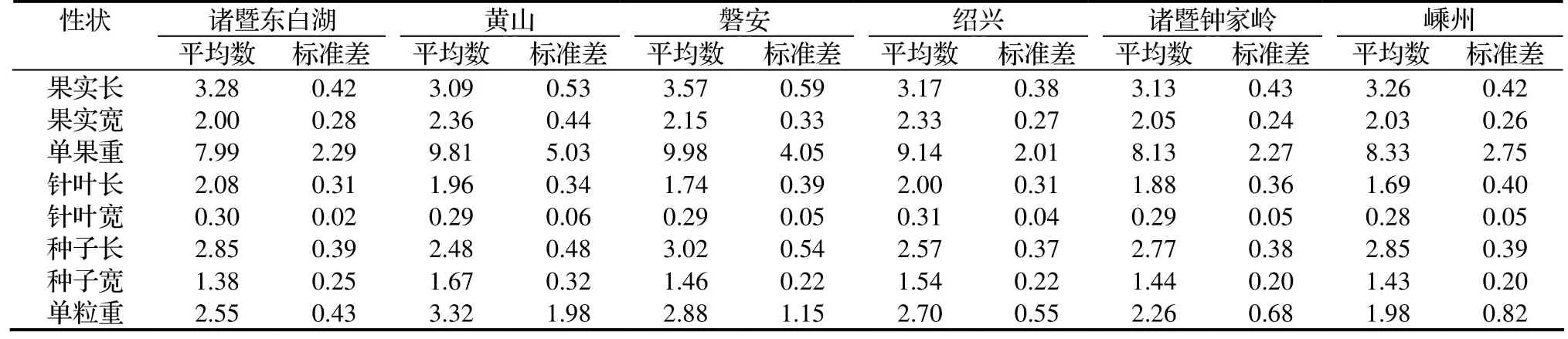
表3 香榧天然群體各性狀平均數及標準差Table 3 Mean and standard deviation of phenotypic traits in T. grandis cv. Merrillii populaions
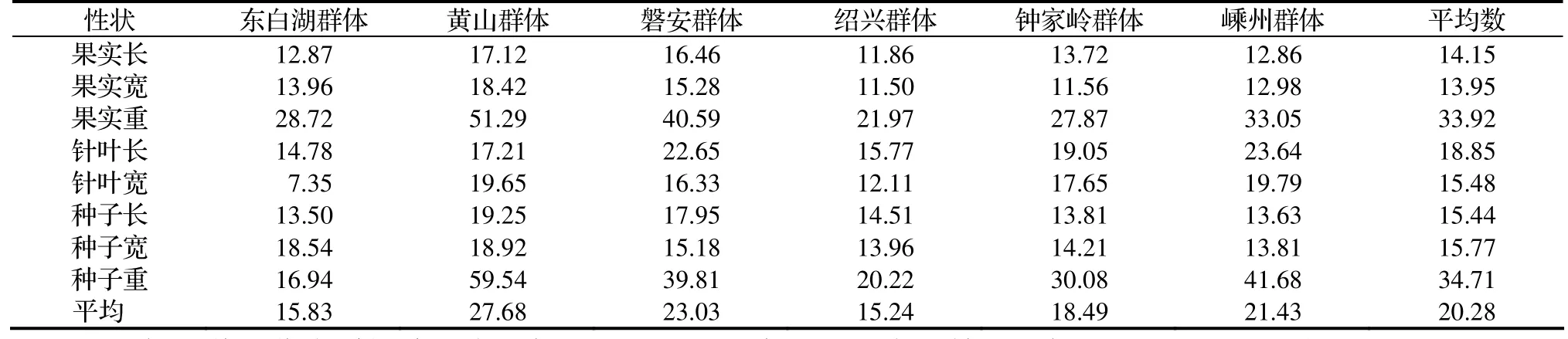
表4 香榧天然群體各性狀變異系數Table 4 Coefficient of variation of phenotypic traits in T. grandis cv. Merrillii populations
2.1.4 香榧天然群體表型性狀聚類分析 對針葉、果實、種子表型數據進行聚類分析,聚類結果如圖1所示。由圖中可以看出,以相似系數0.70劃分,可將6個香榧天然群體劃分為三類,其中諸暨鐘家嶺群體、東白湖群體與嵊州群體歸為一大類。黃山群體與紹興群體聚為一類,磐安群體獨自聚為一類。2.2 香榧天然群體遺傳多樣性的AFLP分析

圖1 香榧天然群體表型性狀聚類結果Figure 1 The cluster map of phenotypic traits in T. grandis cv. Merrillii populations
2.2.1 遺傳多樣性分析 8對 AFLP引物共檢測出364條譜帶,其中多態性譜帶63個。衡量種群遺傳多樣性最常用的指標有多態性條帶數、多態性位點比例、觀測等位基因數、有效等位基因數、Nei基因多樣性指數和Shannon信息指數。香榧天然群體在物種水平上的多態位點百分率高達100%(表5),從單個群體來看,香榧物種水平和群體水平的遺傳多樣性均比較高,各群體的多態位點百分率在79.73% ~ 98.41%,Nei基因多樣性為 0.309 6 ~ 0.376 8, Shannon信息指數為0.454 8 ~ 0.547 1,等位基因數為1.793 9 ~ 1.984 1,有效等位基因數為1.541 6 ~ 1.675 9。運用基因譜帶頻率方差分析比較群體間與群體內遺傳多樣性水平,結果顯示,香榧群體的遺傳多樣性主要存在于群體內(88.86%),群體內的變異明顯大于群體間。
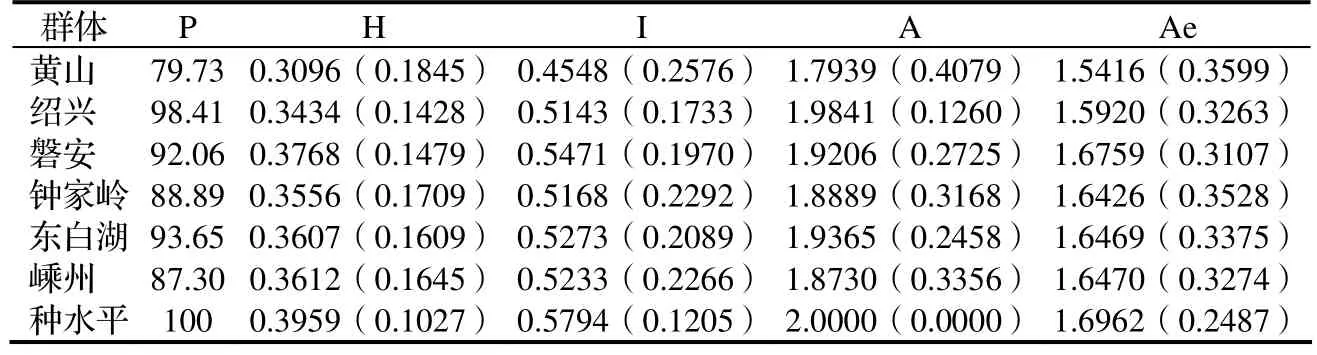
表5 香榧群體遺傳多樣性水平(括號內為標準差)Table 5 Genetic diversity within population in T. grandis cv. Merrillii populations
2.2.2 基因譜帶頻率方差分析 對6個供試群體AFLP標記的譜帶進行ANOVA方差分析(表6),結果表明:在譜帶頻率總方差的貢獻中,群體間占 11.14%,群體內占88.86%,研究群體的遺傳多樣性主要分布在群體內;群體間譜帶頻率存在差異不明顯(F = 1.425 3),基因譜帶頻率在群體間差異不明顯。
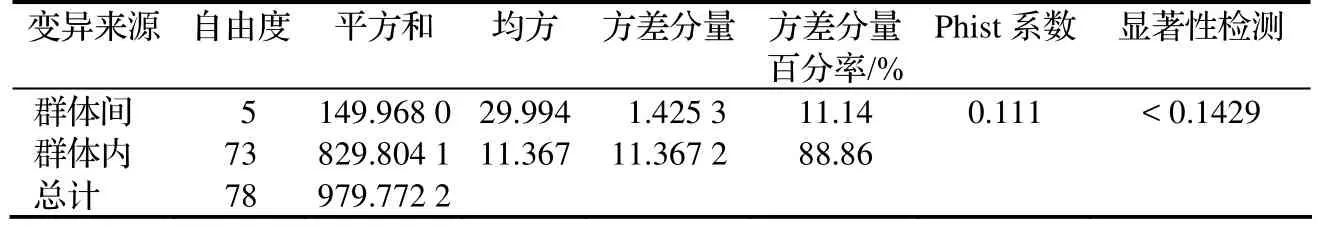
表6 香榧群體AFLP分子標記譜帶頻率方差分析(ANOVA)Table 6 ANOVA on band frequencies of AFLP from 6 T. grandis cv. Merrillii populations
2.2.3 遺傳分化 6個香榧群體種水平上的遺傳多樣性為0.396 3,群體間遺傳多樣性為0.045 1,群體內遺傳多樣性為0.351 2,群體間遺傳多樣性占11.38%,群體內遺傳多樣性占88.62%,群體內的遺傳多樣性大于群體間的遺傳多樣性。香榧群體間存在一定的分化,其遺傳分化系數為0.1136。香榧群體種水平上的基因流(Nm)為3.899 7[8~9]表明香榧群體間存在基因交流,且交流比較頻繁[10]。
2.2.4 遺傳一致度和遺傳距離 6個香榧群體遺傳一致度比較大,平均值為0.917 4,遺傳距離平均值為0.079 7,說明香榧群體之間存在一定程度的分化[10]。另外,I與D值還表明各群體間的遺傳關系,由表 7中可以看出,鐘家嶺群體與磐安群體間的遺傳關系最近(I = 0.9655, D = 0.0351);黃山群體與鐘家嶺群體、東白湖群體之間的遺傳關系最遠(D = 0.1267)。
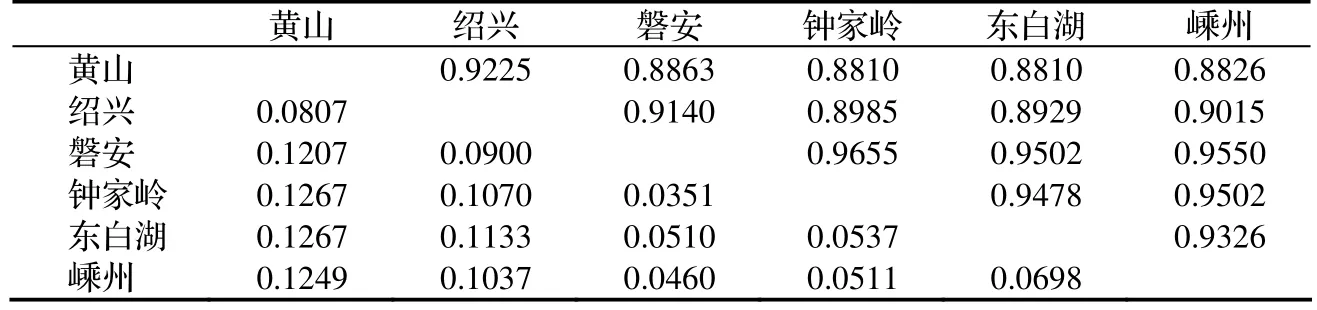
表7 群體間的遺傳一致度和遺傳距離Table 7 The genetic identity(I) and genetic distance(D) within population
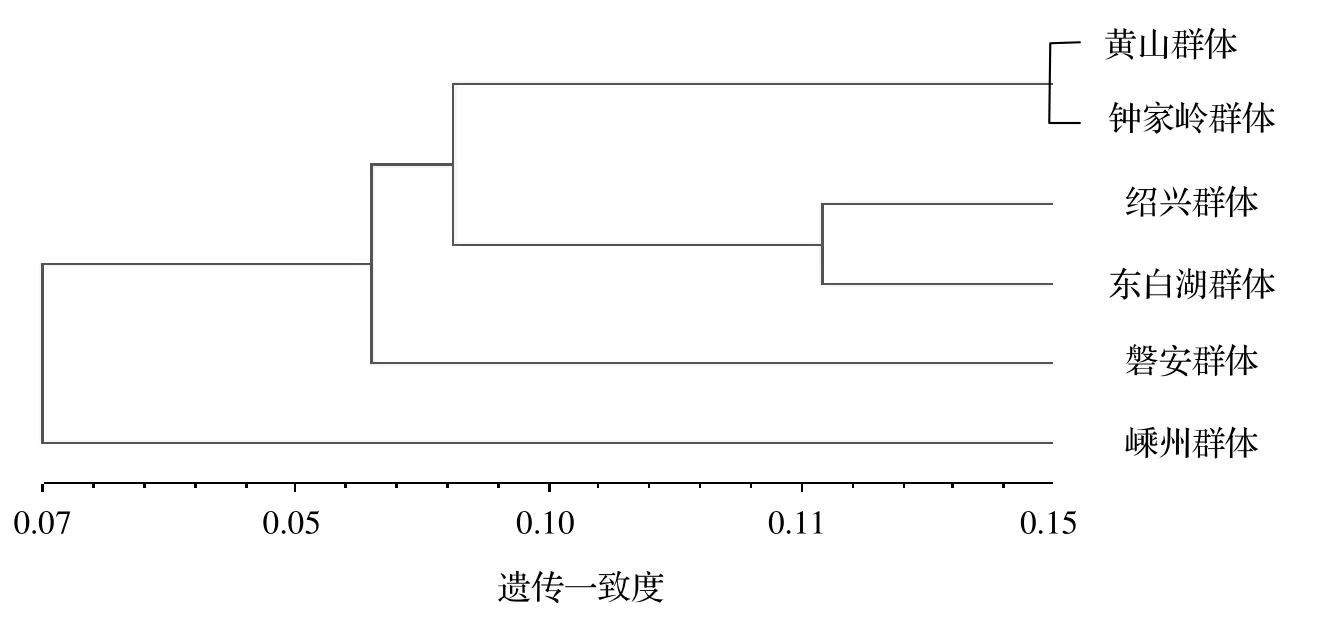
圖2 6個香榧群體遺傳一致度UPGMA聚類Figure 2 UPGMA dendrogram of using Nei’s unbiased genetic identity
2.2.5 UPGMA聚類分析 采用NTSYS軟件進行UPGMA聚類得到6個香榧群體的遺傳一致度聚類圖(圖2)。由圖2可以看出,以相似系數0.10進行劃分,可以將6個群體歸為4個類群,黃山群體和鐘家嶺群體歸為一類;紹興群體和東白湖群體歸為一類;嵊州群體和磐安群體各自聚為一類。
3 結論
3.1 遺傳分化系數
6個香榧群體表型性狀變異系數平均值為20.28%,DNA水平上的遺傳多樣性(Ht)為0.3963,均說明了香榧天然群體具有較為豐富的遺傳多樣性,遺傳變異豐富。
表型性狀方差分量剖分表明,群體間方差分量占8.7%,群體內占72.8%,機誤占18.5%,群體間的表型分化系數為10.8%;DNA水平上群體內的遺傳多樣性占88.62%,群體間的遺傳多樣性占11.38%,且在AFLP譜帶頻率總方差的貢獻中(AMOVA方差分析),群體間占11.14%,群體內占88.86%。由此可見,表型與DNA水平多樣性分析結果一致,均說明了香榧天然群體的遺傳變異主要存在于群體內,群體內變異大于群體間。
3.2 遺傳多樣性特點及分布規律
根據香榧表型性狀的變異數(CV)以及表型分化變異(Vst),初步判定香榧表型變異豐富區在黃山、磐安一帶,表型變異最低的是諸暨東白湖、紹興一帶。根據AFLP分析中各群體的多態位點百分率(P)、Nei基因多樣性指數(H)以及Shannon信息指數(I),確定供試6個香榧群體中變異豐富區在磐安、嵊州一帶,變異最低的在黃山、紹興一帶。由此可見,表型多樣性與DNA水平多樣性分布除黃山群體外基本趨于一致,磐安群體無論是表型還是DNA水平遺傳豐富度都較高,而紹興群體的遺傳豐富度則相對為最低。磐安地區屬于古香榧富集區,基因資源相對較為豐富,在后期的發展過程中,受外部條件影響也相對較小,因此無論是表型還是DNA水平,都具有較高的遺傳豐富度。而紹興地區曾是香榧會稽山區的主產區,但是由于細榧價格是米榧的三倍以上,造成大量非細榧類型被高接換品種,再加上香榧雌雄異株,產區農民為增加產量,進行人工授粉,雄株大量砍伐,造成遺傳多樣性降低。而對于黃山地區來說,其所產香榧主要是米榧系列,其基因資源并沒有較大的遺傳豐富度,但是由于表型受環境影響影響比較大,則表現出了較為豐富的遺傳多樣性。
3.3 反映遺傳分化參數的典型相關分析
在SAS軟件用CANCORR過程實現表型多樣性與AFLP多樣性的典型相關分析。選擇表型多樣性參數變異系數(CV)作為第一組變量,AFLP多樣性參數多臺百分率(P)、基因多樣性(H)、Shannon信息指數(I)作為第二組變量,進行典型相關分析,結果如表8示。典型相關系數為0.978 3,且在顯著性檢驗中P值達到0.063 6,說明二者具有較高的相關性,進一步揭示了表型與DNA水平多樣性分析結果的一致性、科學性。

表8 典型相關系數及其顯著性檢驗Table 8 The canonical correlation coefficient and test of H0
4 討論
本實驗采用表型與DNA分子標記兩個層次來揭示香榧天然群體的遺傳多樣性,二者結果一致,最終都表明香榧天然群體具有較高的遺傳多樣性,且遺傳變異主要集中在群體內,群體內變異明顯大于群體間。表型多樣性研究結果表明,6個香榧群體平均變異系數為20.28%,群體間的表型分化系數為10.8%;DNA水平研究結果顯示,6個香榧群體總的遺傳多樣性(Ht)為0.396 3,群體分化系數(Gst)為0.113 6。
香榧天然群體的遺傳多樣性主要集中在群體內,因此在進行香榧種質資源保存時,可根據現有情況充分利用,除可以進行異地保存,建立異地保存林外,有些遺傳多樣性較高的群體,遺傳變異豐富,可以直接進行原地保存。而對于香榧遺傳改良來說,在重視群體間選擇的同時,可增大群體內選擇的力度,進而推薦優異種質或品種用于生產,促使香榧的發展走向產業化、規模化。
參考文獻:
[1] Falkenhagen E R. Multivariate classification in provenance research[J]. Silvae Genet, 1978, 27(1):14-23.
[2] Putenikhin V P. Phenotype analysis of Picea obovatain the southern Urals population structure[J]. Lesovedenie, 1997(6):37-49.
[3] Li Peng, Beaulieu J, Bousquet J. Genetic structure and patterns of genetic variation among populations in eastern white spruce(Picea glauca)[J]. Can J For Res, 1997,27(2):189-191.
[4] 羅建勛,李曉清,孫鵬,等. 云杉天然群體的表型變異[J]. 東北林業大學學報,2003,31(1):9-11.
[5] 張恒慶,安利佳,祖元剛. 天然紅松種群形態特征地理變異的研究[J]. 生態學報,1999,19(6):932-938.
[6] 梁丹,吳勇,曾燕如,等. 香榧AFLP實驗體系的建立[J]. 福建林業科技,2007,34(2):93-96.
[7] Zhang Jian-hua. Variation and allometry of seed weight in Aeschynomene Americana[J]. Ann Bot, 1998(82):843-847.
[8] Wirght S. The genetic structure of populations [J]. Ann Eugen, 1951(15):323-35.
[9] 程詩明. 苦楝聚合群體遺傳多樣性研究與核心種質構建[D]. 北京:中國林業科學研究院,2005.
[10] Nybom H. Comparison of different nuclear DNA markers for estimating intra specific genetic diversity in plants[J]. Mol Ecol, 2004(13):1 143-1 155.
Genetic Diversity of Different Populations in Torreya grandis cv. Merrillii
CHENG Shi-ming1,MIN Hui2,KANG Zhi-xiong3,LIANG Jun-ying4
(1. Zhejiang For estry Academy, H angzhou 310023, China; 2. Modern Chinese Medicine and Natural Me dicine Research Institute of Zhe jiang, Hangzhou 310052, China; 3. Zhejiang Forestry Department, Hangzhou 310020, China)
Leaves and fruits were collected from 92 Torreya grandis cv. Merrillii trees of 6 representative populations in Zhejiang and Anhui province. Phenotypic identification and amplified fragment length polymorphism (AFLP) were used to analyze the genetic diversity. The correlation coefficient between phenotypic diversity and genetic diversity of different populations by AFLP was 0.9783, which proved the consistency of the two results. It also proved that T. grandis cv. Merrillii had a high genetic diversity and the variation is mainly within populations.
Torreya grandis cv. Merrillii; phenotypic; AFLP analysis; genetic diversity
S718.46
A
1001-3776(2014)04-0011-06
2014-03-24;
2014-06-05
“十一五”國家科技支撐課題“林木、花卉基因資源發掘與種質創新利用研究”子課題“東亞熱帶林木基因資源創新利用研究”(2006BAD13B07-9)、浙江省自然科學基金項目“香榧天然群體遺傳多樣性研究與優異種質創新利用”(Y306613)、浙江省科研院所專項“浙江省特色經濟林種質資源的收集、保存與創新利用研究”(2006F11002)、浙江省科技計劃項目“森林食品研究創新團隊建設與人才培養“(2012F20012)、浙江省森林食品研究重點實驗室(2011F10069)的研究內容。
程詩明(1975-),男,安徽安慶人,副研究員,博士,從事林木遺傳育種研究。

