Na2CrO4-NaOH-H2O體系中Na2CrO4蒸發結晶工藝研究*
劉歡 ,張炳燭 ,田穎 ,張小飛 ,張洋 ,徐紅彬 ,張懿
(1.河北科技大學化學與制藥工程學院,河北石家莊050018;2.中國科學院過程工程研究所濕法冶金清潔生產技術國家工程實驗室;3.中國科學院綠色過程與工程重點實驗室)
現行鉻鹽生產工藝根據鉻鐵礦與堿的反應方式可分為焙燒法工藝和液相法工藝[1]。針對國內焙燒法工藝存在的鉻資源利用率低、鉻渣污染嚴重等問題[2-3],中國科學院過程工程研究所開發了亞熔鹽液相氧化法鉻鹽清潔工藝[4-6]。目前以氫氧化鉀為反應介質的鉀系亞熔鹽法鉻鹽清潔工藝已在河南義馬建成了萬噸級示范裝置并實現連續穩定運行[7-8],以氫氧化鈉為反應介質的鈉系亞熔鹽法鉻鹽清潔工藝已完成實驗室開發。鈉系亞熔鹽液相氧化法制備鉻酸鈉的工藝流程[9]:鉻鐵礦在NaOH溶液中加壓氧化分解后,鉻鐵礦中的三價鉻被氧化成六價鉻并以Na2CrO4的形式進入系統,鋁以NaAlO2形式進入系統。將浸取后得到的漿料降溫后進行首次固液分離,可得到含Na2CrO4粗晶的浸取渣和浸取液。將浸取渣加水溶解后再次固液分離,得到的溶解液首先通過添加氧化鈣脫除少量的Al和Si雜質,再通過蒸發鹽析結晶的方法分離出Na2CrO4晶體;首次浸取液和蒸發結晶母液返回反應體系中循環使用,再次參加與鉻鐵礦的浸取反應。因蒸發結晶工藝過程獲得的Na2CrO4晶體的質量,將直接影響下游產品轉化過程所制備的重鉻酸鈉、鉻酸酐、氧化鉻等鉻鹽產品的質量,因此對Na2CrO4晶體的質量控制成為了上述工藝過程的關鍵環節。
鄒興等[10]研究了 30~110 ℃下 Na2CrO4-NaOHH2O體系的溶解度等溫線,發現在NaOH質量濃度<550 g/L時,Na2CrO4溶解度隨溫度變化不大,適合采用蒸發結晶的方法分離。如采用常壓蒸發結晶工藝,具有操作溫度較高、對蒸發器的材質要求較高且容易結垢等問題,而真空蒸發結晶工藝則兼有流程簡單、耗能低、產品質量好等優勢[11]。筆者通過對Na2CrO4-NaOH-H2O體系相圖的分析,研究了Na2CrO4的真空蒸發鹽析結晶工藝,確定了最優化操作條件,為工業生產過程提供技術指導。
1 相圖分析
在水鹽體系分離中,常用相圖來確定生產流程和探討最佳的生產條件[12]。由30~110℃的Na2CrO4-NaOH-H2O 體系溶解度等溫線[10]可知:在 60~95 ℃時的Na2CrO4-NaOH-H2O體系溶解度數據變化不大,并且也沒有物相的變化。因此筆者針對90℃的Na2CrO4-NaOH-H2O體系相圖做了研究,以此溫度相圖(圖1)為例,通過分析相圖可找到合適的結晶終點。

圖1 90℃時Na2CrO4-NaOH-H2O體系相圖
由圖1可知,aEb為飽和液相線,aE為NaOH的液相飽和線,bE為Na2CrO4液相飽和線。E點為NaOH、Na2CrO4的共飽和點。而aOb為不飽和區域,bEB為Na2CrO4的結晶區域,aEA為NaOH結晶區域,AEB為NaOH、Na2CrO4的共結晶區。通過分析發現,結晶液原始組成在m1點,因此該點為起始溶液的組成點,在90℃下等溫蒸發時,體系m1中的水將逐漸減少,而NaOH、Na2CrO4的比例不會發生變化,溶液在蒸發過程中,系統點m1沿Om1向背離O點的方向移動,當移至m2點時,鉻酸鈉晶體開始析出;當移動到m3點時,若繼續蒸發,體系開始進入NaOH、Na2CrO4共結晶區,會有NaOH析出,影響晶體純度,所以理論上應選取m3點為結晶終點,此時相對于1 050 g結晶初始液,根據杠桿規則算得蒸發水量約為670 mL,液相堿質量濃度約為868 g/L,結晶率約為92%。考慮到終點堿濃度過高,黏度較大,會影響過濾效果,并且液相夾帶嚴重,因此可適當減少蒸發水量以降低液相堿濃度。實驗中選取m4為結晶終點,算得蒸發水量約為590 mL,液相堿質量濃度約為650 g/L,結晶率約為83.5%。經由X射線衍射分析確定固相成分為無水鉻酸鈉。
溫度是影響晶體生長的重要因素[13]。在真空蒸發結晶過程中,為保證蒸發速度,溶液一般都處于沸騰狀態,沸點即為蒸發溫度。不同濃度溶液的沸點不同,要想使整個蒸發結晶過程中保持溫度一致,需確定不同濃度的溶液體系保持特定溫度所需的真空度,圖2為不同NaOH濃度下Na2CrO4-NaOH混合溶液沸點與真空度間的關系。

圖2 不同NaOH濃度下Na2CrO4-NaOH-H2O體系沸點與真空度間的關系
由圖2可以看出,在同一濃度的Na2CrO4-NaOHH2O體系中,沸點隨體系真空度的升高而降低;對于不同濃度的Na2CrO4-NaOH-H2O體系,在相同沸點下,體系NaOH濃度越大,所需真空度越高。根據圖2結果,可通過控制體系的真空度使體系溫度保持一致,為下文考察結晶溫度的影響時提供指導。
2 實驗部分
2.1 實驗裝置
圖3為NaOH-Na2CrO4-H2O體系真空蒸發結晶實驗裝置示意圖。

圖3 蒸發結晶實驗裝置
2.2 實驗步驟
1)量取模擬配制的 NaOH-Na2CrO4混合溶液800 mL加入1 L的結晶器中,開啟攪拌器,打開恒溫水浴加熱。待溶液溫度升至一定值時,開啟真空泵,調節系統內真空度,開始蒸發結晶。在同一蒸發終點下分別考察結晶溫度、攪拌強度、蒸發速度和添加晶種等因素對結晶過程的影響。
2)通過觀察冷凝水系統中收集的冷凝水體積,當水量達到一定值時,打開緩沖瓶閥門放空,關閉真空泵和冷凝水,停止攪拌,關閉所有電源。
3)將蒸發器中的懸浮液迅速保溫過濾,得到晶體產品。晶體經飽和鉻酸鈉溶液洗滌后,再用無水乙醇洗滌。洗滌后的樣品干燥后采用Hydro2000M型粒度分析儀分析產品的粒度和粒度分布。比較不同操作條件制備的產品,確定最優工藝條件。
2.3 結果與討論
2.3.1 攪拌強度的影響
在結晶溫度為80℃、蒸發速度為200 mL/h的條件下,分別考察了 150、200、250、300、350 r/min 等不同攪拌速度對蒸發結晶過程的影響。圖4為不同攪拌速度下所得晶體產品的粒度分布對比。表1為不同攪拌速度下所得晶體產品的平均粒度對比。
由圖4、表1可見,蒸發結晶過程所得晶體產品的平均粒度隨攪拌速度的增大而減小。當攪拌速度為150 r/min時,所得鉻酸鈉晶體的平均粒度為511 μm;當攪拌速度為350 r/min時,所得鉻酸鈉晶體的平均粒度僅為168 μm。當攪拌強度過大時,二次成核占主導地位,已有的晶粒與晶粒、晶粒與器壁、晶粒與攪拌槳間的碰撞幾率與強度均增加,導致二次成核速率加快,故得到的晶粒較小;當攪拌強度過小時,固液混合不均勻,得到的晶體產品粒度分布較寬,大小不一,故應選擇能使晶體離底懸浮的最小攪拌強度。綜合考慮,實驗選擇適宜的攪拌速度為300 r/min。

圖4 不同攪拌速度下所得晶體產品的粒度分布對比
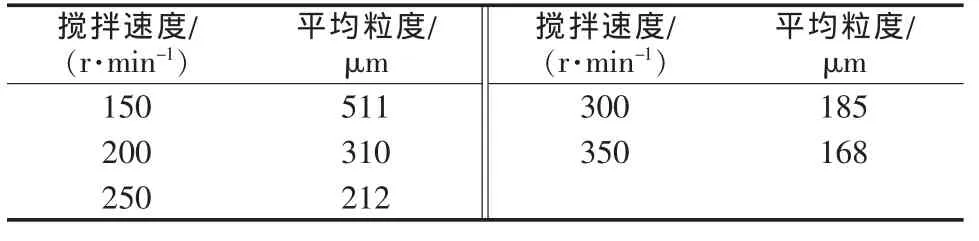
表1 不同攪拌速度下所得晶體產品的平均粒度對比
2.3.2 蒸發速度的影響
設定水浴溫度為90℃,通過調節真空度來控制蒸發速率,忽略體系溫度的變化,在攪拌速度為300 r/min的條件下,分別考察了蒸發速度為60、140、220、300、380 mL/h 時對工藝的影響。 圖 5 為不同蒸發速度下所得晶體產品的粒度分布對比。表2為不同蒸發速度下所得晶體產品的平均粒度對比。

圖5 不同蒸發速率下所得晶體產品的粒度分布對比

表2 不同蒸發速率下所得晶體產品的平均粒度對比
從圖5、表2可以看出,蒸發結晶過程所得晶體的粒度隨蒸發速度的加快而減小,當蒸發速度為60 mL/h時,所得晶體產品的平均粒度為290 μm;當蒸發速度為380 mL/h時,所得晶體產品的平均粒度僅為107 μm。蒸發速度過快時,溶液的過飽和度增大,容易導致爆發成核,從而得到的晶粒較小。故在保證正常操作時間的情況下,應盡可能選擇較小的蒸發速率。綜合考慮,實驗選擇適宜的蒸發速率為140 mL/h。
2.3.3 結晶溫度的影響
將結晶溫度變化控制在±2℃內,在蒸發速率約為150 mL/h、攪拌速度為300 r/min的條件下分別考察了體系溫度為70、80、90℃時對蒸發結晶過程的影響。圖6為不同結晶溫度下所得晶體產品的粒度分布對比。表3為不同結晶溫度下所得晶體產品的平均粒度。

圖6 不同結晶溫度下所得晶體產品的粒度分布對比

表3 不同結晶溫度下所得晶體產品的平均粒度對比
從圖6、表3可以看出,在蒸發速率一定的情況下,結晶溫度的升高有利于晶體的生長,當結晶溫度為90℃時,所得晶體產品的平均粒度為310 μm;當結晶溫度為70℃時,所得晶體產品的平均粒度為159 μm。結晶溫度越高,溶質的溶解度增大,溶解平衡向溶解方向移動,當微小晶體與較大晶體共存于溶液中時,如果溶液對較大晶體是飽和的,則對小晶體為未飽和,因此小晶體最先溶解,再從大晶體表面上重新析出,促進晶體長大,從而獲得的晶體粒度較大[14]。綜合考慮,實驗選擇適宜的結晶溫度為90℃。
2.3.4 晶種的影響
在間歇操作的結晶過程中,在介穩區內添加晶種[15]是獲得粒度較均勻的晶體產品的有效手段。在蒸發速率為300 r/min的條件下加入粒度為123 μm的晶種13.4 g。圖7和表4分別為添加和未添加晶種的操作條件下所得晶體產品的粒度分布對比和平均粒度。

圖7 有、無晶種添加條件下所得晶體產品的粒度分布對比

表4 有、無晶種添加條件下所得晶體產品的平均粒度對比
從圖7、表4可以明顯看出,添加晶種后所得晶體產品的粒度變大,分布較窄,同時晶型也較完整。
3 結論
針對Na2CrO4-NaOH-H2O體系,采用真空蒸發結晶的方法制備了Na2CrO4晶體:1)90℃時Na2CrO4-NaOH-H2O體系相平衡研究結果表明,采用真空蒸發結晶的方法可從Na2CrO4-NaOH-H2O中分離出Na2CrO4晶體。2)Na2CrO4-NaOH-H2O體系中真空蒸發結晶分離Na2CrO4的最優工藝條件:攪拌速度為能使晶體離底懸浮所需的最小轉速;每1 050 g原料所需蒸發速度為140 mL/h;結晶溫度為90℃;添加晶種。在此最優工藝條件下,得到的Na2CrO4晶體產品的平均粒度為300 μm。
[1]丁翼.我國鉻鹽生產狀況及發展建議[J].無機鹽工業,2000,32(4):28-30,44.
[2]Gao Yang,Xia Jun.Chromium contamination accident in China:viewing environment policy of China[J].Environmental Science&Technology, 2011,45(20):8605-8606.
[3]翟超.鉻鹽清潔工藝中鉻渣的處理及利用[D].北京:北京化工大學,2010.
[4]郭雅杰.亞熔鹽法鉻鹽清潔生產工藝多元電解質水溶液基礎物性研究[D].北京:北京化工大學,2010.
[5]Zheng Shili,Zhang Yi,Li Zuohu,et al.Green metallurgical processing of chromite[J].Hydrometallurgy,2006,82(3/4):157-163.
[6]Xu Hongbin,Zhang Yi,Li Zuohu,et al.Development of a new cleanerproductionprocessforproducingchromicoxidefromchromite ore[J].Journal of Cleaner Production,2006,14 (2):211-219.
[7]Zhang Yi,Li Zuohu,Qi Tao,et al.Green manufacturing process of chromium compounds[J].Environmental Progress,2005,24 (1):44-50.
[8]沈鎮平.河南義馬建成萬噸鉻鹽項目[J].杭州化工,2002,32 (3):13.
[9]徐紅彬,張懿,李佐虎,等.一種鉻鐵礦加壓浸出清潔生產鉻酸鈉的方法:中國,101817561A[P].2010-09-01.
[10]鄒興,張懿.NaOH-NaAlO2-Na2CrO4-H2O四元水鹽體系相平衡[J].化工冶金,1998, 19(2):118-121.
[11]戴建軍.鈦白粉生產中真空結晶工藝技術的開發[J].化工設計通訊,2002,28(2): 21-24.
[12]楊仁春,何立惠,李佐虎,等.鉻酸鈉與氯化鈉的分離[J].無機鹽工業,2001,33 (5):5-7.
[13]Hicks J F,Templeton A C,Chen S,et al.The monolayer thickness dependence of quantized double-layer capacitances of monolayerprotected gold clusters[J].Analytical Chemistry,1999,71(17):3703-3711.
[14]張建國,張同來,楊利.起爆藥的結晶控制技術與單晶培養[J].火工品,2001(1):50-54.
[15]張綱,王靜康,熊暉.沉淀結晶過程中的添加晶種技術[J].化學世界,2002,43(6): 326-328.

