α放射核素靶向治療研究進展
李明起,潘俊男,段玉春,鄧啟民,3,王邦金
(1.成都云克藥業有限責任公司,四川 成都 610041; 2.成都市放射性藥物工程技術研究中心,四川 成都 610041; 3.四川大學 生物治療國家重點實驗室,四川 成都 610041)
隨著現代醫學對疾病治療理念的不斷更新,腫瘤治療向靶向治療發展。除了靶向化療藥物外,放射性核素靶向治療愈來愈得到腫瘤臨床醫學的重視。適合于腫瘤靶向治療的核素主要有β放射核素和α放射核素,因β放射核素比α放射核素更易獲得而研究較多,如90Y。但β射線是低線性能量轉換(LET)射線,對細胞的殺傷力較弱[1-2];β射線在生物組織中的射程為1 mm~10 mm,對于微小病灶和非實體瘤,因病灶或細胞的直徑遠小于β射線的射程,β粒子的部分能量會釋放到周圍正常組織而不是在病灶或腫瘤細胞內,在殺死腫瘤細胞的同時會帶來較大的毒副作用[3]。Larsen等[4]通過放射劑量測定法表明,α粒子放射體作為親骨物質比β-粒子放射體優勢明顯。即當放射源位于骨表面時,較短射程的α放射體引起較少的骨髓輻射。在該研究中將兩個α放射二磷酸酯骨探查劑與兩個具有相似的化學結構和骨親和力的β放射化合物相比較, 結果表明,α放射體與β放射體相比骨表面與骨髓劑量比高3倍,α放射骨探查劑比β放射化合物更具有優勢,因為輻射劑量能夠更強的濃縮至骨表面(見圖1)。與β放射核素相比,α放射核素射線能量高(25 keV/μm~230 keV/μm)、射程短(40 μm~85 μm)、對腫瘤細胞殺傷力強,而對正常組織影響小[5]。正因為α放射核素具有以上優勢,近年來,已經成為放射性藥物研究熱點。2013年,第1個α放射核素類藥物Xofigo(223RaCl2注射液)已經在美國和歐盟上市,在臨床上具有較好的療效,從而進一步激發了科學家對其他α放射核素類藥物的研究興趣。
α放射核素的種類較多,其都有各自的優缺點。多數α放射核素的純化較困難,大部分α放射核素的半衰期(過短或過長)都不適合用于醫學用途。目前報道適合于治療用α放射核素主要有223Ra、225Ac、213Bi、211At、212Bi、149Tb、227Th[7]等,其中223RaCl2已于2013年5月被FDA批準用于治療伴骨轉移而無內臟轉移的去勢抵抗性前列腺癌,幾種適合治療的α放射核素性質列于表1。
本文主要介紹了以上核素的來源制備及用于腫瘤靶向治療的最新進展,對存在的問題、現狀及臨床應用前景進行了簡要的探討。
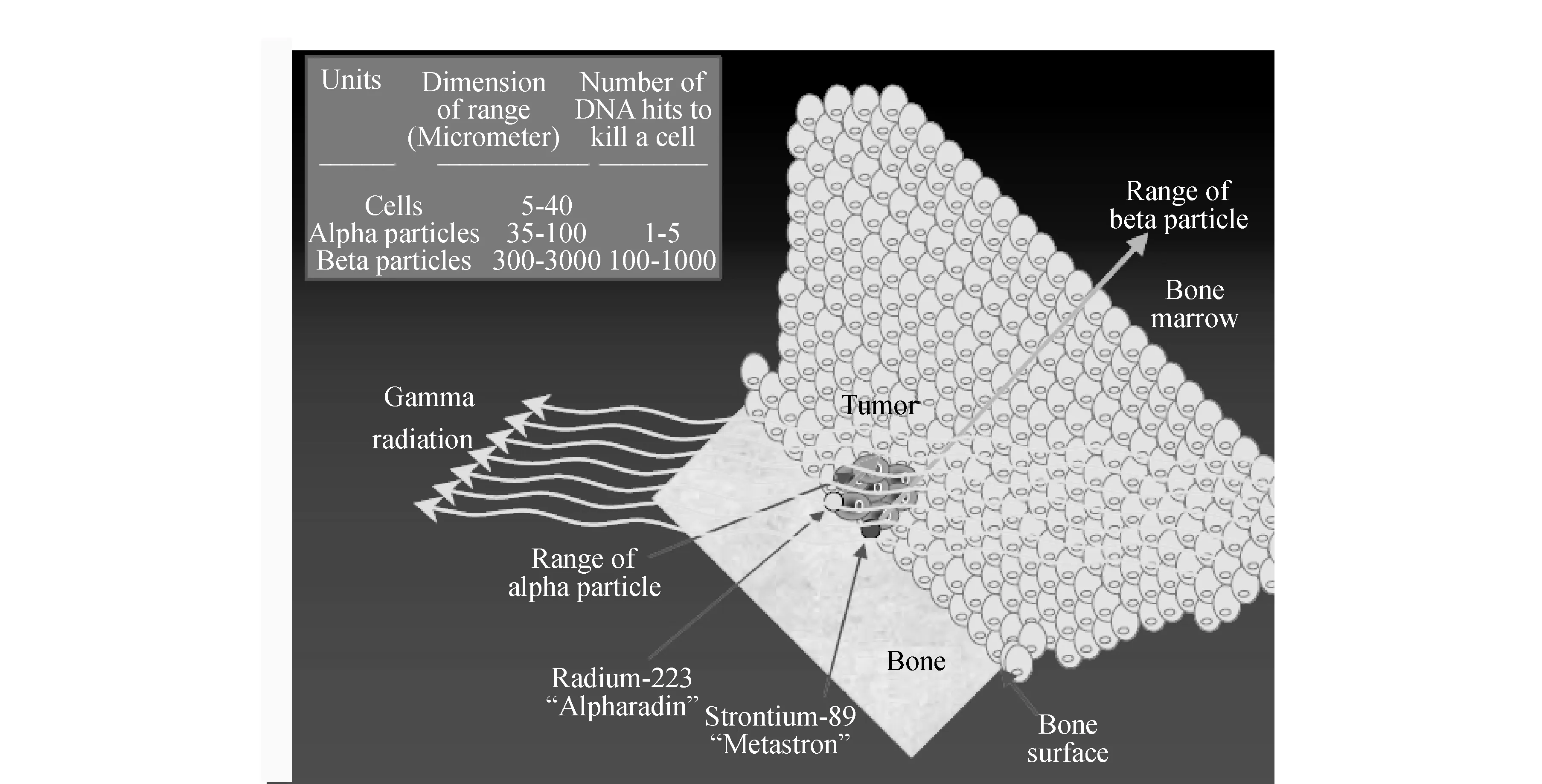
圖1 α粒子放射體與β粒子放射體治療作用示意圖[6]Fig.1 The therapeutic effect of α-particle emitters and β-particle emitters
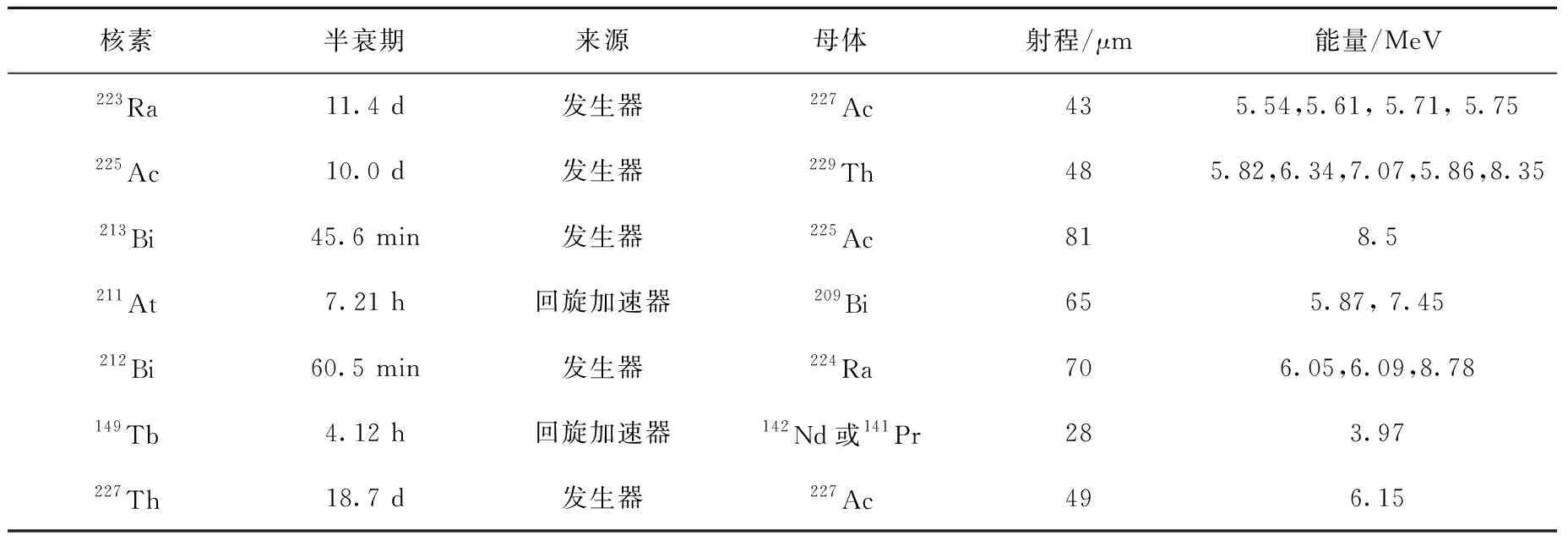
核素半衰期來源母體射程/μm能量/MeV223Ra11.4 d發生器227Ac435.54,5.61, 5.71, 5.75 225Ac10.0 d發生器229Th485.82,6.34,7.07,5.86,8.35213Bi45.6 min發生器225Ac818.5211At7.21 h回旋加速器209Bi655.87, 7.45 212Bi60.5 min發生器224Ra706.05,6.09,8.78149Tb4.12 h回旋加速器142Nd或141Pr283.97227Th18.7 d發生器227Ac496.15
1 幾種重要α放射性核素靶向治療進展
1.1 223Ra靶向治療
223Ra(T1/2=11.4 d)為天然235U衰變系列中的成員,其半衰期相對較長,適合于運輸及治療。223Ra通過6階段衰減為短壽命子體,最后衰變為穩定207Pb,主要發射α 射線,同時還有不同能量和比例的β射線和γ射線。223Ra的制備以227Ac為源,227Ac發生β衰變為227Th,227Th發生α衰變為223Ra(見圖2)。227Ac主要由中子輻照226Ra來制備,通過反應226Ra(n,γ)227Ra,生成的227Ra發生β衰變為227Ac。
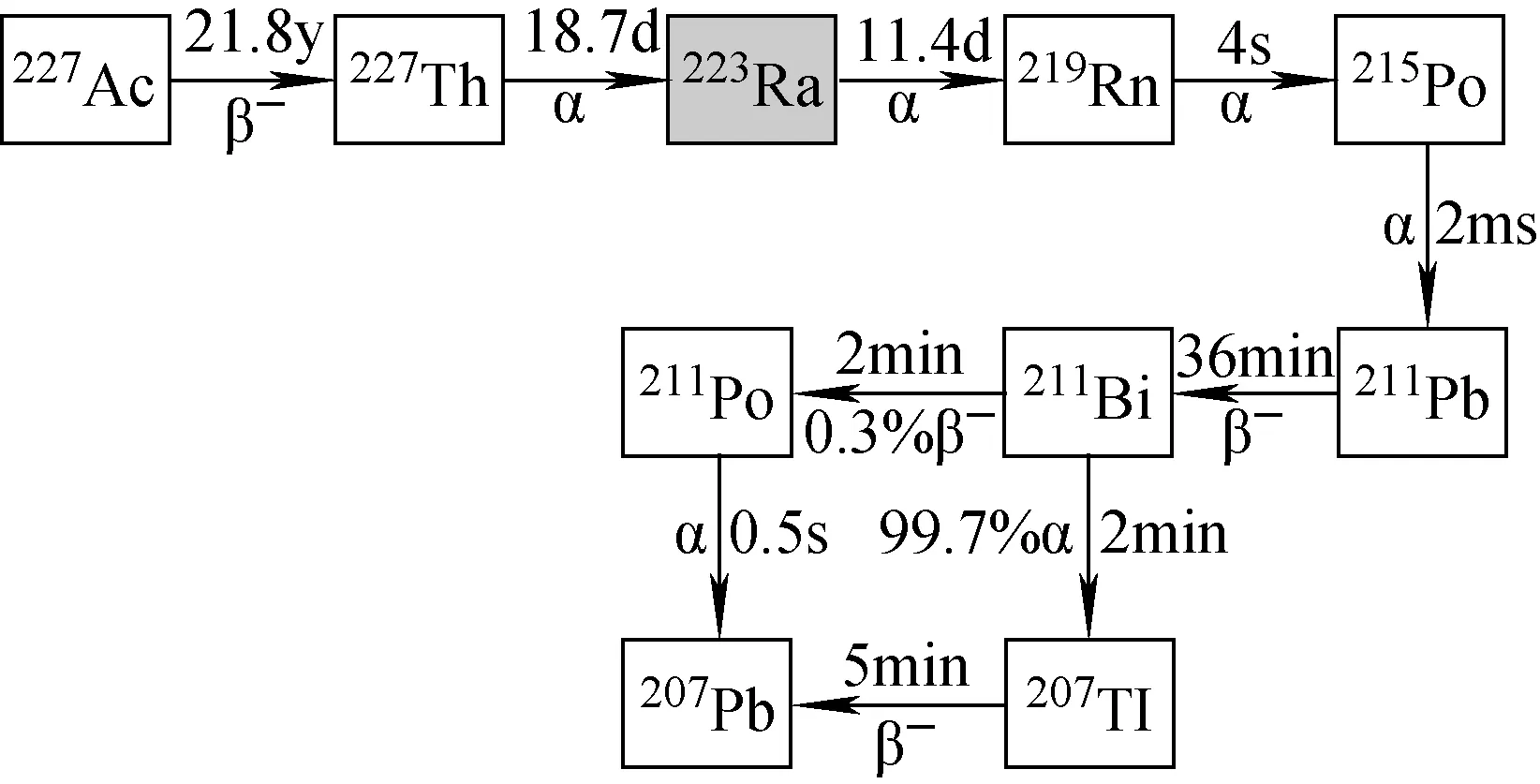
圖2 223Ra生成及衰變鏈Fig.2 The generation and decay chain of 223Ra
223Ra與鈣同族,可以模擬鈣并且在骨更新增多的部位,例如骨轉移部位,與骨礦物質羥基磷灰石形成復合物。223Ra發射的高線性能量轉移射線(80 keV/μm)可引起鄰近細胞的雙鏈DNA斷裂,進而對骨轉移產生抗腫瘤作用。223Ra發射α粒子的射程短(不到10個細胞直徑),能夠最大限度地減少對周圍正常組織的傷害[8]。與其他α核素相比,223Ra具有如下優勢:(1)223Ra具有較長的半衰期,在發生衰變之前大部分的223Ra將從軟組織中去除可降低骨與軟組織的吸收劑量比。(2) 較長的半衰期可使223Ra與骨表面結合牢固,大大降低其和子體的易位,降低對正常組織的毒性。(3) 來自223Ra的較短半衰期子體219Rn(T1/2=4 s),可以使來自223Ra的子體核素具有較少的易位。因此,223Ra是一種具有較低毒性的α放射治療核素[9]。
223Ra是第一個被批準用于臨床治療的α靶向治療核素,223RaCl2注射液于2013年5月和11月,分別由美國食品和藥物管理局(FDA)和歐盟藥品管理局(EMA)批準上市,用于治療伴有骨轉移癥狀并無內臟轉移的去勢抵抗性前列腺癌(CRPC),商品名為Xofigo。
223RaCl2的I 期臨床試驗結果顯示,在最高劑量下也未見明顯的毒副作用[10]。而在以安慰劑作為對照組的II期臨床試驗中,研究者發現CRPC骨轉移患者對223RaCl2的耐受性良好,未見明顯的血液毒副反應,并且在223RaCl2治療組中CRPC患者的血BAP 及PSA 下降明顯,同時中位OS ( 65周vs 46周) 及2年生存率( 30% vs 13% ) 明顯延長[11]。
Ⅲ期隨機對照臨床試驗,納入人群為去勢抵抗的前列腺癌患者,有兩處或以上的骨轉移,一組615例, 用223RaCl2治療,一組307例,用安慰劑治療,比較這兩組的療效。223RaCl2組的中位OS是14.9 個月,安慰劑組是11.3 個月。使用223RaCl2患者的副作用很小。數據顯示[12],223RaCl2與安慰劑相比,可以減低30.5%的死亡率,骨骼并發癥的發生推遲了6個月,同時改善了患者的生活質量。以上結果提示,223RaCl2治療有可能成為去勢抵抗的前列腺癌骨轉移患者的一個新的標準治療方案。
1.2 225Ac靶向治療
225Ac(T1/2=10 d)由長壽命的229Th(T1/2=7 430 y)衰變而來(見圖3)。225Ac在衰變過程中產生三種短半衰期α子體核素,分別為221Fr(T1/2=4.9 min,Eα=6.458 MeV)、217At(T1/2=32.3 ms,Eα=7.202 MeV)、213Bi(T1/2=45.59 min,Eα=8.537 MeV)。因此225Ac也可以作為213Bi的母體核素吸附到樹脂上制成225Ac/213Bi發生器[13]。225Ac價格非常昂貴,來源有限,只能維持少量的臨床研究。美國橡樹嶺國家實驗室每兩個月能提供180 MBq~2 200 MBq的225Ac,主要是從233U衰變的229Th中提取225Ac,由于229Th資源有限,從而限制了225Ac的產量[14]。德國Karlsrhue超鈾元素研究所和俄羅斯物理和動力工程研究院可生產225Ac,生產方法與美國類似,也是從229Th中提取225Ac[14]。
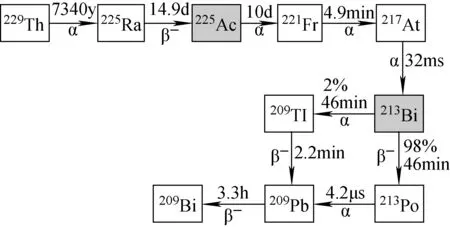
圖3 225Ac和213Bi生成及衰變鏈Fig.3 The generation and decay chain of 225Ac and 213Bi
225Ac每次衰變可釋放四個α粒子和兩個β粒子,因而較其他α核素的細胞毒性更強。但由于225Ac在體內并不能主動靶向作用于某個組織,因此需要選用合適的雙功能偶聯劑將其與合適的載體穩定地連接,并將225Ac標記物準確地輸送至靶細胞。但釋放的α發射子體引起的腎臟輻射毒性是一個嚴峻的問題[15]。225Ac在體內的毒性很強,靜脈注射225Ac后,其主要沉積于肝臟、骨、腎和心臟,清除速率非常慢,注射6個月后,體內仍殘留50%的劑量。為了降低225Ac在體內的毒性,需要選擇合適的偶聯劑,增加體內清除速率。最早應用的偶聯劑有EDTA、DTPA和PEPA,均可降低225Ac在各器官內的沉積,但器官毒性水平仍然很高,特別是肝臟。近年來合成出一類新的偶聯劑HEHA,既可與225Ac穩定結合,且體內清除速率很快,各器官的沉積較低[16]。
McDevitt等[17]的體外實驗表明,225Ac能以比213Bi低1 000倍的劑量殺死多種癌細胞。HuM195為人源化抗CD-33單抗林妥珠單抗,能靶向于骨髓白血病細胞,具有一定的抗急性骨髓白血病(AML)活性。Joseph等[18]將225Ac標記的單抗HuM195藥物用于急性骨髓白血病的Ⅰ期臨床研究,以評價藥物對人體的藥效、劑量及其安全性等。18位患者參與研究,評價了18.5 kBq/kg(n=3)、37 kBq/kg(n=4)、74 kBq/kg(n=3)、111 kBq/kg(n=6)和148 kBq/kg(n=2)幾個225Ac劑量水平,未見急性毒性反應,在1位劑量為111 kBq/kg和2位劑量為148 kBq/kg的患者中觀察到劑量限制毒性(骨髓抑制持續35 d以上;膿毒病死亡);骨髓外毒性僅限于短暫的肝功能異常;平均5個月的隨訪未發現放射性腎炎;通過γ計數儀分析了血漿藥代動力學,發現呈兩相代謝動力學,α粒子和β粒子的血漿平均半衰期分別為1.9 h和35 h。16位患者中有10位的外周血癌細胞被消除,15位患者中有10位的骨髓癌細胞減少33%以上,由以上結果可看出,225Ac標記的單抗HuM195用于人體的安全劑量為111 kBq/kg,所有劑量水平均有抗白血病的活性。
F3是一種血管腫瘤歸巢肽,連接在腫瘤內皮細胞表面的核仁上,可以內化進入細胞核,將F3與225Ac穩定結合,從而實現靶向傳遞225Ac進入腫瘤細胞。Markus等[19]進行了225Ac-DOTA-F3對于腹膜轉移癌的體內外研究,體外研究顯示225Ac-DOTA- F3的ID50為1.8 μCi/L,選擇6×50 nCi的225Ac-DOTA-F3進行體內實驗,結果顯示,225Ac-DOTA-F3能控制腫瘤生長,與對照組相比,可增加患腹膜轉移癌小鼠的存活率,副作用主要表現為部分腎臟纖維化。
Franziska等[20]研究了225Ac標記生長抑制素受體對大鼠胰腺腺泡癌細胞(AR42J)的作用,結果顯示,225Ac-DOTATOC能引起腫瘤細胞DNA雙鍵斷裂,導致細胞死亡。
1.3 213Bi靶向治療
213Bi(T1/2=45.6 min)為225Ac衰變子體(見圖3),其α射線的能量為8.5 MeV,是所有可用于放射治療的α核素中半衰期最短的核素。另外,由于213Bi衰變時發射出440 keV的γ射線(26.1%),因此可在治療過程中同時進行顯像,有利于研究劑量和生物分布情況[21]。盡管213Bi的半衰期很短,但可通過淋洗225Ac/213Bi發生器而獲得213Bi,因此截止目前,213Bi仍是臨床研究應用最多的α靶向治療核素。213Bi主要由225Ac/213Bi發生器制備[14]。
Rosenblat 等[22]完成了213Bi標記HuM195對急性骨髓白血病的Ⅱ期臨床研究,以評價藥物對人體的最大耐受劑量和治療白血病的效果。31位患者參與了研究,首先給予5 d阿糖胞苷(200 mg/m2/d),再給予213Bi-HuM195,劑量范圍為18.5 MBq/kg~46.25 MBq/kg。結果顯示,213Bi-HuM195的最大耐受劑量為37 MBq/kg,5位患者可見短暫的肝功能異常,2位劑量為37 MBq/kg的患者發生了與治療相關的死亡,所有劑量均可顯著降低骨髓萎縮,平均療效持續時間為6個月。生物分布和藥理學研究顯示,213Bi-HuM195可在CD33位點達到飽和狀態。以上結果顯示,阿糖胞苷和213Bi-HuM195的聯合給藥是可行的,并且能減輕急性骨髓白血病患者的病情。
神經肽P物質是神經源性炎癥反應中的重要介質,主要由初級感覺神經末梢釋放,靶向于多形性膠質瘤中過度表達的神經激肽1型(NK-1)受體,Morgenstern 等[23]報道了213Bi-DOTA-P物質用于復發性多形性神經膠質細胞瘤的首次臨床研究,17位患者參與研究,給予1~4次213Bi-DOTA- P物質,每次間隔2個月,劑量為50 mCi,結果顯示,接受4次(200 mCi)的患者耐受性很好,僅出現輕微短暫的副反應,顯像結果顯示,213Bi-DOTA-P物質能長時間停留在腫瘤部位。在有效的16位患者中,5位患者死亡(4人死于疾病進展,1人死于非治療相關的原因),2位患者疾病進展,9位患者疾病穩定或腫瘤減小。綜上,213Bi-DOTA- P物質用于多形性神經膠質細胞瘤的治療是安全的,毒副反應小。接受4×50 mCi劑量的患者疾病能很好地被控制,213Bi-DOTA-P物質有可能成為一種新的復發性、多形性神經膠質細胞瘤的α靶向治療藥物。
Bryan等[24]將人類的胰腺癌細胞MiaPaCa-2異種移植至裸鼠中,研究213Bi標記嵌合抗體chTNT3聯合順鉑和吉西他濱治療實驗胰腺癌的效果,分別對比了單獨給予700 μCi213Bi-chTNT3、化療藥物治療3 d后再給予700 μCi213Bi-chTNT3、單獨給予chTNT3和化療藥物。結果顯示,213Bi-chTNT3相比化療藥物,能顯著減緩MiaPaCa-2腫瘤的生長,而且毒副作用很小。
1.4 211At靶向治療
211At(T1/2=7.2 h)衰變釋放出近100%的α射線,衰變為穩定核素207Bi(見圖4),射線平均能量6.8 MeV,其LET為(97~99) keV/μm;在軟組織中的射程約為6~8個細胞的范圍(55 μm~88 μm),就放射治療而言,是除硼中子俘獲治療外僅有的高傳能線密度體系。衰變過程同時釋放γ射線,有利于顯像和劑量標準研究。目前該核素只能通過回旋加速器生產,來源有限使其不能被廣泛應用于臨床研究[25]。211At的生產可按照反應209Bi(α,2n)211At,在回旋加速器中用加速的氦離子輻照209Bi而產生211At。美國有三個機構可提供211At,分別是Duke大學、The National Institutes of Health PET Center和華盛頓大學;法國的Nantes建起了一個70 MeV的回旋加速器用于生產211At[14]。國內四川大學原子核科學研究所也進行了基于CS-30回旋加速器制備211At的研制和生產[26]。

圖4211At生成及衰變鏈
Fig.4 The generation and decay chain of211At
Albertsson等[27]報道了211At標記鼠源化單抗MX35治療復發性卵巢癌的I期臨床研究,結果表明,211At-MX35對人體毒副反應小,中期分析時,沒有復發病例,所有患者均存活。目前準備開展211At標記人源化單抗MX35治療晚期卵巢癌的Ⅱ/Ⅲ期臨床研究。Thorsten等[28]的研究結果表明,211At標記抗CD-33單抗對白血病細胞HL-60和K-562具有很強的細胞毒性,能殺死癌細胞。劉寧等[29]對核素211At進行了系統研究,合成了一系列的211At標記化合物(SPC,ATE和TCP)雙功能偶聯劑,對其分別進行了211At標記偶聯牛血清白蛋白(BSA)的研究,結果表明,三種不同偶聯劑制得的標記物在體內外都具有較高的穩定性。其研究小組利用骨骼體系對胺基膦酸類化合物具有高親和性的特點,通過SPC雙功能偶聯劑進行了211At的合成及其生物學性能評價,并與99Tcm-MDP進行了比較。結果表明,211At標記化合物和99Tcm-MDP都對小鼠骨骼具有明顯的親和性。211At標記化合物在小鼠骨骼的攝取都遠高于游離At在骨骼的攝取,6 h時即可達23.7% ID/g。結果提示,將211At標記的胺基膦酸類化合物用于骨腫瘤治療是可行的。此外本課題組還進行了211At標記膠體、胰島素和單克隆抗體等化合物的標記研究,已有的研究結果[30-32]證實,211At是一個有應用前景的理想的靶向治療核素。
1.5 212Bi靶向治療
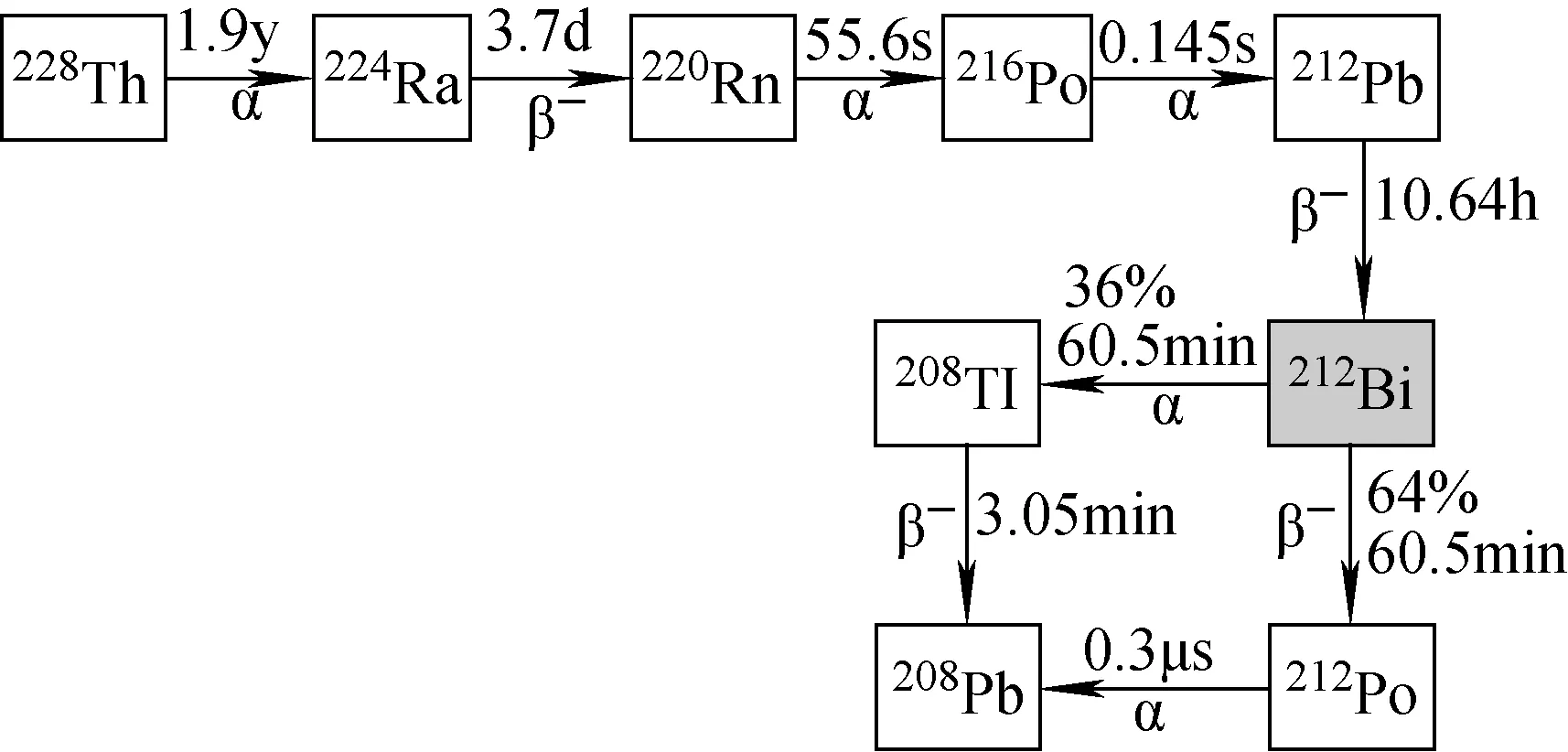
圖5 212Bi生成及衰變鏈Fig.5 The generation and decay chain of 212Bi
212Bi是天然232Th衰變鏈中的成員(見圖5),其半衰期(T1/2=60 min)較短,212Bi一般可通過224Ra/212Pb/212Bi發生器制備,從224Ra中提取出212Pb(T1/2=10.6 h)與螯合劑結合進入體內,在體內發生β衰變為212Bi。212Bi有64%發生β衰變為212Po,212Po(T1/2=0.29 ms)會發生α衰變為穩定的208Pb;212Bi有36%發生α衰變為208Ti,208Ti(T1/2=3 min)再發生β衰變為穩定的208Pb。208Ti的衰變含高能量(2.6 Mev)的γ射線,因此,患者必須采用特殊的輻射防護程序[33]。212Bi主要由224Ra/212Pb/212Bi發生器制備,224Ra可從232U中提取,也可由經反應226Ra(2n,γ)228Ra,228Ra發生β衰變為228Ac,228Ac發生β衰變生成的228Th中提取[14]。
212Bi放射性治療藥物的研究在20世紀80年代以后引起國外學者的重視,國內也對212Pb/212Bi 標記化合物進行了初步探索[34]。標記212Bi化合物已用于臨床前研究中的小鼠淋巴瘤[35]、黑色素瘤[36]、卵巢癌[37]、彌散性腹膜轉移[38]和骨轉移[39]等疾病的研究。Kozak 等[40]用DTPA作為雙功能配體,將雙212Bi對抗體進行了標記,研究發現其可特異性識別人白細胞介素-2(IL-2)受體。Macklis 等[41]將212Bi標記單克隆抗體用于小鼠腫瘤細胞株(Thy1.2+EL-4)的培養,研究顯示,標記藥物能顯著抑制淋巴瘤細胞的增殖,其抑制率可達98%。經3H胸腺嘧啶脫氧核苷滲入分析表明,此時每個靶細胞吸收了3個212Bi。 Brechbiel 和 Waldmann[42]將212Pb/212Bi與抗HER2/neu單克隆抗體結合,其能夠徹底殺滅小鼠體內的乳腺癌細胞。HER2/neu是一種受體蛋白,其過度表達與乳腺癌預后差相關,結果表明,212Bi抗體的應用是預防和治療乳腺癌轉移的一個策略。Milenic等[38]將212Pb/212Bi標記的曲妥珠單抗用于治療小鼠彌散性腹膜轉移疾病。將212Pb/212Bi與多肽標記,其對治療轉移性黑素瘤具有較好的效果[36],以上研究表明,α放射性核素和其他的放射性核素在治療人類腫瘤轉移中具有重要作用。
1.6 149Tb靶向治療

圖6 149Tb生成及衰變鏈Fig.6 The generation and decay chain of 149Tb
149Tb具有較短的半衰期(T1/2=4 h),其衰變時,17%發生α衰變,能量為4 MeV,4%發生β衰變,79%發生電子俘獲(見圖6)。低活度(1.48 MBq)的149Tb可在串列加速器上利用142Nd(12C,5n)149Dy→149Tb核反應制得,更大量(1 GBq)的149Tb 則需要利用CERN 的散裂源[7]。由于149Tb的半衰期較短,其使用的地點必須要在其生產加速器的附近。目前對該同位素進行的相關研究主要位于塞爾維亞的貝爾格萊德、澳大利亞的堪培拉國立大學的串列加速器和瑞士日內瓦的CERN質子加速器,目前仍沒有149Tb商業供應商[14]。
149Tb 衰變放出α 粒子(3.97 MeV)和γ 射線(165 keV)。與213Bi相同,在治療過程中可同時進行顯像。因此149Tb具有潛在的用于癌癥放射免疫治療的價值[43]。Abbas 等[44]用對急性骨髓白血病細胞有特異性的單抗WM-53進行了149Tb標記,其標記率可達90%~95%。其體外結合與殺傷細胞實驗表明,標記后免疫反應與標記前一致。進一步的研究表明,149Tb能阻止細胞的DNA 合成,且即使劑量僅為74 kBq~111 kBq 時仍能選擇性地殺死腫瘤細胞。Allen 等[3]的研究表明,149Tb 對病變前期的癌細胞的治療具有很大的潛力。對骨髓內白血病細胞的清除,其效率是225Ac 的 5 倍以上,其比211At 或212Bi 的效率高一個數量級。利比亞原子核研究中心的科學家評估了149Tb和213Bi對人成纖維細胞的放射生物學效應,通過評估DNA損傷和修復正確的概率來進行評估。結果表明,149Tb比213Bi具有更高的治療潛力[45]。149Tb 的α粒子比213Bi的α粒子具有更高的概率來誘導細胞凋亡。因此149Tb 是對有針對性的腫瘤放射治療更有用。但因其來源比較困難,目前有關149Tb研究的報道并不多見。
1.7 227Th靶向治療
227Th為227Ac衰變鏈中的第一個子體,半衰期(T1/2=18.7 d)適中,發生α衰變為223Ra(見圖2)。作為223Ra的母體核素,其制備同223Ra類似。227Th的制備也是以227Ac為源,227Ac發生β衰變為227Th。
由于223Ra具有非常適合人體治療的核素性質,因此最近幾年其母體核素227Th已經被考慮用于活性劑,或作為在體內產生了223Ra的體內發生器,用于腫瘤放射免疫治療。Washiyama等[46]研究了Th元素為正三價時,與螯合劑(DTPA、EDTMP)絡合用于乳腺癌和前列腺癌的骨轉移的放射免疫治療。Dahle 等[47]將227Th由DOTA絡合連接到利妥昔單抗,并已被建議作為用于治療非霍奇金淋巴瘤的新放射免疫療法。Larsen 等[48]研究了227Th的體內發生器,將227Th通過與雙功能螯合劑絡合,再與抗體、生長因子、多肽及激素類似物等靶向分子連接,用于治療任何形式的癌癥以及風濕病,尤其對于皮膚癌、前列腺癌、宮頸癌、乳腺癌和炎性疾病具有較好的治療效果。但是由于227Th在體內衰變要獲得治療效果所需的劑量極易引起其他器官高毒性反應,甚至有可能致死,其用于人體時所需的劑量大小很難控制,因此限制了其應用。
2 展望
α放射核素經過幾十年的研究,已經證實其在腫瘤治療領域擁有獨特地位。目前已有拜爾公司的Xofigo(223RaCl2注射液)于2013在美國和歐盟上市,可以看出α放射核素藥物具有極好的市場價值。目前α放射核素治療研究呈現如下趨勢:(1) α放射核素來源呈現多途徑化,一種核素可以來源于自然衰變提取、核反應或者發生器等多種途徑,這為α放射核素的制備和應用提供了方便。(2) α放射核素治療靶向性進一步增強,由于α放射核素的性質決定了其治療時必須高靶向性,因此科學家在靶向性方面進行了多方面研究,如具有靶向性的新型螯合劑或化合物,可攜帶α放射核素進入到細胞核,使核素內化,可以更強的殺滅腫瘤細胞,進一步降低毒副作用;開發出了多種α放射核素的體內發生器,可使α放射核素到達靶向組織,特異進行衰變治療,擴大了α放射核素的適應癥。(3) α放射核素的腫瘤治療呈現多樣化,前期研究主要集中于血液和骨系統腫瘤,最近隨著具有靶向性的螯合劑或化合物的深入研究,α放射核素已經用于黑色素瘤、乳腺癌、胰腺癌、卵巢癌等其他實體瘤的治療,其中部分研究已經進入臨床評價。
α放射核素治療藥物近年來雖然取得了很大進展,但是還存在諸多問題,包括:(1) α放射核素制備較困難,提純難度較大,導致其價格昂貴,我國缺乏生產醫學用途α放射核素的生產單位和機構,因此國家應大力提倡設施建設和資金投入;(2) 進一步深入α核素藥物的劑型研究應包括α核素的標記化合物、螯合劑和載體等的研究,進一步提高α核素藥物在體內的靶向性和穩定性,提高安全性。(3) 制定α核素藥物的使用和劑量規范,指導合理用藥,調高療效,降低副作用,使α核素藥物真正成為低毒高效的潛力藥物。國內α放射核素研究極少,因此在我國有很大的發展和研究空間。
參考文獻:
[1] Hoefnagel C A. Radionuclide therapy of tumors: general aspects and considerations[J]. Int J Biol Markers, 1993, 8(3): 172-179.
[2] Breitz H B. Dosimetric considerations for radioimmunotherapy[J]. Diagn Oncol, 1993, 3(4): 209-215.
[3] Allen B J, Blagojevic N. α and β emitting radiolanthanides in targeted cancer therapy: the potential role of149Tb[J]. Nucl Med Commun, 1996, 17(1): 40-47.
[4] Larsen R H, Murud K M, Akabani G, et al. Has high in vivo stability and bone accumulation of211At-and131I-labeled bisphosphonates[J]. Nuclear Medicine ,1999, 40(7): 1 197-1 203.
[5] Sgouros G. Alpha-particles for targeted therapy[J]. Adv Drug Deliv Rev, 2008, 60(12): 1 402-1 406.
[6] Larsen R H, Bruland ?S. Targeting of skeletal metastases by the alpha-emitter Radium-223[C/OL]. http:∥www.bruland.info/PDF/195-202.pdf.
[7] 昝亮彪,劉寧,楊遠友,等. α核素用于腫瘤靶向治療研究的進展[J]. 核技術,2006,29(4):279-285.
Zan Liangbiao, Liu Ning, Yang Youyuan, et al. Progress of the targeted tumor therapy with α-emitting nuclides[J] . Nuclear Techniques, 2006, 29(4): 279-285(in Chinese).
[8] Parker C, Nilsson S, Heinrich D, et al. Alpha emitter radium-223 and survival in metastatic prostate cancer[J]. N Engl J Med, 2013, 369(3): 213-223.
[9] Larsen R H, Henriksen G. Preparation of radium-223, physically accepted preparation and kit:Norway, CA2358498A1[P]. 1999-12-17.
[10] Nilsson S, Larsen R H, Fossa S D, et al. First clinical experience with alpha-emitting radium-223 in the treatment of skeletal metastase[J]. Clin Cancer Res, 2005, 11(12): 4 451-4 459.
[11] Nilsson S, Franzen L, Parker C, et al. Bone-targeted radium-223 in symptomatic,hormone-refractory prostate cancer: a randomised, multicentre, placebo-controlled phase II study[J]. Lancet Oncol, 2007, 8(7): 587-594.
[12] Goyal J, Antonarakis E S. Bone-targeting radiopharmaceuticals for the treatment of prostate caner with bone metastases[J]. Cancer lett, 2012, 323(2): 135-146.
[13] Geerlings M W, Kaspersen F M, Apostolidis C, et al. The feasibility of225Ac as a source of alpha-particles in radioimmunotherapy[J]. Nucl Med Comm, 1993, 14(2): 121-125.
[14] Darrell R F. Commercial Availability of Alpha-Emitting Radionuclides for Medicine[J]. Current Radiopharmaceuticals, 2008, 1(3): 127-134.
[15] Chappell L L, Deal K A, Dadachova E, et al. Synthesis conjugation and radiolabeling of a novel bifunctional chelating agent for225Ac radioimmunotherapy applications[J]. Bioconjug Chem, 2000, 11(4): 510-519.
[16] Taylor D M. The metabolism of actinium in the rat[J]. Health Phys, 1970, 19(3): 411-418.
[17] McDevitt M R, Dangshe M, Lawrence TL, et al. Tumor Therapy with Targeted Atomic Nanog-enerators[J]. Science, 2001,294(5 546): 1 537-1 540.
[18] Jurcic J G, Rosenblat T L, McDevitt M R, et al. Alpha-Particle Immunotherapy for Acute Myeloid Leukemia (AML)with Bismuth-213 (213Bi) and Actinium-225 (225Ac)[C]. 8thInternational Symposium on Targeted Alpha Therapy, 2013, June 4-6: 14.
[19] Markus E, Alfred M, Frank B, et al. Therapeutic efficacy and toxicity of225Ac labelled tumour-homing peptides in treatment of peritoneal carcinomatosis[C]∥7thSymposium on Targeted Alpha Therapy, July 17-19, 2011. [s.n.], 2011: 21.
[20] Franziska G, Jorg F, Stephan M, et al. DNA double strand break assessment by γH2AX-foci quantification after alpha-particle emitter Ac-225 and electron emitter Lu-177 somatostatin receptor targeted radiotherapy correlates with cell death and apoptosis in vitro[C]∥8thInternational Symposium on Targeted Alpha Therapy, June 4-6, 2013. [s.n.], 2013: 28.
[21] Sartor O, Maalouf B N, Hauck C R, et al. Targeted use of Alpha Particles:Current Status in Cancer Therapeutics[J]. J Nucl Med Radiat Ther, 2012, 3(4): 136-144.
[22] Rosenblat T L, McDevitt M R, Mulford D A, et al. Sequential cytarabine and alpha-particle immunotherapy with bismuth-213-lintuzumab (HuM195) for acute myeloid leukemia[J]. Clin Cancer Res, 2010, 16(21): 5 303-5 314.
[23] Morgenstern A, Krolicki L, Kunikowska J, et al. Targeted alpha therapy of glioblastoma multiforme with213Bi-substance P[C]∥8thInternational Symposium on Targeted Alpha Therapy. [s. n.], 2013: 15.
[24] Bryan R A, Jiang Z, Jandl T, et al. Treatment of experimental pancreatic cancer with 213-Bismuthlabeled chimeric antibody to single-strand DNAin combination with cisplatin and Gemcitabine[C]∥8thInternational Symposium on Targeted Alpha Therapy. [s. n.], 2013: 22.
[25] Zalutsky M R, Pruszynski M. Astatine-211:production and availability[J]. Curr Radiopharm, 2011, 4(3): 177-185.
[26] 劉寧,楊遠友,金建南,等. 基于CS-30回旋加速器的同位素研制及應用[J]. 同位素,2012,25(3):189-192.
Liu Ning, Yang Youyuan, Jin Jiannan, et al. Preparation of radioactive isotopes by CS-30 cyclotron and their applications[J]. Journal of Isotopes, 2012, 25(3): 189-192(in Chinese).
[27] Albertsson P, Andersson H, Back T, et al. Clinical update of a phase I study on alpha particle radioimmunotherapy with astatine-211 in relapsed ovarian carcinoma[C]∥ 8thInternational Symposium on Targeted Alpha Therapy. [s. n.], 2013: 16.
[28] Thorsten P, Zekiye K, Doris K, et al. In vitro experimental211At-anti-CD33 antibody therapy of leukaemia cells overcomes cellular resistance seen in vivo against gemtuzumab ozogamicin[J]. European Journal of Nuclear Medicine and Molecular Imaging, 2010, 37(5): 851-861.
[29] 劉寧,楊遠友,廖家莉,等. 近年來211At放射性藥物研究的新進展[J]. 同位素,2011,24(S1):36-43.
Liu Ning, Yang Youyuan Liao Jiali,et al. New progress of211At labelled radiopharmaceuticals recently[J]. Journal of Isotopes, 2011, 24(S1): 36-43(in Chinese).
[30] Liu N, Jin J N, Mo S W, et al. Prepartion and preliminary evaluation of astatine-211 labeled IgG via DTPA anhydride[J]. J Radioanal Nucl Chem, 1998, 227(1-2): 187-190.
[31] Liu N, Jin J N, Zhang S Y, et al.211At labeling of a monoclonal antibody and its Fab fragment: Cytotoxicity on human gastric cancer and biodistribution in nude mice with tumor exnografts[J]. J Radioanal Nucl Chem, 2001, 247(1): 129-133.
[32] Liu N, Jin J N, Zhang S Y, et al. Astatine-211 labeling of monoclonal antibody and its fab fragment: Synthesis,immunoreactivity and expermental therapy[J]. J Lablled Comp Radiopharm, 1995, 36(11): 1 105-1 113.
[33] Elgqvist J, Frost S, Pouget J P. The potential and hurdles of targeted alpha therapy-clinical trials and beyond[J]. Targeted alpha therapy, 2014, 3: 324-333.
[34] 牛芳,馬桃桃,孫秀華,等.212Pb/212Bi發生器的分離研究[J]. 核化學與放射化學,1991,20(3):189-192.
Niu Fang, Ma Taotao, Sun Xiuhua, et al. Separation studies of212Pb-212Bi Radionuclidic generator[J]. 1991, 20(3):189-192(in Chinese).
[35] Stuart F P, Perdrizet G, Steranka B, et al. Specific destruction of allogeneic tumor cells in vivo by a bismuth-212 immunotoxin[J]. Transplant Proc, 1987, 19(1): 605-606.
[36] Miao Y, Hylarides M, Fisher D R, et al. Melanoma therapy via peptide-targeted {alpha}-radiation[J]. Clin Cancer Res, 2005, 11(15): 5 616-5 621.
[37] Rotmensch J, Whitlock J L, Schwartz J L, et al. In vitro and in vivo studies on the development of the alpha-emitting radionuclide bismuth-212 for intraperitoneal use against microscopic ovarian carcinoma[J]. Gynecol, 1997, 176(4): 833-840.
[38] Milenic D E, Garmestani K, Brady E D, et al. Potentiation of high-LET radiation by gemcitabine: targeting HER2 with trastuzumab to treat disseminated peritoneal disease[J]. Clin Cancer Res, 2007, 13(6): 1 926-1 935.
[39] Hassfjell S P, Bruland ? S, Hoff P.212Bi-DOTMP: an alpha particle emitting bone-seeking agent for targeted radiotherapy[J]. Nucl Med Biol, 1997, 24(3): 231-237.
[40] Kozak R W, Atcher R W, Gansow O A, et al. Bismuth-212-labeled anti-Tac monoclonal antibody: alpha-particle-emitting radionuclides as modalities for radioimmunotherapy[J]. Proc Natl Acad Sci USA, 1986, 83(2): 474-478.
[41] Macklis R M, Kinsey B M, Kassis AI, et al. Radioimmunotherapy with alpha-particle-emitting immunoconjugates[J]. Science, 240(4 855): 1 024-1 026.
[42] Brechbiel M W, Waldmann T A. Anti-HER2 radioimmunotherapy[J]. Breast Dis, 2000, 11: 125-132.
[43] Beyer G J, Offord R, Allen B J, et al. Targeted Cancer Therapy: The Potential Role of Terbium-149. In Proc[C]∥6thInternational Conference on Radiopharmaceutical Dosimetry. Tennessee: [s. n.], 1996: 7-10.
[44] Abbas Rizvi S M, Henniker A J, Goozee G, et al. In vitro testing of the leukaemia monoclonal antibody WM-53 labeled with alpha and beta emitting radioisotopes[J]. Leukemia Res, 2002, 26(7): 37-43.
[45] Natouh S A. Radiobiological evaluation of213Bi and149Tb radioisotopes for targeted alpha therapy by computational methods[M]. Libya : Tajoura Nuclear Research Center, 2012: 1-4.
[46] Washiyama K, Amano R, Sasaki J, et al.227Th-EDTMP: a potential therapeutic agent for bone metastasis[J]. Nucl Med Biol, 2004, 31(7): 901-908.
[47] Dahle J, Borrebk J, Melhus KB, et al. Initial evaluation of (227)Th-p-benzyl-DOTA-rituximab for low-dose rate alpha-particle radioimmunotherapy[J]. Nucl Med Biol, 2006, 33(2): 271-279.
[48] Larsen R H. Oeyvind Bruland.Thorium-227 for use in radiotherapy of soft tissue disease: Norway, CA2522148A1[P]. 2004-04-15.

