多元電解質對脂肪酶有機相拆分炔戊醇的激活
崔麗娟,徐剛,孟梟,吳堅平,楊立榮
(浙江大學化學工程與生物工程學系,浙江 杭州 310027)
多元電解質對脂肪酶有機相拆分炔戊醇的激活
崔麗娟,徐剛,孟梟,吳堅平,楊立榮
(浙江大學化學工程與生物工程學系,浙江 杭州 310027)
脂肪酶是一種應用節廣泛的重要生物催化劑,提高脂肪酶在非天然環境中的催化性能逐步成為了一個研究熱點。研究表明,某些電解質的加入可顯著提高提脂肪酶在有機溶劑體系中的酶活和選擇性。然而有關研究主要考察單一電解質的作用,且涉及的電解質種類較少,更為系統的研究未見報道。本文以洋蔥假單胞菌脂肪酶(Pseudomonas cepacialipase,即PcL)催化手性菊酯農藥前體4-甲基庚-4-烯基-1-炔基-3-醇(炔戊醇)在甲苯中選擇性轉酯化為模型,系統考察了鹵化物、硝酸鹽、硫酸鹽、磷酸鹽等8類35種電解質單獨以及多種電解質協同對PcL催化性能的影響。結果表明,NaF-Na2HPO4/NaH2PO4的二元電解質體系具有遠高于任意單一電解質組分的性能,該體系使PcL活力提高23倍。進一步研究表明,這一電解質體系對PcL催化不同對映體轉酯化的活力提高程度不同,從而將其對映體選擇率(E值)由11提高到21。
有機相;電解質;脂肪酶;對映體選擇性;催化活力
有機相酶催化研究是一個值得關注的焦點。為了改善酶在有機相中的催化特性,研究者從不同角度出發,設計了一系列高效的研究方法[1-3]。這些方法可簡單分為兩類:催化劑工程和溶劑工程。前者主要通過蛋白質工程或調控酶的微環境[4-8]來改善酶的催化性能;后者主要通過添加少量水[9]或改變溶劑的疏水性[10]和極性[11]來改善酶的催化性能。其中,通過加入電解質來調控酶的微環境是最簡便有效的。研究表明,經電解質處理后,酶的催化性能得到顯著改善[12-15],這引起了學術界對其研究的廣泛興趣。1994年Clark等[16]首次報道了在酶的冷凍干燥(大多數應用到有機相體系中的酶粉由噴霧干燥制得,而經電解質處理的酶粉需要特殊方法制備,如冷凍干燥等)體系中加入非緩沖鹽可以大幅度提高其催化效率。他們通過向Hay bacillus protease的凍干體系中加入KCl,使其在正己烷中酯交換反應的kcat/Km值比無鹽加入時提高了3750倍。Yang等[17]發現通過加入EDTA-2Na,Candidasp. Lipase在正己烷中的轉酯化活力較原始酶提高了27倍。Yu等[18]發現加入LiCl后,Candida rugosaLipase在異辛烷中的酯化活力較原始酶提高了2倍,選擇性提高了1.6倍。Salis等[19]發現向Pseudomonas cepaciaLipase(PcL)的凍干體系中加入Na2SO4后,其在2-甲基-2-丁醇中的酯化活力較原始酶提高了9倍。Li等[20]研究發現,通過精確調控凍干過程,磷酸緩沖鹽摻雜能夠將PcL在有機相中的轉酯化活性提高近10倍,達到其水相本征活性的50 %。但目前在非天然體系中,關于電解質對脂肪酶催化性能影響的系統性研究以及不同電解質的協同作用卻鮮有報道。
本文以PcL在甲苯中催化4-甲基庚-4-烯基-1-炔基-3-醇(炔戊醇,MEYO)與乙酸乙烯酯轉酯化反應為研究對象,其中,炔戊醇是一種重要的手性農藥中間體,其S構型是一類擬除蟲菊酯產品的活性組分[21]。通過對35種電解質及其不同組合的研究,系統性地考察了電解質的種類、組合方式以及電解質的濃度對有機相中脂肪酶酶促轉酯催化性能的影響,最終發現經NaF-Na2HPO4/NaH2PO4的二元電解質體系(NaF 0.24mmol/L,Na2HPO4/ NaH2PO4100mmol/L)處理后,PcL的催化活力提高了23倍,對映體選擇率提高到初始的2倍。
1 實驗部分
1.1 實驗材料
洋蔥假單胞菌脂肪酶(Pseudomonas cepaciaLipase,縮寫為PcL,商品名Lipase PS)購自Amano Enzyme Inc.。炔戊醇、甲苯、乙酸乙烯酯、NaF、NaSCN、NaNO3、Na2CO3、Na2SO4、NaH2PO4、CH3COONa、4-羥乙基哌嗪乙磺酸(HEPES)、NaOH、HCl等,購于Sigma-Aldrich Inc.。
1.2 經電解質處理的PcL樣品制備
按需配制一定濃度的電解質溶液,用pH計(PHS-3C,上海精密科學儀器有限公司)進行校準,調整溶液的pH值到7.0。然后在4℃下,將0.030gPcL溶于3mL上述電解質溶液中,振蕩,分裝,-196℃預凍20min,冷凍干燥12h,冷凍干燥方法參照文獻[22],凍干完成后將樣品取出,儲于4℃保存待用。
1.3 模型反應
PcL催化轉酯化拆分炔戊醇的反應式如圖式1所示。反應在2mL Axygen密閉反應管中進行。反應條件為:甲苯1mL,炔戊醇100mmol/L,乙酸乙烯酯300mmol/L,粗酶粉(處理或未處理)10mg/mL,35℃,轉速220r/min。
1.4 數據分析
采用氣相色譜儀(Fuli 9790型,溫嶺福立分析儀器有限公司)分析樣品中各組分含量,CP-cyclodextrin-B-2,3,6-M-19手性柱。色譜條件為:氣化溫度250℃,檢測溫度260℃,柱溫110℃,載氣氮氣流速為45mL/min。(S)-酯、(R)-酯、(R)-醇和(S)-醇對應的保留時間均由標品確定,分別為20.8min、21.8min、22.5min 和24.7min。
根據反應初始階段(轉化率小于5%)單位時間內產物的增加量計算PcL的酶活。


圖1 PcL催化轉酯化拆分rac-炔戊醇
式中,X 為底物轉化率,X = (c0- c)/c0,c0及 c分別為反應前后底物醇的濃度,mmol/L;t為反應進行的時間,min;m為反應中使用的酶量,mg;p為PcL的蛋白含量,%。
參照文獻[23]計算反應的對映體選擇率:E = ln[1-X(1+eep)]/ln[1-X(1-eep)],其中eep為產物對映體過剩值,eep=|(S)-酯%-(R)-酯%|/[(S)-酯%+(R)-酯% ]。
2 結果與討論
2.1 電解質種類對PcL催化轉酯性能的影響
系統考察了8類35種電解質及其組合方式對PcL催化炔戊醇轉酯性能的影響,陽離子的影響見表1。可知,除Ni2+、Fe3+、Cu2+、Hg2+和Zn2+等過渡金屬離子外,大部分陽離子對PcL催化活力的影響較微弱,過渡金屬離子易與蛋白質發生特異性結合,形成沉淀,從而造成酶分子的不可逆失活。作者認為,電解質一方面可以調節酶微環境中的水活度,另一方面可以通過與酶分子間形成氫鍵和鹽橋來調節酶制劑的極性。而在不同溶劑中,同一種脂肪酶對水活度與極性的需求不同。這也是與文獻[17] 相比,該反應體系中 Na2SO4(表 1,編號1)未對PcL產生激活作用的原因。
陰離子的影響見表2。可知,大部分陰離子對PcL催化轉酯活力未見激活作用,而F-與其他鹵離子顯示出不同的規律,添加NaF(表2,編號20)后,PcL的催化活力較原始酶提高了1.6倍,因F-原子半徑較小,負電荷集中,易與酶分子周圍的陽離子產生靜電相互作用,利于維持酶分子的原始構象;加入Na2HPO4/NaH2PO4(表2,編號30)后,PcL的催化活力較原始酶提高了1.7倍,其激活程度小于文獻[18] 中的數值,除溶劑因素外,磷酸緩沖鹽pH值的不同也是影響酶催化性能的關鍵因素。
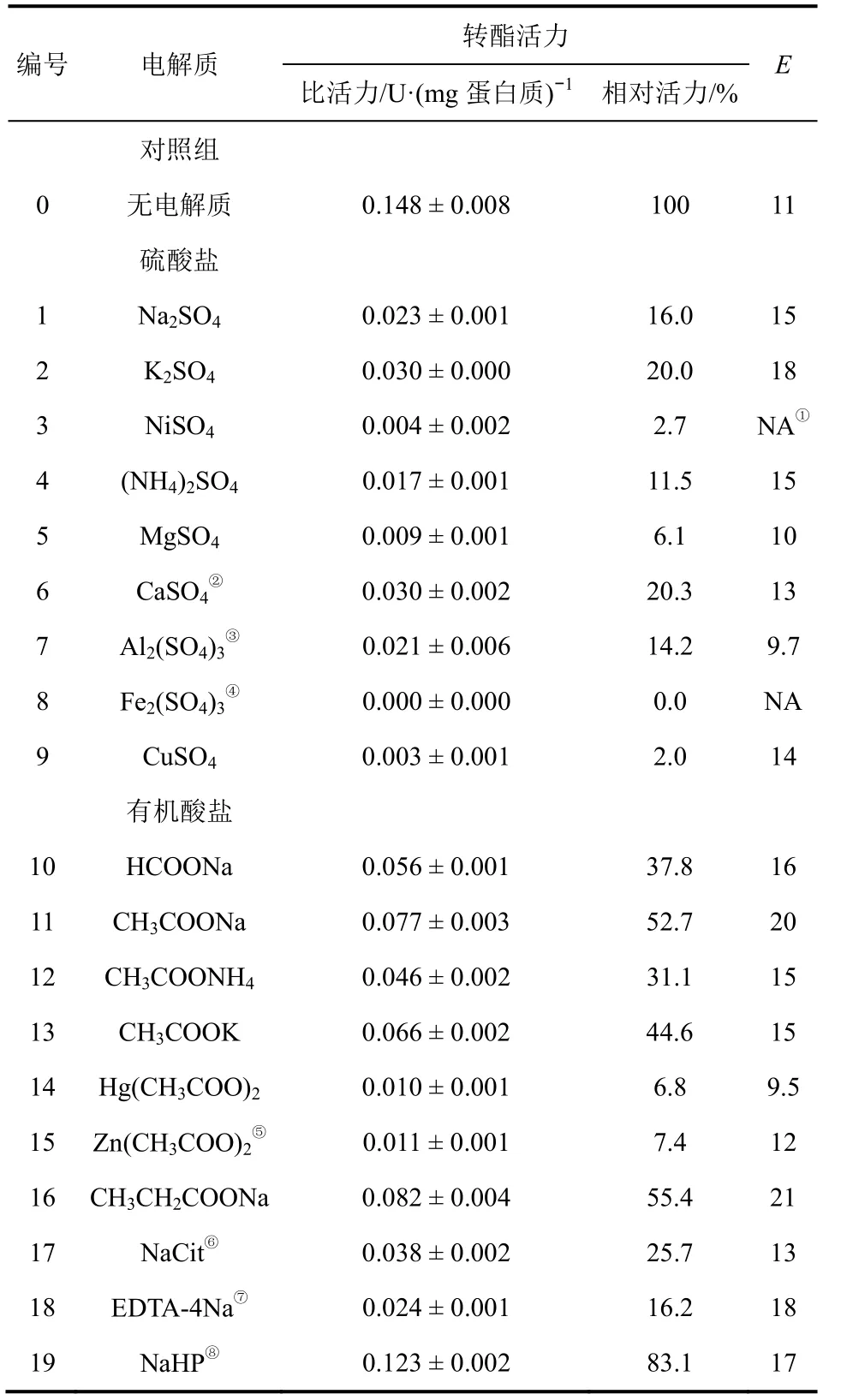
表 1 電解質陽離子對 PcL 催化轉酯性能的影響
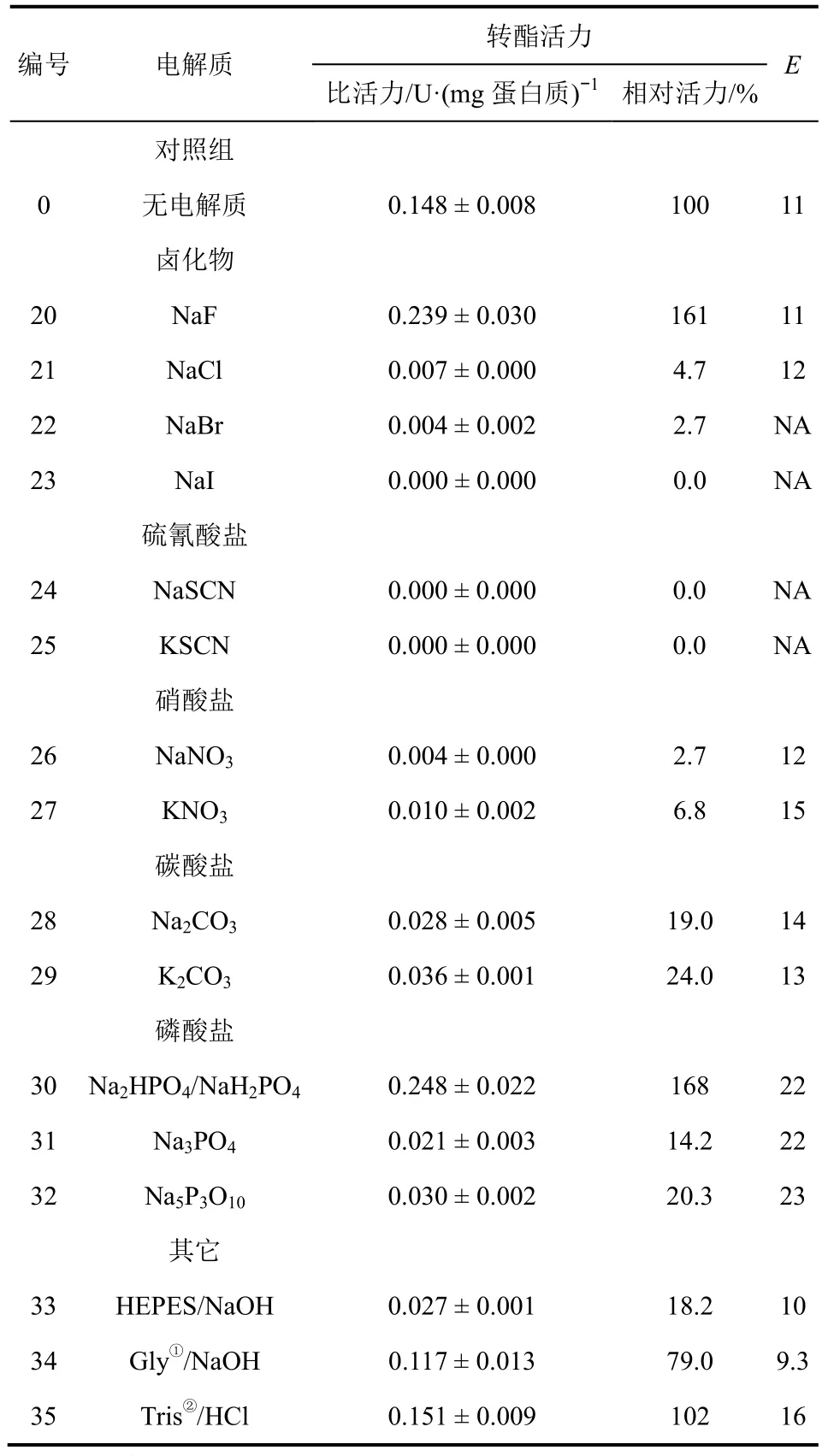
表2 電解質陰離子對PcL催化轉酯性能的影響
除陰陽離子外,進一步研究了多種陰陽離子協同作用對PcL催化轉酯性能的影響,表3可知,不同電解質組合后,PcL被迅速激活,經NaF與Na2HPO4/NaH2PO4(表3,編號5)混合作用,PcL的催化活力較原始酶提高了17倍,可見,多種電解質混合后具備了不同于單一電解質獨立存在時的性質。此結論獨立于電解質對脂肪酶的激活機理遵循霍夫邁斯特次序(按電解質聚沉能力的大小,排列所得)[24],以及與電解質JDB因子(JDB因子用來衡量電解質增加或降低水黏度的程度)[25]相關的假說。
2.2 電解質濃度對PcL催化轉酯性能的影響
由圖2可見,當NaF或Na2HPO4/NaH2PO4單獨存在時,電解質濃度對PcL催化活力的影響不甚顯著; NaF-Na2HPO4/NaH2PO4協同作用后,36組不同濃度組合呈現出規律性分布。在一定范圍內,電解質總濃度的提高較電解質濃度單一性提高,PcL催化活力的提升更加顯著,當到達一定含量后,PcL的催化活力隨著電解質含量的增加而不斷下降。推測,電解質含量的增加有利于其與酶分子間相互作用力的形成,經飽和狀態之后,繼續增加電解質的含量,此時多余的電解質就會覆蓋在酶分子的表面,阻礙脂肪酶與底物的接觸,從而使PcL的催化活力下降。可見,適宜的電解質含量有利于保持酶的催化活力,當NaF與Na2HPO4/NaH2PO4的濃度分別為0.24mmol/L、100mmol/L時,PcL的催化活力[3.342U/(mg蛋白質)]達到最佳,約為原始PcL催化活力[0.148U/(mg蛋白質)]的23倍。

表 3 電解質的不同組合對PcL催化轉酯性能的影響
2.3 電解質對PcL 催化不同對映體轉酯活力的影響

圖2 NaF與Na2HPO4/NaH2PO4的濃度對PcL催化轉酯活力的影響

圖3 NaF-Na2HPO4/NaH2PO4二元電解質體系對PcL催化不同對映體轉酯化活力的影響
研究了PcL催化的單一構型(R或S)炔戊醇體系,圖3為 NaF-Na2HPO4/NaH2PO4二元電解質體系對PcL催化不同對映體轉酯化活力的影響。由圖3可見,對同一種構型而言,NaF-Na2HPO4/ NaH2PO4二元電解質體系比任意單一電解質(NaF或 Na2HPO4/NaH2PO4)對PcL催化活力的影響更加顯著,這亦進一步證實2.1節的研究結果;兩種構型相比較,以原始酶的催化活力為基準,分別向凍干體系中加入NaF、 Na2HPO4/NaH2PO4、NaFNa2HPO4/NaH2PO4后,υR的提高較υS更加明顯,從而使其對映體選擇率(E值)由 11提高到21。
3 結 論
通過對8類35種電解質及其組合的研究,表明多種電解質的協同作用比單一電解質對PcL催化性能的影響更加顯著。另外,經電解質處理后,酶催化不同對映體轉酯化活力提高的程度不同,從而使其對映體選擇率(E值)得到相應的提高。
[1] 周勤麗,孟梟,徐剛,等. 基于化學修飾法探討脂肪酶對手性伯醇的識別機理[J]. 化工進展,2013,32(11):2695-2706.
[2] 曾嶸,楊忠華,姚善涇. 生物催化羰基不對稱還原合成手性醇的研究及應用進展[J]. 化工進展,2004,23(11):1169-1173.
[3] 張玉彬. 生物催化的手性合成[M]. 北京:化學工業出版社,2002:6-8.
[4] Ru M T,Hirokane S Y,Lo A S,et al. On the salt-induced activation of lyophilized enzymes in organic solvents:Effect of salt kosmotropicity on enzyme activity[J].J. Am. Chem. Soc.,2000,122(8):1565-1571.
[5] Wehtje E,Adlercreutz P,Mattiasson B. How do additives affect enzyme activity and stability in nonaqueous media[J].Biotechnol. Bioeng.,1997,54(1):67-76.
[6] Ghanem A. The utility of cyclodextrins in lipase-catalyzed transesterification in organic solvents:Enhanced reaction rate and enantioselectivity[J].Org. Biomol. Chem.,2003,1(8):1282-1291.
[7] Dabulis K,Klibanov A M. Dramatic enhancernent of enzymatic activity in organic solvents by lyoprotectants[J].Biotechnol. Bioeng.,1993,41(5):566-571.
[8] Morgan J A,Clark D S. Salt-activation of nonhydrolase enzymes for use in organic solvents[J].Biotechnol. Bioeng.,2004,85(4):456-459.
[9] Serdakowski A L,Munir I Z,Dordick J S. Dramatic solvent and hydration effects on the transition state of soybean peroxidase[J].J. Am. Chem. Soc.,2006,128(44):14272-14273.
[10] Parida S,Dordick J S. Substrate structure and solvent hydrophobicity control lipase catalysis and enantioselectivity in organic media[J].J. Am. Chem. Soc.,1991,113(6):2253-2259.
[11] Guinn R M,Skerker P S,Kavanaugh,et al. Activity and flexibility of alcohol dehydrogenase in organic solvents[J].Biotechnol. Bioeng.,1991,37(4):303-308.
[12] Lindsay J P,Clark D S,Dordick J S. Combinatorial formulation of biocatalyst preparations for increased activity in organic solvents:Salt activation of penicillin amidase[J].Biotechnol. Bioeng.,2004,85(5):553-560.
[13] Collins K D. Sticky ions in biological systems[J].Proc. Natl. Acad. Sci. USA.,1995,92:5553-5557.
[14] Eppler R K,Komor R S,Huynh J,et al. Water dynamics and salt-activation of enzymes in organic media:Mechanistic implications revealed by NMR spectroscopy[J].PNAS,2006,103(15):5706-5710.
[15] Hsu W T,Clark D S. Variations in the Enantioselectivity of salt-activated subtilisin induced by lyophilization[J].Biotechnol. Bioeng.,2001,73(3):231-237.
[16] Khmelnitsky Y L,Welch S H,Clark D S,et al.Salts dramatically enhance activity of enzymes suspended in organic solvents[J].J. Am. Chem. Soc.,1994,116(6):2647-2648.
[17] Wang P,Yang L R,Wu J P. Immobilization of lipase by salts and the transesterification activity in hexane[J].Biotechnol. Lett.,2001,23:1429-1433.
[18] Yu H W,Chen H,Yang Y Y,et al. Effect of salts on activity,stability and enantioselectivity ofCandida rugosalipase in isooctane[J].J. Mole. Catal. B.,2005,35:28-32.
[19] Bilanicova D,Salis A,Ninham B W,et al. Specific anion effects on enzymatic activity in nonaqueous media[J].J. Phys. Chem B.,2008,112(38):12066-12072.
[20] Jin Q R,Jia G Q,Wang X L,et al. Comparison of the salt-induced activation ofPseudomonas cepacialipase in organic media by phosphate buffer and sodium sulfate[J].Chin. J. Catal.,2013,34(6):1224-1231.
[21] Mitsuda S,Matsuo N,Nabeshima S. Preparation of (-)-α-ethynyl alcohol moieties of pyrethroid isecticides by lipase-catalyzed enantioselectivity hydrolysis[J].Biosci. Biotechol. Biochem.,1992,56(2):357-358.
[22] Ru M T,Dordick J S,Reimer J A,et al. Optimizing the salt-induced activation of enzymes in organic solvents:Effects of lyophilization time and water content[J].Biotechnol. Bioeng.,1999,63(2):233-241.
[23] Chen C S,Fujimoto Y,Girdaukas G,et al. Quantitative analyses of biochemical kinetic resolutions of enantiomers[J].J. Am. Chem. Soc.,1982,104(25):7294-7299.
[24] Salis A,Bilanicova D,Ninham B W,et al. Hofmeister effects in enzymatic activity:Weak and strong electrolyte influences on the activity ofCandida rugosaLipase[J].J. Phys. Chem. B,2007,111(5):1149-1156.
[25] Serdakowski A L,Dordick J S. Enzyme activation for organic solvents made easy[J].Trends Biotechnol.,2008,26(1):48-54.
Multi-electrolytes activation of Lipase for 4-methylhept-4-en-1-yn-3-ol resolution in organic media
CUI Lijuan,XU Gang,MENG Xiao,WU Jianping,YANG Lirong
(Department of Chemical and Biological Engineering,Zhejiang University,Hangzhou 310027,Zhejiang,China)
Lipase was an important biological catalyst,which was widely applied in many areas,how to improve its catalytic performance in non-natural environment has become a research hot spot gradually. Studies showed that the specific activity and enantioselectivity of lipase could be improved remarkably by adding some electrolytes into reaction system. However,relevant researches mainly focused on the role of single electrolyte,report on the types of electrolytes involved was much less,and further systematic research has not been reported yet. By utilizingPseudomonas cepacialipase (PcL)as the catalyst,the asymmetric transesterification resolution of 4-methylhept-4-en-1-yn-3-ol was conducted with the precursor of chiral chrysanthemum ester pesticides in hydrophobic organic media,the influences of 8 types,including halide,nitrate,sulfate,phosphate et al,35 kinds of electrolytes and their different combinations on PcL's catalytic performance were investigated systematically. The results indicate that the specific activity of PcL is 23 times higher than that of native lipase with synergistic effect of NaF,Na2HPO4and NaH2PO4. Further study shows that the improvement of enantioselectivity has been achieved from 11 to 21,due to the different degree of activation of enantiomers by PcL.
organic media;electrolytes;lipase;enantioselectivity;catalytic activity
O 643
A
1000-6613(2014)08-2150-05
10.3969/j.issn.1000-6613.2014.08.035
2013-12-18;修改稿日期:2014-01-07。
國家 973 計劃(2011CB710800)、國家自然科學基金(20936002)及國家 863 計劃(2011AA02A209)項目。
崔麗娟(1989—),女,碩士研究生。聯系人:吳堅平,副教授,研究方向為生物催化與轉化。E-mail wjp@zju.edu.cn。

