沒食子酸脫羧酶及酶法制備焦性沒食子酸研究進展
張亮亮,汪詠梅*,徐曼,陳笳鴻
(1.中國林業科學研究院林產化學工業研究所;生物質化學利用國家工程實驗室;國家林業局林產化學
工程重點開放性實驗室;江蘇省生物質能源與材料重點實驗室,江蘇南京 210042;2.中國林業科學研究院林業新技術研究所,北京 100091)
沒食子酸脫羧酶及酶法制備焦性沒食子酸研究進展
張亮亮1,2,汪詠梅1,2*,徐曼1,陳笳鴻1
(1.中國林業科學研究院林產化學工業研究所;生物質化學利用國家工程實驗室;國家林業局林產化學
工程重點開放性實驗室;江蘇省生物質能源與材料重點實驗室,江蘇南京 210042;2.中國林業科學研究院林業新技術研究所,北京 100091)
對沒食子酸脫羧酶及酶法制備焦性沒食子酸研究進展進行了介紹和綜述,重點介紹了產沒食子酸脫羧酶的微生物種類、發酵時間、底物濃度、pH值、溫度、金屬離子,氮源及接種量等對微生物發酵產高活性沒食子酸脫羧酶的影響因素,并簡述了酶法制備焦性沒食子酸的方法,指出了今后的研究方向。
沒食子酸;焦性沒食子酸;沒食子酸脫羧酶;單寧酶
焦性沒食子酸,又稱焦蒬酚或連苯三酚,是一種具有多種用途的化學試劑和化工原料,廣泛用于醫藥合成、染料、食品、農藥及電子產品等,作為顯影劑、熱敏劑、高分子材料的助劑以及化學分析試劑等。目前焦性沒食子酸的市場需求量為600 t/a左右,全國年產量為200~500 t/a,還滿足不了市場需求。生產焦性沒食子酸的主要原料是沒食子酸。沒食子酸主要由五倍子、塔拉等的提取物經水解后制得的。沒食子酸受熱脫羧后生成焦性沒食子酸。在我國,目前焦性沒食子酸主要采用化學法進行制備,其制備工藝主要有兩種[1-3]:一種是對沒食子酸直接高溫脫羧,該工藝需要在高溫下進行人工翻炒,不僅勞動強度大,產品得率較低,質量也不穩定。另一種是采用催化劑對沒食子酸進行加熱催化脫羧,該工藝具有得率高、操作簡便的優點,但產品中容易殘留微量催化劑。而微生物酶法則有助于解決上述弊端,因此,建立酶法制取焦性沒食子酸的新工藝具有“綠色”化學化工加工新工藝的重要意義。國外最早是日本學者從20世紀80年代初發現沒食子酸脫羧酶并開始研究微生物酶法制備焦性沒食子酸,國內目前尚未見到相關技術研究的報道。
1 產沒食子酸脫羧酶的微生物
單寧酸可在單寧酶的作用下發生降解生成沒食子酸,沒食子酸可在沒食子酸脫羧酶(GAD)的作用下發生脫羧反應生成焦性沒食子酸[4-6],反應過程見圖1。
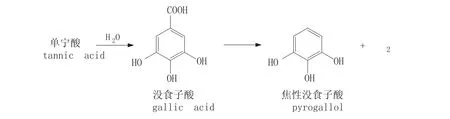
圖1 單寧酸生物降解過程Fig.1 Degradation of tannic acid
目前已從多種細菌中分離得到沒食子酸脫羧酶,已報道的能夠產生沒食子酸脫羧酶的細菌主要有成團泛菌(Pantoea agglomerans),弗氏檸檬酸菌(Citrobacter freundiiTB3),檸檬菌株(Citrobactersp.),腸桿菌(Enterobacterspp.),月形單胞菌(Selenomonasspp.)和鏈球菌(Streptococcusspp.)等[5,7-11],有些微生物種類不僅能產生沒食子酸脫羧酶同時也能產生單寧酶,如鏈球菌(Streptococcus gallolyticus),隆派恩菌(Lonepinella koalarum),植物乳桿菌(Lactobacillus plantarum),類植物乳桿菌(Lactobacillus paraplantarum),戊糖乳桿菌(Lactobacillus pentosus)和成團泛菌(Pantoea agglomerans)等[5,12-14]。除細菌外還發現一株酵母菌Rhodotorula glutinis也可以產生沒食子酸脫羧酶[15]。表1列出了已報道的能夠產生沒食子酸脫羧酶的微生物及其參考文獻。已經公開的有關沒食子酸脫羧酶及酶法制備焦性沒食子酸的專利僅有4項,見表2,均為日本研究人員在20世紀八九十年代所申請。
目前發現的產沒食子酸脫羧酶的菌株主要為腸桿菌屬(Enterobacter)、泛菌屬(Pantoea)和檸檬酸桿菌屬(Citrobacter)。這類細菌見于人和動物的糞便,或是正常腸道棲居菌,也見于土壤、水、污水和食物中。能發酵葡萄糖產酸產氣,為革蘭氏陰性的兼性厭氧桿菌,有周鞭毛,可以活動。

表1 產沒食子酸脫羧酶的微生物Table 1 Microbial sources of gallic acid decarboxylase(GAD)

表2 已發表的沒食子酸脫羧酶制備和應用的專利Table 2 Published patents regarding to GAD production and application
2 沒食子酸脫羧酶活性的影響因素
Soni等[9]研究了腸桿菌Enterobacter spp.發酵沒食子酸產沒食子酸脫羧酶的條件及酶活性的影響因素。分別考察了發酵時間、底物濃度、緩沖液濃度、pH值、發酵溫度、金屬離子種類及濃度、氮源、攪拌速度和接種量對焦性沒食子酸產量及沒食子酸脫羧酶活性的影響。
2.1 發酵時間的影響
發酵時間對焦性沒食子酸的產量及沒食子酸脫羧酶的活性影響較大。經20 h發酵后焦性沒食子酸的產量及沒食子酸脫羧酶的活性均達到最大值,分別為190 μg/mL和0.193 U/mL[9]。發酵4、8及20 h后取樣分析,焦性沒食子酸產量分別為10.54、13.33及15.81 μg[9]。Yoshida等[21]研究發酵時間對檸檬菌株(Citrobacterspp.)產沒食子酸脫羧酶的影響時發現,發酵48 h后沒食子酸脫羧酶的產率達到最大,沒食子酸的最大轉化率為69.8%。Zeida等[5]研究成團泛菌(Pantoea agglomerans)產沒食子酸脫羧酶發現在反復震蕩培養條件下,發酵24 h后發酵產物中沒食子酸脫羧酶含量達到最高。
2.2 底物濃度及磷酸緩沖液的影響
以沒食子酸作為唯一碳源進行微生物發酵時,當沒食子酸底物質量分數為0.2%時腸桿菌(Enterobacterspp.)產沒食子酸脫羧酶酶活達到最高(0.156 U/mL),同時胞外蛋白濃度達到最大值(62.45 mg/L)[9]。Zeida等[2]研究發現當沒食子酸底物濃度為3 g/L時成團泛菌(Pantoea agglomerans)產沒食子酸脫羧酶酶活最高。通過對發酵液中不同緩沖液體系的比較研究發現,在發酵液中添加磷酸鹽緩沖液發酵產物中沒食子酸脫羧酶酶活最高。發酵液中磷酸鹽緩沖液濃度為30 mmol/L時發酵產物中沒食子酸脫羧酶活性最高(0.137 U/mL),蛋白質含量為54.67 mg/L[9]。
2.3 pH值及發酵溫度的影響
發酵生產沒食子酸脫羧酶過程中,pH值能夠顯著的影響發酵產生的蛋白質含量和沒食子酸脫羧酶活性。當pH值為6.6時,腸桿菌(Enterobacterspp.)發酵產沒食子酸脫羧酶發酵產物中蛋白質含量最大且產生的沒食子酸脫羧酶酶活最高,蛋白質含量及沒食子酸脫羧酶活性分別為52.45 μg/mL和0.131 U/mL[9]。發酵時pH值的控制對微生物生長、沒食子酸脫羧酶的產率及發酵原料的降解都起到至關重要的作用。文獻報道不同的細菌發酵產高活性沒食子酸脫羧酶的最適宜pH值范圍為5~6.6之間。
發酵溫度對沒食子酸脫羧酶的產率及活性同樣具有很大的影響。Soni等[9]考察了不同發酵溫度(25、30、35、40和45℃)對腸桿菌(Enterobacterspp.)發酵產沒食子酸脫羧酶產量及活性的影響,發現最佳發酵溫度為30℃,在此溫度下發酵產物中胞外蛋白質濃度及沒食子酸脫羧酶的活性最大,分別為42.42 mg/L和0.106 U/mL。
2.4 金屬離子的影響
Soni等[9]以沒食子酸為底物,研究了不同金屬離子(Fe2+、Cu2+、Mg2+、Co2+、Mn2+、K+及Zn2+)對腸桿菌(Enterobacterspp.)發酵產物中胞外蛋白質含量及沒食子酸脫羧酶產率的影響。發現Mg2+對發酵過程影響最大,當有Mg2+存在的條件下發酵產物中沒食子酸脫羧酶的含量最高,為0.175 U/mL,同時發酵產物中胞外蛋白質含量最高,為70.29 mg/L。且進一步研究發現當0.06%Mg2+時發酵產物中沒食子酸脫羧酶及蛋白質含量最高,分別為0.164 U/mL和65.75 mg/L。Yoshida等[21]研究了以沒食子酸為底物,利用檸檬菌株(Citrobacterspp.)發酵產沒食子酸脫羧酶的過程,發現在發酵原料中添加0.05%的MgSO4得到發酵產物中沒食子酸脫羧酶含量最高。Kumar等[7]發現在發酵原料中添加濃度為0.5 mol/L的MgSO4同樣能夠促進弗氏檸檬酸菌(Citrobacter freundiiTB3)發酵產沒食子酸脫羧酶的產率。Zeida等[5]研究發現每升發酵原料中添加0.5 g的MgSO4·7H2O和0.01 g的FeSO4·7H2O可促進成團泛菌(Pantoea agglomerans)發酵產沒食子酸脫羧酶的產率。
2.5 氮源的影響
Soni等[9]通過在發酵原料中添加硝酸銨,氯化銨及硫酸銨3種不同氮源,考察了不同氮源對發酵產物中蛋白質含量及沒食子酸脫羧酶產率的影響。發現在發酵原料中添加0.04%(NH4)2SO4作為發酵氮源時得到發酵產物中沒食子酸脫羧酶活性最高,為0.101 U/mL,蛋白質含量也最高,為43.11 mg/L。在利用微生物發酵產沒食子酸脫羧酶過程中,通常添加NH4Cl作為氮源。
2.6 攪拌速率及接種量的影響
研究發現攪拌速率對微生物發酵產沒食子酸脫羧酶具有一定的影響,當攪拌速率為150 r/min時,發酵產物中沒食子酸脫羧酶活性最高,為0.095 U/mL,焦性沒食子酸含量也達到最高,為37.92 mg/L。Soni等[9]研究了在含有100 mL發酵原料的三角瓶中分別按照1%、2%、3%、4%、5%和6%的接種量進行接種培養。發現當接種量為5%時發酵產物中沒食子酸脫羧酶和蛋白質含量最高,分別為0.057 U/mL和22.64 mg/L。
3 酶法制備焦性沒食子酸研究狀況
Yoshida等[8]研究了酶法制備焦性沒食子酸的生物脫羧過程:檸檬菌株(Citrobactersp.)在28℃下培養24 h后,加入7.5%沒食子酸引發反應。為避免底物氧化及氧氣引起的其它副反應,反應操作應在無氧條件下進行,加入少量L-抗壞血酸作除氧劑,調pH值為4.5,加入沒食子酸即有大量CO2氣體放出。每2 h取一次樣分析,8 h后停止。產物經離心沉降、溶劑萃取、再蒸發溶劑即得焦性沒食子酸,焦性沒食子酸產率達到97.4%。
Soni等[9]報道了腸桿菌(Enterobacterspp.)30℃下在含有0.2%沒食子酸、0.4%(NH4)2SO4、0.05%MgSO4、pH值為6.6、30 mmol/L磷酸鹽作為緩沖液的培養液中培養20 h,可得到焦性沒食子酸產品。Kumar等[7]設計了一種能夠進行連續發酵控制的圓柱形生物反應器,將弗氏檸檬酸菌(Citrobacter freundii)固定到κ-型卡拉膠(κ-carrageenan)上進行沒食子酸連續脫羧反應制備焦性沒食子酸,控制發酵混合液以0.5 mL/min的流速通過反應器進行沒食子酸脫羧反應,得到發酵產物中焦性沒食子酸最高含量為7.3 g/L,焦性沒食子酸的轉化率達到98.5%。
Shinya等[23]從土壤中分離得到一株能夠產生沒食子酸脫羧酶的細菌成團泛菌(Pantoea agglomerans),并研究了沒食子酸脫羧酶制備焦性沒食子酸的脫羧過程。發現沒食子酸脫羧酶酶活的最佳條件為:pH值5.5~6.5,溫度50℃。經SDS-聚丙烯酰胺凝膠電泳(SDS-PAGE)分析沒食子酸脫羧酶分子量為58 ku,經凝膠滲透色譜-液相色譜法分析沒食子酸脫羧酶分子量為442 ku,經氨基酸序列測定其N-末端氨基酸序列為Ser-Asn-Thr-Gln-Asn-Leu-Pro-Ala-Asn-Asp-Val-Tyr-Asp-Leu-Arg。
最早研究酶法制備焦性沒食子酸,是利用微生物發酵沒食子單寧(gallotannin)或塔拉單寧(tara tannin)來制備焦性沒食子酸。但這類脫羧反應過程非常緩慢,只有25.8%的沒食子單寧(發酵液中為1%的沒食子單寧)和28.5%的塔拉單寧(發酵液中為1%的塔拉單寧)轉化為焦性沒食子酸[8]。之后研究人員開始直接以沒食子酸為底物,研究微生物發酵制備焦性沒食子酸,焦性沒食子酸的產率得到了提高,經發酵條件優化后焦性沒食子酸的轉化率普遍能達到90%以上。除了以植物單寧或沒食子酸為原料制備焦性沒食子酸外,近年來有研究者利用重組大腸桿菌(Escherichia coliKL7/pSK6.161)以自然界資源更為豐富的葡萄糖為原料,合成了沒食子酸和焦性沒食子酸[24]。在該反應中葡萄糖轉化為沒食子酸的轉化率為12%,沒食子酸轉化為焦性沒食子酸的轉化率達到了93%~97%。
4 小結與展望
采用微生物發酵法對沒食子酸脫羧制備焦性沒食子酸的研究已經在國外進行了多年,篩選出了多種具有高效沒食子酸脫羧能力的微生物菌株。這些研究主要集中在產高活性沒食子酸脫羧酶菌株的篩選和酶法制備焦性沒食子酸發酵條件的優化上。目前國內尚未見到酶法制備焦性沒食子酸產業化的報道。這是因為沒食子酸脫羧酶的應用還受到一定程度的限制,有些細菌產生的沒食子酸脫羧酶酶活太低而沒有實用價值,有些酶活雖高卻沒有合適的應用手段等條件的制約。對于前者,可以借鑒單寧酶的研究手段運用物理、化學誘變、原生質體融合以及分子克隆和遺傳工程手段改良菌種。目前國際上尚未見到這方面的研究報道,這是目前該領域需要重點研究的工作。對于后者,人們正通過酶的固定化等方法加以克服。對單寧酶及其應用的研究國內已有大量報道。但國內至今仍未見到沒食子酸脫羧酶及酶法制備焦性沒食子酸的相關報道。目前,產高活性沒食子酸脫羧酶菌株的篩選及酶法制備焦性沒食子酸技術的研究已列為國家863研究課題計劃。相信隨著對沒食子酸脫羧酶的深入研究,必將促進我國五倍子加工產業的發展。
[1]李蘭英,李玉新,楊雄輝.焦性沒食子酸的制備和用途[J].湖南化工,1991(4):13-15.
[2]程從球,王亞兵.焦性沒食子酸制備新工藝的研究[J].林產化學與工業,1994,14(4):15-18.
[3]杜運平,張宗和.焦性沒食子酸的制備方法及應用[J].生物質化學工程,2011,45(1):47-52.
[4]HASLAM E,HAWORTH R,JONES K,et al.Gallotannins.Introduction:and the fractionation of tannase[J].Journal of the Chemical Society(Resumed),1961:1829-1835.
[5]ZEIDA M,WIESER M,YOSHIDA T,et al.Purification and characterization of gallic acid decarboxylase from Pantoea agglomerans T 71[J].Applied and Environmental Microbiology,1998,64(12):4743-4747.
[6]BRUNE A,SCHINK B.Phloroglucinol pathway in the strictly anaerobic Pelobacter acidigallici:fermentation of trihydroxybenzenes to acetate via triacetic acid[J].Archives of Microbiology,1992,157(5):417-424.
[7]KUMAR R A,JAYARAMAN A,LAKSHMANAN M,et al.Bioconversion of gallic acid into pyrogallol by immobilized Citrobacter freundii TB3[J].Journal of Fermentation and Bioengineering,1992,74(3):159-162.
[8]YOSHIDA H,YAMADA H.Microbial production of pyrogallol through decarboxylation of gallic acid[J].Agricultural and Biological Chemistry,1985,49(3):659-663.
[9]SONI M,SHARMA K P,JOHN P.Characterization of pyrogallol production from gallic acid by Enterobacter spp[J].Journal of Microbiology and Biotechnology Research,2012,2(2):327-336.
[10]ODENYO A A,BISHOP R,ASEFA G,et al.Characterization of tannin-tolerant bacterial isolates from East African ruminants[J].Anaerobe,2001,7(1):5-15.
[11]O′DONOVAN L,BROOKER J D.Effect of hydrolysable and condensed tannins on growth,morphology and metabolism of Streptococcus gallolyticus(S.caprinus)and Streptococcus bovis[J].Microbiology,2001,147(4):1025-1033.
[12]OSAWA R,FUJISAWA T,SLY L I.Streptococcus gallolyticus sp.nov.;gallate degrading organisms formerly assigned to Streptococcus bovis[J].Systematic and Applied Microbiology,1995,18(1):74-78.
[13]OSAWA R,RAINEY F,FUJISAWA T,et al.Lonepinella koalarum gen.nov.,sp.nov.,a new tannin-protein complex degrading bacterium[J].Systematic and Applied Microbiology,1995,18(3):368-373.
[14]KAR B,BANERJEE R,BHATTACHARYYA B.Effect of additives on the behavioural properties of tannin acyl hydrolase[J].Process Biochemistry,2003,38(9):1285-1293.
[15]GUPTA J,JEBSEN C,KNEIFEL H.Sinapic acid degradation by the yeast Rhodotorula glutinis[J].Journal of General Microbiology,1986,132(10):2793-2799.
[16]GRANT D,PATEL J.The non-oxidative decarboxylation of p-hydroxybenzoic acid,gentisic acid,protocatechuic acid and gallic acid by Klebsiella aerogenes(Aerobacter aerogenes)[J].Antonie Van Leeuwenhoek 1969,35(1):325-343
[17]HADDOCK J D,FERRY J G.Initial steps in the anaerobic degradation of 3,4,5-trihydroxybenzoate by Eubacterium oxidoreducens:characterization of mutants and role of 1,2,3,5-tetrahydroxybenzene[J].Journal of Bacteriology,1993,175(3):669-673.
[18]KRUMHOLZ L,CRAWFORD R,HEMLING M,et al.Metabolism of gallate and phloroglucinol in Eubacterium oxidoreducens via 3-hydroxy-5-oxohexanoate[J].Journal of Bacteriology,1987,169(5):1886-1890.
[19]NAKAJIMA H,OTANI C,NIIMURA T.Decarboxylation of gallate by cell-free extracts of Streptococcus faecalis and Klebsiella pneumoniae isolated from rat feces[J].Journal of the Food Hygienic Society of Japan,1992(33):371-377.
[20]SAMAIN E,ALBAGNAC G,DUBOURGUIER H C.Initial steps of catabolism of trihydroxybenzenes in Pelobacter acidigallici[J].Archives of Microbiology,1986,144(3):242-244.
[21]YOSHIDA H,TANI Y,YAMADA H.Isolation and identification of a pyrogallol producing bacterium from soil[J].Agricultural and Biological Chemistry,1982,46(10):2539-2546.
[22]SHARMA K P,JOHN P.Purification and characterization of tannase and tannase gene from Enterobacter sp.[J].Process Biochemistry,2011,46(1):240-244.
[23]SHINYA M,YASUSHI H,KIKUO W,et al.Gallic Acid Decarboxylase and Production of Pyrogallol:JP 19970222339[P].1997.
[24]KAMBOURAKIS S,DRATHS K M,FROST J W.Synthesis of gallic acid and pyrogallol from glucose:Replacing natural product isolation with microbial catalysis[J].Journal of the American Chemical Society,2000,122(37):9042-9043.
Research Progress on Gallic Acid Decarboxylase and Microbial Production of Pyrogallol through Decarboxylation of Gallic Acid
ZHANG Liang-liang1,2,WANG Yong-mei1,2,XU Man1,CHEN Jia-hong1
(1.Institute of Chemical Industry of Forest Products,CAF;National Engineering Lab.for Biomass Chemical Utilization;Key and Open Lab.of Forest Chemical Engineering,SFA;Key Lab.of Biomass Energy and Material,Jiangsu Province,Nanjing 210042,China;2.Research Institute of Forestry New Technology,CAF,Beijing 100091,China)
The gallic acid decarboxylase and microbial production of pyrogallol through decarboxylation of gallic acid was reviewed.Main focuses were enzyme-producing strains and the factors influencing the activities of gallic acid decarboxylase,such as time,concentration of gallic acid,pH value,temperature,metal ions,nitrogen sources and inoculums size.Finally,methods of microbial production of pyrogallol through decarboxylation of gallic acid were introduced briefly.The future study direction was pointed out.
Gallic acid;Pyrogallol;Gallic acid decarboxylase;Tannase
TQ35
A
1673-5854(2014)04-0035-05
10.3969/j.issn.1673-5854.2014.04.007
2013-10-24
國家863計劃資助(SS2014AA021802)
張亮亮(1981—),男,江蘇沭陽人,博士,副研究員,主要從事植物化學研究;E-mail:zhll20086@gmail.com
*通訊作者:汪詠梅,副研究員,主要從事植物資源化學利用研究;E-mail:njlhswym@163.com。

