Hβ分子篩催化合成環(huán)己酮甘油縮酮及工藝優(yōu)化
陸禹吉,王成章,高勤衛(wèi),葉建中,陶冉
(1.南京林業(yè)大學化學工程學院,江蘇南京 210037;2.中國林業(yè)科學研究院林產(chǎn)化學工業(yè)研究所,國家林業(yè)局林產(chǎn)化學工程重點開放性實驗室;江蘇省生物質能源與材料重點實驗室,江蘇南京 210042)
Hβ分子篩催化合成環(huán)己酮甘油縮酮及工藝優(yōu)化
陸禹吉1,2,王成章2*,高勤衛(wèi)1*,葉建中2,陶冉2
(1.南京林業(yè)大學化學工程學院,江蘇南京 210037;2.中國林業(yè)科學研究院林產(chǎn)化學工業(yè)研究所,國家林業(yè)局林產(chǎn)化學工程重點開放性實驗室;江蘇省生物質能源與材料重點實驗室,江蘇南京 210042)
以甘油和環(huán)己酮為原料,Hβ分子篩為催化劑,研究了環(huán)己酮甘油縮酮的合成工藝。采用IR、GC-MS等分析技術對合成所得產(chǎn)物的結構進行了分析測定。探討了反應條件對產(chǎn)物收率的影響,采用正交試驗方法確定了縮酮反應的最適工藝條件:0.1 mol環(huán)己酮,0.15 mol甘油,反應時間90 min,反應溫度90℃,催化劑用量為0.2 g。在此條件下進行了3次穩(wěn)定性實驗,實驗表明,反應穩(wěn)定性較好,并且產(chǎn)物2-羥甲基-l,4-二氧雜螺環(huán)[4,5]癸烷的收率達95%以上。討論了反應機理和產(chǎn)物的選擇性。
環(huán)己酮;甘油;Hβ分子篩;縮酮反應;正交試驗;機理
環(huán)己酮甘油縮酮是帶有清香、花木香的香料,具有留香持久,原料來源豐富,生產(chǎn)工藝簡單,化學性質穩(wěn)定等優(yōu)點[1]。環(huán)己酮甘油縮酮的原料甘油近年來作為油脂行業(yè)過剩的副產(chǎn)物也備受關注。因此開發(fā)此類以甘油為原料的高附加值產(chǎn)品成為當前的熱點問題[2-3]。此外,環(huán)己酮甘油縮酮還可作為合成丙烯酸環(huán)雜脂的原料,制備光固化活性稀釋劑[4]。傳統(tǒng)的合成方法是在無機強酸(硫酸、鹽酸、磷酸等)催化下,將酮與醇直接反應,生成縮酮,但強酸對設備腐蝕嚴重,且反應時間長、后處理復雜、環(huán)境污染嚴重。近年來又發(fā)展了很多催化劑,如路易斯酸鹽[5-6]、固體超強酸[7-8]、固載雜多酸[9]、離子液體[10]、分子篩[11]等,都對合成環(huán)己酮甘油縮酮有良好的催化作用。Hβ分子篩催化劑催化縮酮反應條件溫和、反應過程簡單易控,克服了傳統(tǒng)液體酸催化劑的缺點,具有良好的催化穩(wěn)定性,且回收簡單、重復利用性良好。該催化劑不會產(chǎn)生酸性廢水,對環(huán)境污染小,為環(huán)保型催化劑之一,并且產(chǎn)物分離方便,具有很好的開發(fā)應用前景。本研究選取Hβ分子篩為催化劑,考察了反應條件對產(chǎn)物2-羥甲基-l,4-二氧雜螺環(huán)[4,5]癸烷收率的影響,并通過正交試驗法研究了該反應的最佳合成工藝,旨在為合成光固化涂料稀釋劑奠定基礎,減少因使用傳統(tǒng)涂料而對環(huán)境造成的污染。
1 實驗
1.1 試劑與儀器
甘油、環(huán)己酮、環(huán)己烷、石油醚(60~90℃),均為分析純;Hβ分子篩(南開大學催化劑廠)。
GC-2010氣相色譜儀,日本島津公司;Agilent 7890A/5975C GC-MS氣相-質譜聯(lián)用儀,美國安捷倫公司;FT-IR-360紅外光譜儀,美國尼高力公司。
1.2 反應原理
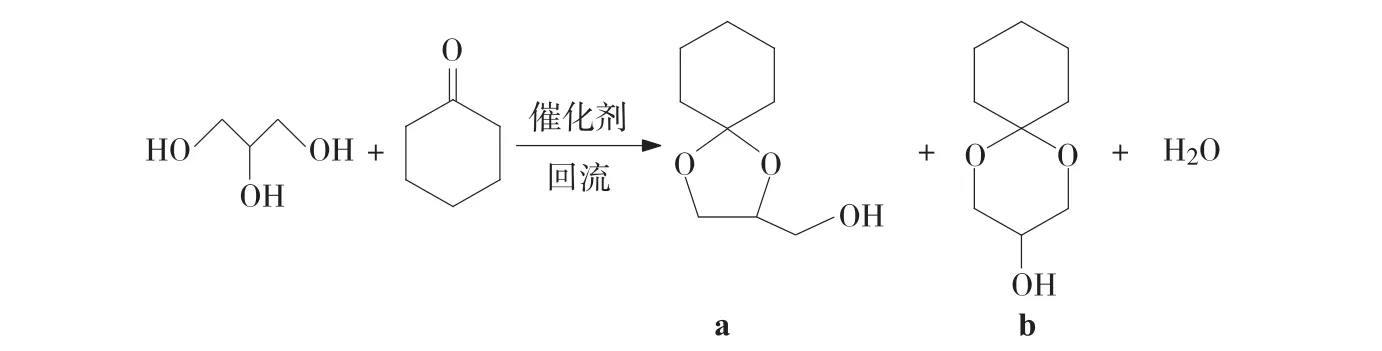
甘油和環(huán)己酮在催化劑和帶水劑(環(huán)己烷)的存在下縮合成環(huán)己酮甘油縮酮,產(chǎn)物為2-羥甲基-l,4-二氧雜螺環(huán)[4,5]癸烷(a)和3-羥基-1,5-二氧雜螺環(huán)[5,5]十一烷(b)兩種同分異構體和水,反應式如下所示。
1.3 環(huán)己酮甘油縮酮產(chǎn)物的合成及純化
在備有電磁攪拌、回流冷凝管、分水器的100 mL三口燒瓶中,依次加入甘油、環(huán)己酮、環(huán)己烷和Hβ分子篩固體催化劑,加熱回流攪拌,使反應產(chǎn)生的水與共沸劑環(huán)己烷共沸蒸出,反應過程中定時取樣分析。反應一定時間,結束后冷卻至室溫,過濾分離催化劑,濾液經(jīng)減壓蒸餾除去環(huán)己烷和環(huán)己酮,再經(jīng)石油醚(60~90℃)萃取除去甘油,最后旋蒸得到產(chǎn)品。
1.4 產(chǎn)物分析
產(chǎn)物定性由FT-IR、GC-MS分析。FT-IR為全反射法測定紅外光譜,掃描范圍為450~4000 cm-1;GC-MS條件為:EI電離源,70 eV,掃描范圍m/z=12~450,掃描時間1 s,進樣量0.2 μL。
產(chǎn)物的定量采用GC面積歸一法,分析條件為:氫火焰離子檢測器;石英毛細管柱HP-5MS(30 m× 0.25 mm×0.25 μm);進樣口及檢測室溫度:280℃;柱溫采用程序升溫,初溫50℃,保持2 min,以20℃/min的速率升至260℃,保持5 min;載氣:He,40 mL/min;燃氣:H2,45 mL/min;空氣:480 mL/min;進樣量為0.5 μL;分流比:20∶1。
2 結果與討論
2.1 產(chǎn)物的分析鑒定
采用IR、GC-MS對合成產(chǎn)物(a和b)的化學結構進行了測定。圖1為純化后縮酮產(chǎn)物的紅外光譜圖,從圖1中可以看出:3392.60 cm-1處為O—H的伸縮振動吸收峰,2931.90 cm-1和2860.50 cm-1為亞甲基的C—H伸縮振動吸收峰,1448.33 cm-1處為環(huán)內亞甲基C—H的彎曲振動,1096.42 cm-1處為C—O的伸縮振動吸收峰,證明產(chǎn)物中醚鍵的存在[12-13]。
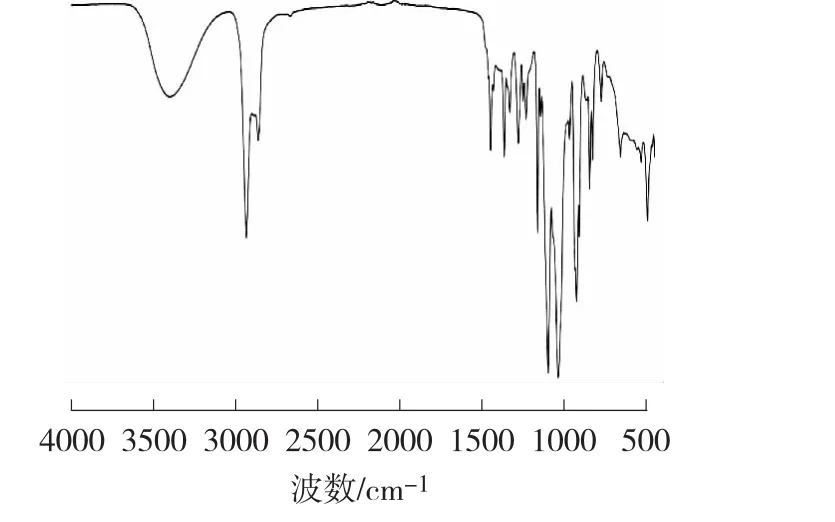
圖1 產(chǎn)物的紅外光譜圖Fig.1 FT-IR spectrum of the product
產(chǎn)物a和產(chǎn)物b的質譜圖如圖2所示:明顯看出縮酮產(chǎn)物的的分子離子峰m/z=172。比較兩張質譜圖可以發(fā)現(xiàn),產(chǎn)物a中有產(chǎn)物b沒有的m/z=141的碎片,該特征峰為2-羥甲基-1,4-二氧雜螺環(huán)[4,5]癸烷(a)失去羥甲基后的碎片峰。其他碎片峰m/z分別為:143(M+—C2H5)、129(M+—C3H7)、55(129—C3H6O2)和116(M+—C4H8)。從而可以證實產(chǎn)物a為2-羥甲基-1,4-二氧雜螺環(huán)[4,5]癸烷,產(chǎn)物b為3-羥基-1,5-二氧雜螺環(huán)[5,5]十一烷。
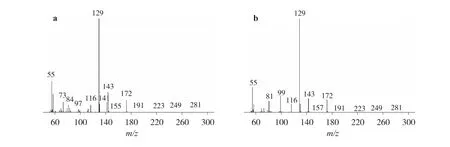
圖2 產(chǎn)物a和產(chǎn)物b的質譜圖Fig.2 MS spectra of products a and b
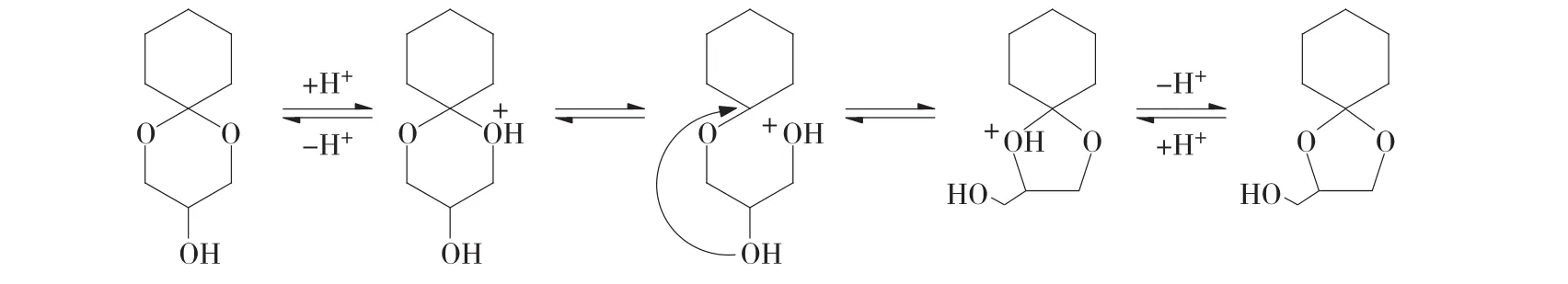
2.2 反應機理研究以及產(chǎn)物選擇性的討論
環(huán)己酮甘油縮酮反應機理如下式所示,羰基化合物在酸位上吸附,甘油作為親核試劑進攻,形成半縮酮,半縮酮再吸附到酸位上,發(fā)生脫水反應,附近的羥基進攻碳正離子,發(fā)生親核加成反應,最終形成2-羥甲基-l,4-二氧雜螺環(huán)[4,5]癸烷(a)和3-羥基-1,5-二氧雜螺環(huán)[5,5]十一烷(b)兩種同分異構體。
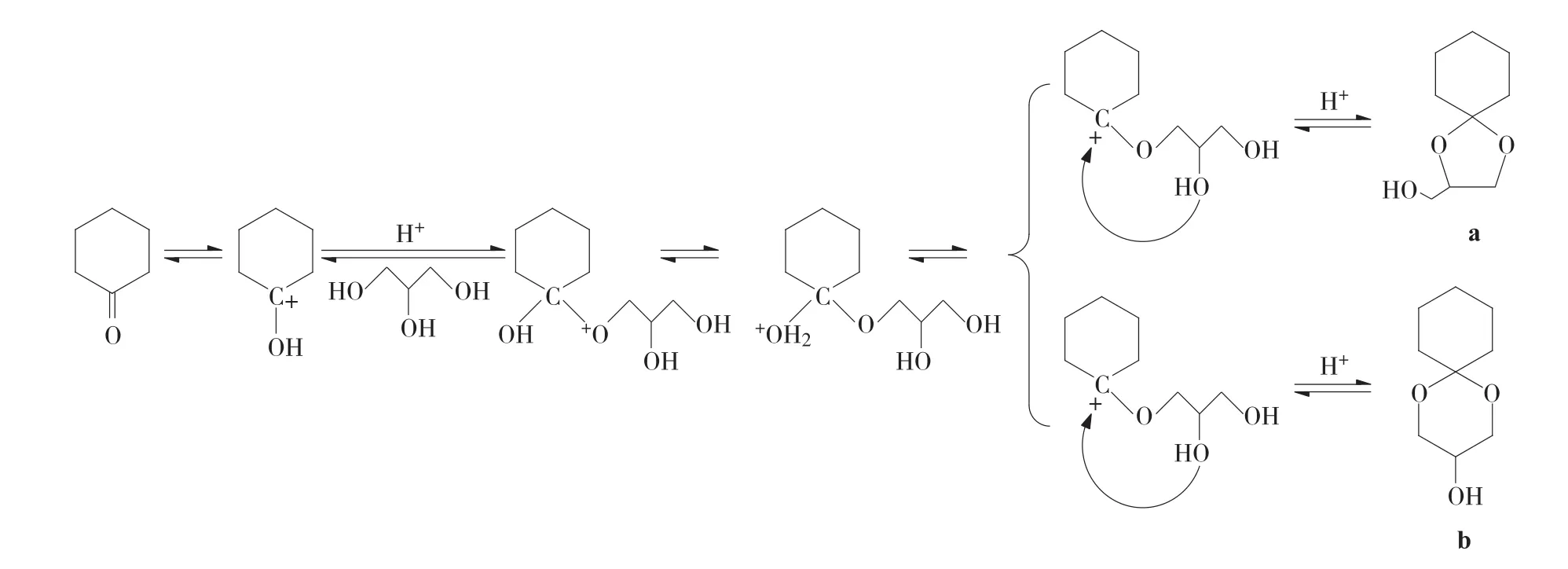
受動力學和熱力學不同程度的控制,不同反應條件下產(chǎn)物的選擇性比例不同[14]。由于該縮酮反應產(chǎn)物以主產(chǎn)物a和副產(chǎn)物b為主,因此不同產(chǎn)物的選擇性以各產(chǎn)物占兩種產(chǎn)物總和的質量分數(shù)計算。在正交試驗各反應的條件下,通過GC面積歸一法測得各產(chǎn)物的選擇性,結果如表1所示。
由表1可知,該反應產(chǎn)物主要以產(chǎn)物a為主,選擇性均達到95%以上,這可能是在酸性條件下,六元環(huán)上的羥基進攻碳正離子,最終形成五元環(huán)。機理如下式所示。
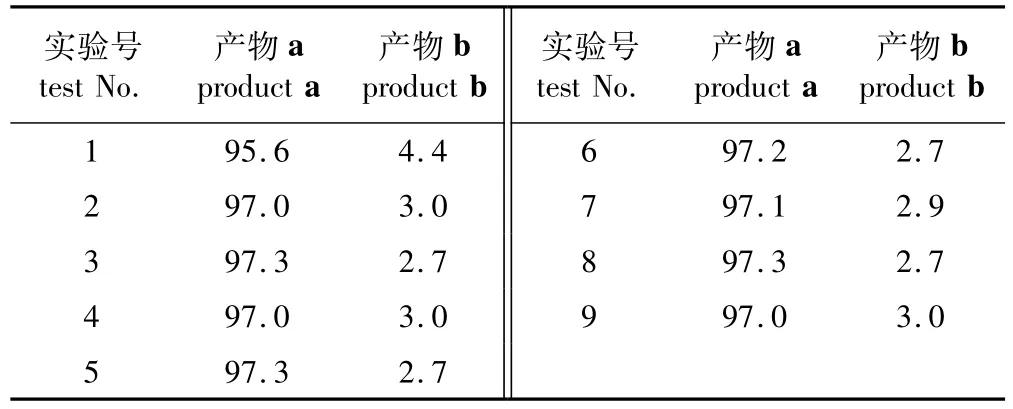
表1 產(chǎn)物的選擇性Table 1 Selectiveness of product %
2.3 制備條件對縮酮產(chǎn)物a收率的影響
縮酮反應的合成條件為:0.1 mol環(huán)己酮,0.1~0.2 mol甘油,反應時間為60~150 min,反應溫度為70~95℃,催化劑Hβ分子篩用量為0.1~0.3 g。
2.3.1 甘油用量的影響 甘油和環(huán)己酮之間的縮合反應是酮與醇發(fā)生的羰基加成反應,包括半縮酮的生成、加成后脫水和另一分子醇反應生成縮酮兩步過程,是一個逐級加成反應[7]。從化學平衡的角度考慮,增大環(huán)己酮或甘油的量都有利于提高環(huán)己酮的轉化率,但實驗表明環(huán)己酮與產(chǎn)物及帶水劑環(huán)己烷的互溶性較甘油好,且甘油較環(huán)己酮更廉價易得,為了使后處理操作簡便,減少產(chǎn)物分離難度,所以本實驗采用甘油稍過量。
在環(huán)己酮0.1 mol,催化劑0.2 g,環(huán)己烷10 mL,90℃回流反應150 min的條件下,考察甘油用量對環(huán)己酮甘油縮酮收率的影響,結果如圖3(a)所示。由圖可知,隨著甘油加入量的增加,縮酮產(chǎn)物a收率明顯增加,這主要是由于提高了甘油和環(huán)己酮分子碰撞的幾率。當甘油達到0.15 mol時,收率達到最大值,繼續(xù)增大甘油用量,縮酮產(chǎn)物a收率反而呈下降趨勢,這可能是由于過量的甘油對反應體系起到了稀釋的作用,而且過量的甘油可能會引起其他副反應。因此,在環(huán)己酮為0.1 mol的情況下,甘油的最佳用量為0.15 mol。
2.3.2 反應時間的影響 在環(huán)己酮0.1 mol,甘油0.15 mol,催化劑0.2 g,環(huán)己烷10 mL,90℃回流反應的條件下,考察反應時間對環(huán)己酮甘油縮酮收率的影響,結果如圖3(b)所示。由圖可知,隨著反應時間的增加,縮酮產(chǎn)物a收率迅速增加,當達到90 min時,收率達到最大。繼續(xù)延長反應時間,產(chǎn)物a收率反而下降,這是因為反應時間延長,導致副反應增多。因此,最佳的反應時間為90 min。
2.3.3 反應溫度的影響 反應溫度對縮酮反應有一定的影響,反應溫度過高,副反應越多,溫度過低,反應速率低且產(chǎn)物得率低。因此,合適的反應溫度對于提高環(huán)己酮甘油縮酮產(chǎn)物a的收率有顯著的作用。
在環(huán)己酮0.1 mol,甘油0.15 mol,催化劑0.2 g,環(huán)己烷10 mL,不同溫度回流反應90 min的條件下,考察反應溫度對環(huán)己酮甘油縮酮收率的影響,結果如圖3(c)所示。由圖可知,隨著反應溫度的不斷上升,縮酮產(chǎn)物a的收率也隨之增加,當溫度達到90℃時,產(chǎn)物a收率達到最大。繼續(xù)增加反應溫度,產(chǎn)物a收率反而下降。因此,最佳反應溫度為90℃。
2.3.4 催化劑用量的影響 在環(huán)己酮0.1 mol,甘油0.15 mol,環(huán)己烷10 mL,90℃回流反應90 min的條件下,考察催化劑用量對環(huán)己酮甘油縮酮收率的影響,結果如圖3(d)所示。由圖可知,隨著催化劑用量的增加,縮酮產(chǎn)物a收率明顯提高,這是因為適當?shù)脑黾哟呋瘎┯昧靠梢蕴峁└嗟幕钚灾行模欣诳s酮反應的進行。當催化劑質量為0.2 g時,產(chǎn)物a收率達到最大。繼續(xù)增加催化劑用量時,產(chǎn)物a收率反而降低,這是由于過多的Hβ分子篩會增加反應體系的酸度,從而引發(fā)一些副反應,影響產(chǎn)物a的收率。因此,在環(huán)己酮為0.1 mol的情況下,催化劑的最佳用量為0.2 g。
2.4 環(huán)己酮甘油縮酮反應條件的優(yōu)化
為了確定適宜的縮酮反應工藝條件,在單因素的基礎上,采用正交試驗方法對實驗條件進一步優(yōu)化。根據(jù)單因素試驗結果,影響縮酮產(chǎn)物a收率的主要因素為:甘油用量、反應時間、反應溫度、催化劑用量等4個主要因素,采用L9(34)正交試驗表,正交試驗設計及結果分析如表2所示。
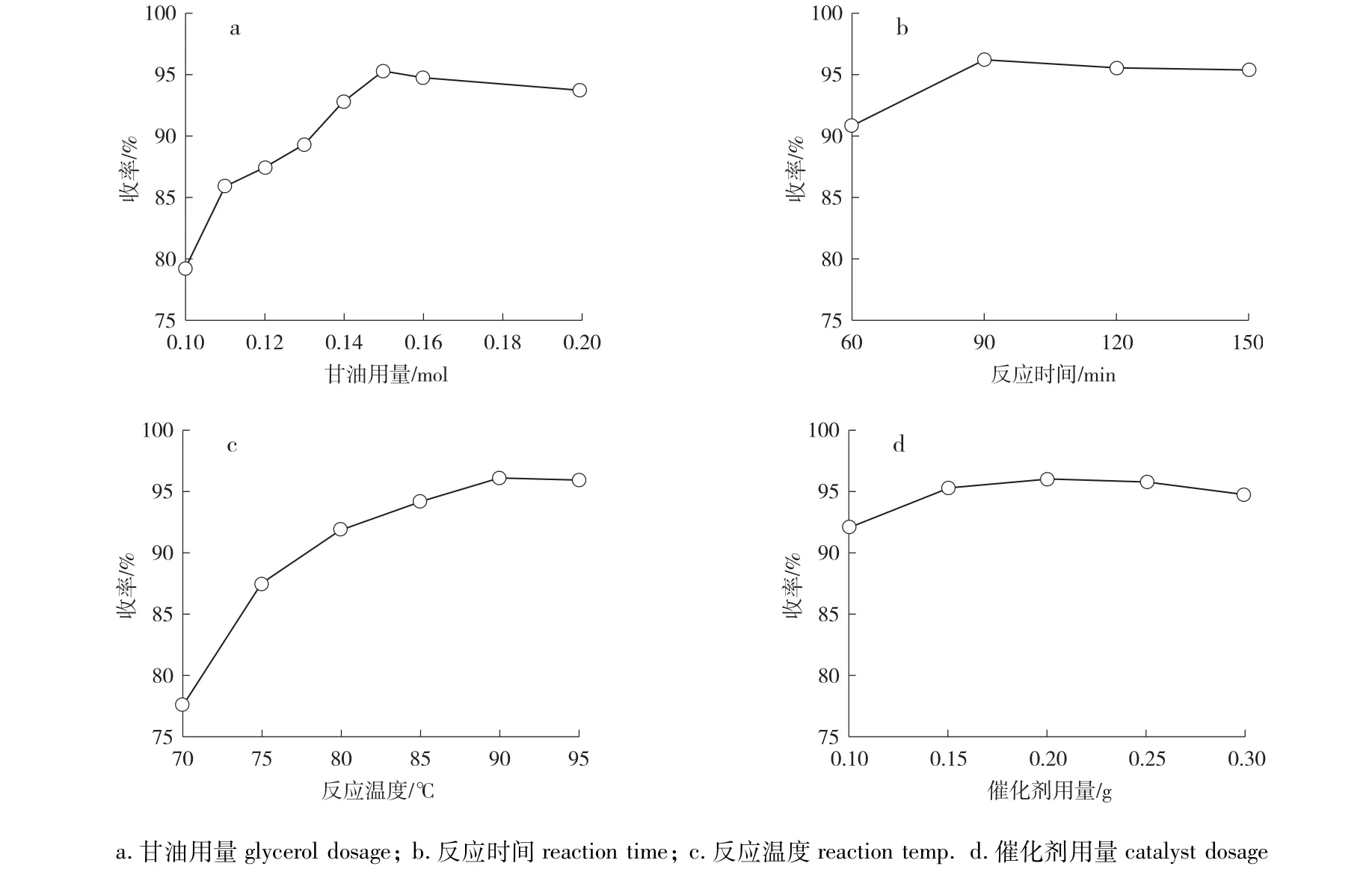
圖3 不同條件對環(huán)己酮甘油縮酮收率的影響Fig.3 Effect of different condition on yield of cyclohexanone glycerol ketal
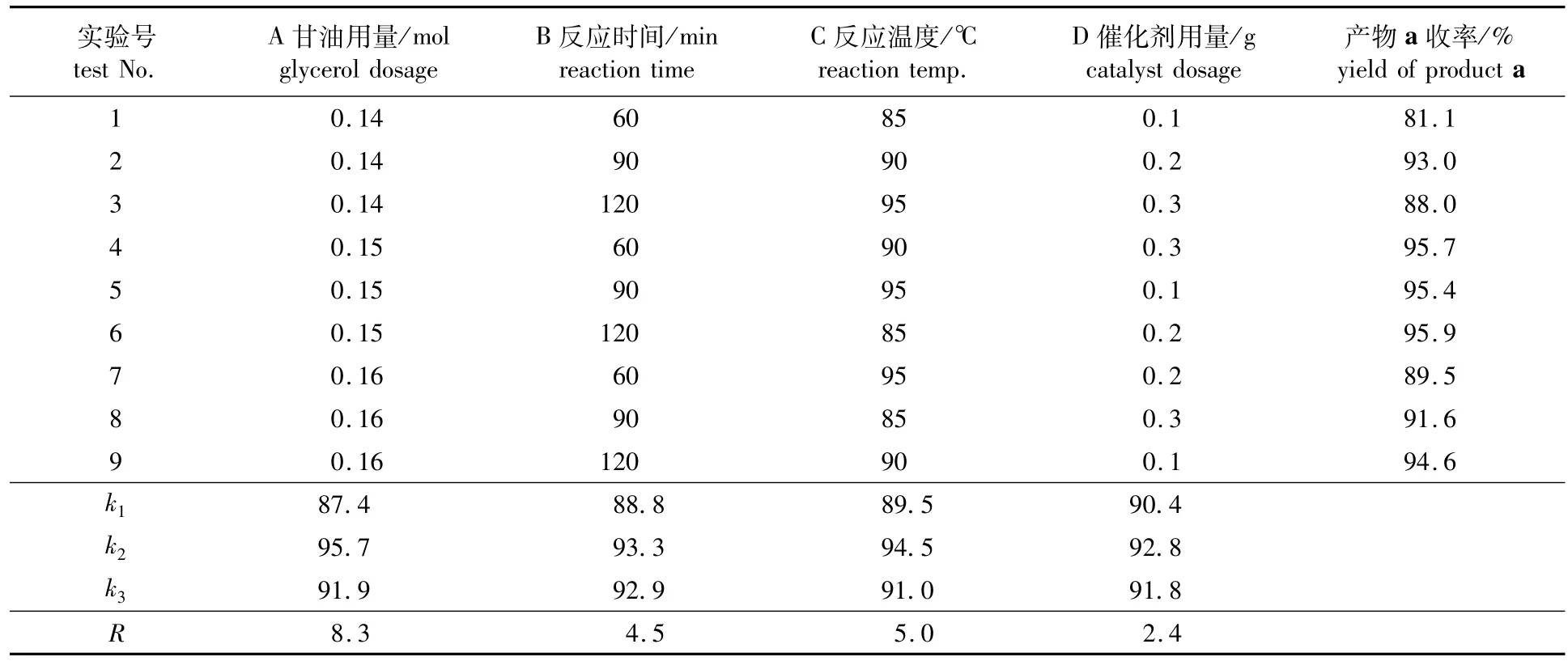
表2 正交試驗方案及結果分析Table 2 Orthogonal experiment conditions and analysis results
從正交試驗結果得出,各因素對縮酮產(chǎn)物a收率的影響順序為A>C>B>D,最優(yōu)工藝條件組合為A2B2C2D2,即0.1 mol環(huán)己酮,0.15 mol甘油,反應時間為90 min,反應溫度為90℃,催化劑用量為0.2 g。在最佳工藝條件下進行了3次穩(wěn)定性試驗,縮酮產(chǎn)物a收率分別為:96.4%、95.8%、96.3%,說明該縮酮反應條件穩(wěn)定,反應重現(xiàn)性好。
3 結論
3.1 采用單因素試驗和正交實驗相結合的方法,確定了2-羥甲基-l,4-二氧雜螺環(huán)[4,5]癸烷的適宜合成工藝條件為:0.1 mol環(huán)己酮,0.15 mol甘油,反應時間90 min,反應溫度90℃,催化劑Hβ分子篩的用量為0.2 g。在此條件下,該縮酮反應產(chǎn)物以2-羥甲基-l,4-二氧雜螺環(huán)[4,5]癸烷為主,選擇性達到95%以上。
3.2 采用IR、GC-MS等分析手段對合成產(chǎn)物的化學結構進行了分析鑒定,確定了產(chǎn)物結構和理論產(chǎn)物結構相一致。研究結果對后續(xù)實驗提供了理論幫助。
[1]高文藝,張曉麗,任立國.碳基固體酸催化合成環(huán)己酮甘油縮酮的研究[J].石油化工高等學校學報,2011,24(2):35-39.
[2]MOTA C J A,DA SILVA C X A,ROSENBACH N,JR.,et al.Glycerin derivatives as fuel additives:The addition of glycerol/acetone ketal(solketal)in gasolines[J].Energy Fuels,2010,24(4):2733-2736.
[3]SILVA P H R,GONALVES V L C,MOTA C J A.Glycerol acetals as anti-freezing additives for biodiesel[J].Bioresour Technol,2010,101(15):6225-6229.
[4]金養(yǎng)智.紫外光固化活性稀釋劑的進展[J].影像技術,2009,2:12-19.
[5]梁學正,高珊,于心玉,等.三氯化鋁催化合成甘油類縮醛(酮)的研究[J].精細與專用化學品,2006,14(12):15-17.
[6]梁學正,高珊,于心玉,等.FeCl3催化合成縮醛(酮)[J].化工進展,2006,25(6):684-686.
[7]尚倩倩,劉群,肖國民.固體超強酸/ZrO2催化合成環(huán)己酮甘油縮酮[J].東南大學學報:自然科學版,2011,41(1):140-144.
[8]楊水金,夏佳.固體超強酸催化合成丁醛1,2-丙二醇縮醛[J].林產(chǎn)化學與工業(yè),2006,26(1):132-134.
[9]李貴賢,王成君,周洋,等.改性二氧化硅固載磷鎢酸催化合成環(huán)己酮甘油縮酮[J].精細化工,2012,29(5):472-475.
[10]鮑少華,權南南,張敬,等.磺酸基功能化離子液體催化合成甘油縮環(huán)己酮的研究[J].應用化工,2009,28(1):1-4.
[11]梁學正,于心玉,彭惠琦,等.Hβ沸石催化合成縮醛(酮)[J].石油化工,2006,34(11):1083-1085.
[12]ULAHANNAN R T,PANICKER C Y,VARGHESE H T,et al.Spectroscopic(FT-IR,F(xiàn)T-Raman)investigations and quantum chemical calculations of 4-hydroxy-2-oxo-1,2-dihydroquinoline-7-carboxylic acid[J].Spectrochimica Acta(A):Molecular and Biomolecular Spectroscopy,2014,121:404-414.
[13]王玉民,趙振東,畢良武,等.新鈴蘭醛Vc縮醛的合成及其抗氧化性能的研究[J].林產(chǎn)化學與工業(yè),2009,29(3):13-17.
[14]DEUTSCH J,MARTIN A,LIESKE H.Investigations on heterogeneously catalysed condensations of glycerol to cyclic acetals[J].Journal of Catalysis,2007,245(2):428-435.
Synthesis and Process Optimization of Ketalization of Glycerol to Cyclohexanone Using Molecular Sieve Hβ as Catalysts
LU Yu-ji1,2,WANG Cheng-zhang2,GAO Qin-wei1,YE Jian-zhong2,TAO Ran2
(1.College of Chemical Engineering,Nanjing Forestry University,Nanjing 210037,China;2.Institute of Chemical Industry of Forest Products;Key and Open Lab.of Forest Chemical Engineering;Key Lab.of Biomass Energy and Material,Nanjing 210042,China)
Synthesis and process optimization of the ketalization of glycerol to cyclohexanone was investigated by using molecular sieve Hβ as catalysts.The structure of the product was identified by IR and GC-MS spectrum.Influence of reaction condition on the yield of the product was examined.The optimum synthesis conditions were determined based on the orthogonal test results as follows:amount of cyclohexanone was 0.1 mol,amount of glycerol was 0.15 mol,reaction time was 90 min,reaction temperature was 90℃,and amount of catalysts was 0.2 g.Three experiments were carried out under these conditions.A good stability was obtained.The yield of the product 2-methylol-1,4-dioxaspiro[4,5]decane could reach more than 95%.Reaction mechanism and selective of product were discussed.
cyclohexanone;glycerol;molecular sieve Hβ;ketalization;orthogonal test;mechanism
TQ35
A
1673-5854(2014)04-0007-06
10.3969/j.issn.1673-5854.2014.04.002
2014-04-25
國際合作與交流項目(S2012GR0138)
陸禹吉(1990—),男,江蘇大豐人,碩士生,從事生物高分子材料研究;E-mail:luyuji35@163.com
*通訊作者:王成章(1966—),男,研究員,博士生導師,從事天然產(chǎn)物研究與開發(fā);E-mail:wangczlhs@sina.com
高勤衛(wèi)(1968—),男,教授,博士生導師,從事生物高分子材料的研究;E-mail:gqw@njfu.com.cn。

