胰腺癌伴神經浸潤動物模型的建立
張曉蘭 邢鈴 張志鋼 楊鳴 吳紅玉 滿曉華 金晶 李兆申 金震東
神經浸潤(perineural invasion ,PNI)是胰腺癌的典型表現,其發(fā)生率為50%~100%。PNI亦是腫瘤細胞侵犯周圍神經及轉移擴散的途徑之一,疼痛的產生也與PNI密切相關。PNI的發(fā)生預示著胰腺癌的局部復發(fā)及胰腺癌患者較差的預后[1],但其發(fā)病機制目前仍未明確。由于缺乏有效的體內實驗模型,既往針對PNI發(fā)病機制的研究多局限于體外實驗。本研究建立有效的PNI體內模型,模擬腫瘤細胞浸潤神經時的體內微環(huán)境,為PNI發(fā)病機制的研究提供一定的實驗基礎。
材料與方法
一、細胞培養(yǎng)
人胰腺癌細胞株CAPAN-2、PANC1及SW1990均購自美國ATCC(American Type Culture Collection),按照ATCC推薦的培養(yǎng)條件培養(yǎng)、傳代,取對數生長期細胞,收集于1.5 ml EP管中備用。
二、實驗動物及分組
4~5周齡BALB/c裸小鼠32只,體質量18~22 g,購自上海中科院斯萊克動物中心,于第二軍醫(yī)大學動物實驗中心SPF級屏障系統(tǒng)飼養(yǎng)。飼養(yǎng)條件:室溫26~28℃,相對濕度40%~60%,動物飼養(yǎng)箱置于層流架中,飲用水、飼料及墊料均經嚴格消毒,定期更換,專人管理。入室適應性喂養(yǎng)1周后開始實驗。按完全隨機法分為4組,其中3組分別接種CAPAN-2、PANC1、SW1990細胞,不做任何處理的裸鼠為對照組,每組8只。
三、造模方法
BALB/c裸小鼠稱重后用1%戊巴比妥按照40 mg/kg體質量劑量腹腔注射麻醉。待麻醉完全后,消毒裸鼠右下肢,在其股骨頭下約1~2 mm處沿股骨干走行方向切一3~4 mm的小切口,鈍性沿肌肉走行輕輕剝離肌肉,找尋并暴露坐骨神經,在坐骨神經周圍分別注射約106個胰腺癌細胞(圖1),縫合切口。術后自由進食、水。動態(tài)觀察成瘤情況、成瘤時間。待瘤塊長至最長徑約0.8 cm時,給予1%戊巴比妥鈉麻醉裸鼠,沿股骨干剝離、切下腫瘤。給予冰PBS沖洗后將取下的腫瘤組織一分為二,一部分置-80℃冰箱凍存?zhèn)溆茫硪徊糠种糜?%多聚甲醛中固定48 h后常規(guī)行石蠟包埋、切片、HE染色,光鏡下觀察。
四、統(tǒng)計學處理
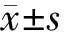

圖1 暴露的坐骨神經(a)及注射胰腺癌細胞的裸鼠(b)
結 果
一、一般狀況
對照組裸鼠體質量增加,各癌細胞注射組裸鼠成瘤后體質量明顯下降(表1),活動度下降,甚至呈現惡液質,且成瘤側肢體活動受限,跛行(圖2)。
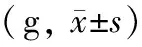
表1 各組裸鼠的體質量變化
注:與對照組比較,F=434.41,aP<0.01;與成瘤前比較,t值分別為7.719、6.481、5.640,bP<0.01
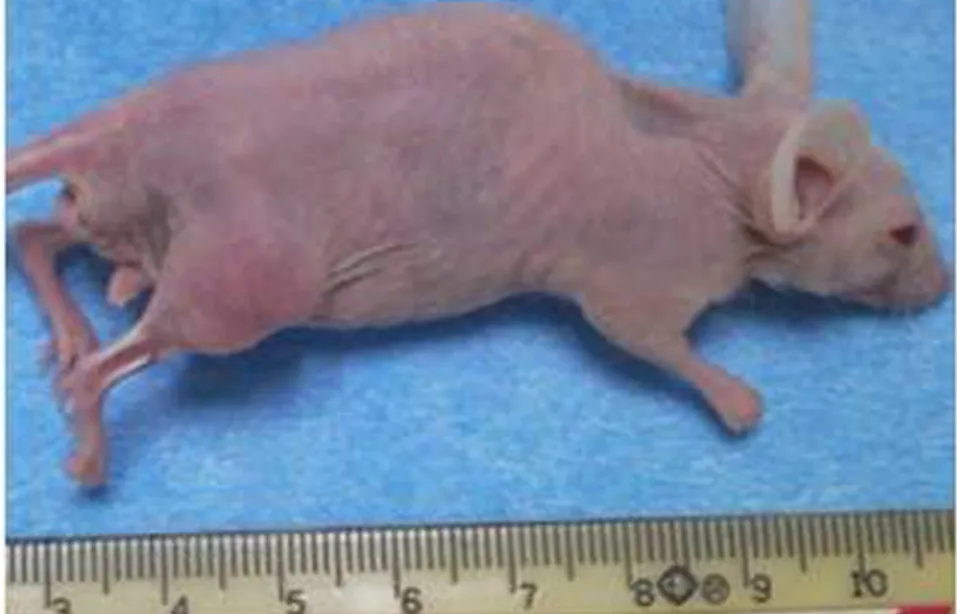
圖2 成瘤側肢體活動受限的裸鼠
二、成瘤情況及平均成瘤時間
CAPAN-2注射組及SW1990注射組的8只裸鼠最終均成瘤,PANC1注射組只有5只成瘤。
以腫瘤最長徑長至約0.8 cm為時間截點,CAPAN-2注射組、PANC1注射組、SW1990注射組裸鼠的成瘤時間分別為(49.8±5.0)、(56.6±2.4)、(25.4±3.0)d。SW1990注射組3~4周成瘤,PANC1注射組8周左右成瘤,CAPAN-2注射組7~8周成瘤,3組成瘤時間的差異具有統(tǒng)計學意義(F=73.51,P<0.01)。
三、PNI造模成功率
待最終成瘤時,見腫瘤與表皮有部分粘連,但均可順利分離。剝離表皮后暴露腫瘤,見大部分腫瘤呈類球狀,部分呈不規(guī)則形狀,包繞股骨干,侵及肌肉。部分腫瘤包繞坐骨神經(圖3a),部分腫瘤位于坐骨神經旁。光鏡下見癌細胞包繞神經生長,侵犯神經束膜(3b)。CAPAN-2注射組、PANC1注射組、SW1990注射組裸鼠造模成功率分別為87.5%(7/8)、20.0%(1/5)、50.0%(4/8)。
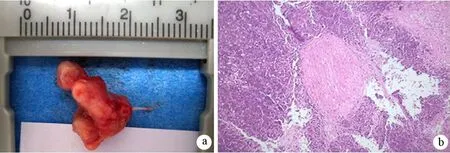
圖3 腫瘤包繞神經生長(a),侵及神經束膜(b,HE ×100)
討 論
Batsakis[2]廣義的PNI定義為癌細胞侵及神經內、神經周圍或穿過神經。有人認為PNI專指癌細胞能在神經束膜內觀察到,但這一觀點過于嚴格。大部分PNI是腫瘤與神經在神經束膜內接觸,但在鞘膜內并未發(fā)現腫瘤細胞。因此,不同作者定義的腫瘤與神經接觸的標準是不一樣的。腫瘤生長方式的描述亦包括全部包繞、部分包繞、同心型板層結構及切面的接觸等,因而PNI的定義也不一致。大部分作者建議,腫瘤細胞環(huán)繞神經周圍至少33%以上才能稱之為PNI。但起初描述癌細胞的PNI為癌細胞沿著腫瘤周圍神經纖維的旁側生長[3]。Leibig等[4]定義PNI為癌細胞在神經內、圍繞或穿過神經,腫瘤密切接觸神經并至少環(huán)繞神經外周的33%,或神經細胞侵及神經鞘3層結構的任何一層。本研究以Leibig的PNI定義作為判斷標準。
目前國內外針對胰腺癌PNI的研究大多應用體外實驗模型。本實驗室既往曾應用BD Matrigel基質膠內小鼠背根神經節(jié)與人胰腺癌細胞株三維共培養(yǎng)的模式成功建立PNI的體外模型,可見神經突觸與癌細胞間有相向生長的趨勢[5]。但體外實驗具有一定的局限性,不能完全模擬體內腫瘤細胞遷徙、轉移的微環(huán)境。國外有少部分PNI體內模型建立的方法,如Gil等[6]采用微量注射器顯微注射癌細胞于裸鼠坐骨神經建立PNI模型,用于觀察癌細胞的浸潤對神經功能的影響。但該方法需用微量注射器及顯微注射技術,操作復雜且費用昂貴。因此,建立一種簡單易行、復制率高的體內動物模型勢在必行。
根據以往體外實驗結果及相關文獻報道,人胰腺癌細胞株CAPAN-2具有較高的神經侵犯特性,PANC1具有較低的神經侵犯特性。因此,本研究選擇不同人胰腺癌細胞株進行裸鼠坐骨神經周圍注射的方法建立PNI體內模型。結果顯示, SW1990細胞擴增速度快,成瘤成功率高,時間短,但PNI發(fā)生率不高;CAPAN-2細胞擴增速度較慢,成瘤時間相對長,但PNI發(fā)生率最高;PANC1細胞擴增速度慢,成瘤時間最長,PNI發(fā)生率最低。本研究結果提示細胞株的選擇對于胰腺癌PNI動物模型造模成功有重要的影響。
本研究建立的體內造模方法簡單、易行,但存在一定的創(chuàng)傷性,且因存在切口,如縫合不好可出現注射的細胞外滲,從而導致成瘤率下降,甚至不成瘤。另外,分離坐骨神經時如將神經周圍肌肉剝離暴露過多也可造成注入的癌細胞沿組織間隙擴散,不能很好地聚集在坐骨神經周圍,從而導致成瘤率及PNI發(fā)生率的下降。
參 考 文 獻
[1] Bapat AA, Hostetter G, Von Hoff DD, et al. Perineural invasion and associated pain in pancreatic cancer[J]. Nat Rev Cancer, 2011,11(10):695-707.
[2] Batsakis JG. Nerves and neurotropic carcinomas[J]. Ann Otol Rhinol Laryngol, 1984,94(4 Pt 1):426-427.
[3] Demir IE, Ceyhan GO, Liebl F, et al. Neural invasion in pancreatic cancer: the past, present and future[J]. Cancers(Basel), 2010,2(3):1513-1527.
[4] Liebig C, Ayala G, Wilks JA, et al. Perineural invasion in cancer: a review of the literature[J]. Cancer, 2009,115(15):3379-3391.
[5] 安薇, 李平, 李桂香, 等. 胰腺癌神經浸潤體外模型的構建與觀察[J]. 中華胰腺病雜志, 2012,12(3):160-163.
[6] Gil Z, Cavel O, Kelly K, et al. Paracrine regulation of pancreatic cancer cell invasion by peripheral nerves[J]. J Natl Cancer Inst, 2010,102(2):107-118.

