羅氏HIV-1定量檢測引物SK145和SKCC1B的評估及優化
樊路娟,張春霞,徐慶剛,張馳宇
(1.江蘇大學生命科學研究院,江蘇鎮江212013;2.中國科學院上海巴斯德研究所,上海200025)
羅氏HIV-1定量檢測引物SK145和SKCC1B的評估及優化
樊路娟1,2,張春霞1,徐慶剛1,張馳宇1,2
(1.江蘇大學生命科學研究院,江蘇鎮江212013;2.中國科學院上海巴斯德研究所,上海200025)
目的:評估羅氏HIV-1檢測系統中引物SK145和SKCC1B對不同亞型HIV-1病毒定量檢測的廣譜性及準確性,并在此基礎上對該引物進行優化。方法:下載并分析5個主要HIV-1流行亞型(B、C、A、01_AE、D)在引物SK145和SKCC1B擴增區段的對應序列,從各亞型篩選出所占比例最高的5條序列構建定量標準品。用梯度稀釋的HIV-1各亞型標準品來評估引物SK145和SKCC1B的擴增效率。為改善引物SK145和SKCC1B對HIV-1不同亞型擴增的準確性和廣譜性,我們重新設計了一對簡并引物并分析其對不同亞型病毒的擴增效果。結果:引物SK145、SKCC1B對于B亞型病毒的擴增效果最好,而對非B亞型病毒的擴增效果并不理想,簡并引物能顯著改善對各亞型HIV-1病毒擴增的效果。結論:羅氏引物SK145和SKCC1B不適用于非B亞型HIV-1病毒載量的定量檢測,而優化設計的簡并引物能改善對各亞型HIV-1病毒的擴增效率,因而可用于中國等HIV-1多亞型共流行國家的HIV-1病毒載量檢測。
人類免疫缺陷病毒1型;實時熒光定量PCR;SK145;SKCC1B
人類免疫缺陷病毒1型(human immunodeficiency virus type 1,HIV-1)是導致全球艾滋病(acquired immunodeficiency syndrome,AIDS)流行的主要病原體。HIV-1的遺傳異質性是影響病毒載量定量可靠性的一個重要因素,而所有的核酸擴增或信號擴增技術都依賴于HIV-1序列特異性的引物和(或)探針,引物(探針)結合區的核苷酸不匹配會干擾雜交從而影響定量結果的可靠性。
羅氏分子系統(Roche Molecular Systems)的HIV-1病毒載量檢測技術中,AMPLICOR?HIV-1 MONITOR Test version 1.5和COBAS?AMPLICOR HIV-1 MONITOR Test version 1.5都獲得美國食品和藥物管理局(Food and Drug Administration,FDA)認證,是臨床監控正在進行抗病毒治療HIV-1患者病毒載量的金標準[1-2]。這兩種檢測方法使用相同的引物SK145、SKCC1B,得到155 bp的擴增產物。
本實驗目的在于評估引物SK145、SKCC1B對高度變異型病毒HIV-1定量檢測的廣譜性及準確性,并且在此基礎上設計了一對廣譜性更高、特異性更強的簡并引物de-F、de-R。
1 材料與方法
1.1 材料
1.1.1 細胞和載體 JM109感受態細胞、pGH載體(上海捷瑞生物工程有限公司)。
1.1.2 主要試劑盒及試劑 柱式質粒DNAout(北京天恩澤基因科技有限公司);ScaⅠ購自寶生物工程(大連)有限公司;DNA片段純化試劑盒(TaKaRa公司);快捷型瓊脂糖凝膠DNA回收試劑盒(離心柱型)Ⅱ型(北京百泰克生物技術有限公司);實時PCR試劑盒SYBR?Premix Ex TaqTMⅡ(Tli RNaseH Plus)購自寶生物工程(大連)有限公司。
1.1.3 主要儀器 One DropTMOD-1000分光光度計(南京五義科技有限公司)、Mx3000P/3005P實時熒光定量PCR儀(美國安捷倫公司)。
1.2 方法
1.2.1 序列篩選與合成 根據HIV數據庫(http:/www.hiv.lanl.gov/components/sequence/HIV/geo/geo.comp)中全球HIV-1序列分布情況,選取所占比例最高的5個亞型:B(58.2%),C(15.1%),A(7.5%),01_AE(4.7%),D(3.7%)。這5個亞型的病毒占感染樣本總比例的89.2%,可用來全面準確地評估引物SK145、SKCC1B對不同亞型HIV-1病毒的擴增效率。由于引物SK145(1359→1388)、SKCC1B(1513→1486)的擴增產物位于HIV-1基因組1359→1513區段,因此本實驗從HIV數據庫中下載這5個亞型病毒在HIV基因組1359→1513區段的所有序列,用MEGA5處理并經DAMBE比對后從各亞型分別篩選出占比例最高的5條序列,并統計數據。用MEGA5處理上述25條序列并刪除上下游引物間區域(1389→1485)只保留上下游引物對應區序列,用DAMBE繼續比對后得到15條獨特序列。找到這15條序列所對應原始序列并在1359→1513區段前后各延伸5 bp得到長165 bp(1354→1518)的15條序列:A1,A3,A5,B1,B2,B4,C2,C4,D1,D3,D4,01_AE1,01_AE2,01_AE4,01_AE5。由上海捷瑞生物工程有限公司合成這15條序列并克隆到pGH載體。
1.2.2 簡并引物設計和合成 處理并統計上述各亞型毒株在引物SK145、SKCC1B擴增區段(1359→1513)所占比例最高的5條序列(5個亞型×5條),分別只保留上游和下游引物對應區序列,比對所得的25條上游(1359→1388)和下游(1513→1486)引物區對應序列,并統計各一致序列條數,根據上下游引物區序列比對結果并充分考慮GC含量、3′末端序列等因素后設計出上下游簡并引物:de-F(AGTGGGGGGACAYCARGCAGC)、de-R(TACTAGTAGTTCCTGCTATRTCACTTCC),并由上海生工公司合成。
1.2.3 制備重組質粒 將克隆到pGH載體的重組質粒轉化到JM109感受態細胞,挑單菌落擴大培養后用菌液PCR篩選陽性克隆,按照柱式質粒DNAout試劑盒的操作說明提取質粒。
1.2.4 Sca I酶切質粒 pGH載體上有一個ScaⅠ酶切位點,可使環狀質粒變為線性質粒。酶切體系:ScaⅠ2.5μL,10×H緩沖液5μL,質粒DNA≤2.5μg,加滅菌水補足50μL總體系,37℃酶切4 h后,取4μL酶切反應液電泳觀察其條帶,判斷酶切是否完全。
1.2.5 純化線性質粒 將所得線性質粒的酶切反應液按快捷型瓊脂糖凝膠DNA回收試劑盒(離心柱型)Ⅱ型操作說明進行純化。
1.2.6 制備15個亞型線性質粒儲存液 用超微量紫外分光光度計測純化后線性質粒的純度和濃度,純度要求D(260 nm)/D(280 nm)的值介于1.8~2.0,質粒拷貝數(拷貝/mL)=D(260 nm)× 50μg/mL×10-6×6.02×1023/[650(dolton/bp)×堿基對數目],計算得到質粒濃度。用pH 8.0的1× TE將各亞型線性質粒濃度調整到109拷貝/mL,每管100μL分裝多管,-20℃儲存備用。
1.2.7 評估引物SK145、SKCC1B對15個亞型線性質粒的擴增效率 用pH 8.0的1×TE對15個亞型線性質粒的儲存液(每次定量時各取出一管冰上融化)進行10倍梯度連續稀釋,選取1×108拷貝/mL、1×107拷貝/mL這兩個梯度的稀釋液為模板,SK145、SKCC1B為上下游引物,B1亞型線性質粒109~105copies/mL的稀釋液為標準品,進行SYBR Green熒光定量,各亞型各濃度梯度重復定量3次。冰上配置PCR體系(20μL):SYBR?Premix Ex TaqTMⅡ10.0μL,SK145(10μmol/L)0.8μL,SKCC1B(10 μmol/L)0.8μL,ROX參比染料0.4μL,質粒模板2.0μL,滅菌蒸餾水6.0μL。PCR反應程序:預變性95℃30 s;兩步法擴增95℃5 s,60℃34 s,循環40次;熔解曲線95℃15 s,60℃1 min,每30 s升溫0.5℃,循環71次后達95℃,95℃15 s。反應結束后系統自動生成標準曲線和熔解曲線,并給出各亞型線性質粒的拷貝數(即實驗值)。計算熒光定量實驗值/理論值的百分比,并匯總分析。
1.2.8 評估簡并引物de-F、de-R對15個亞型線性質粒的擴增效率 以de-F、de-R為上下游引物,采用SYBR Green熒光定量(方法同1.2.7)對15個亞型線性質粒的擴增效率進行評估。
2 結果
2.1 線性質粒的電泳結果
將各亞型的重組質粒單酶切并純化后得線性質粒,電泳后得到3 082 bp的條帶(圖1),和預期產物結果一致。
圖1 線性質粒和環狀質粒
2.2 B1亞型線性質粒標準品的擴增曲線、標準曲線和熔解曲線結果
將梯度稀釋的B1亞型線性質粒標準品(109~105拷貝/mL),用熒光定量PCR重復測定3次,每次每個稀釋度重復3管,熒光定量PCR結束后系統會自動生成擴增曲線、標準曲線和熔解曲線,見圖2。如圖所示各梯度擴增曲線間隔分布均勻,且標準曲線的相關系數R2=0.997,說明線性質粒在此稀釋范圍內有良好的線性關系。回歸方程:Y=-3.490× Log(X)+39.25,擴增效率為93.4%,說明反應體系及反應條件適宜且擴增效率較高。熔解曲線結果為單峰,產物T m值(熔解溫度)一致(均為85℃),說明引物特異性強,無非特異性擴增。
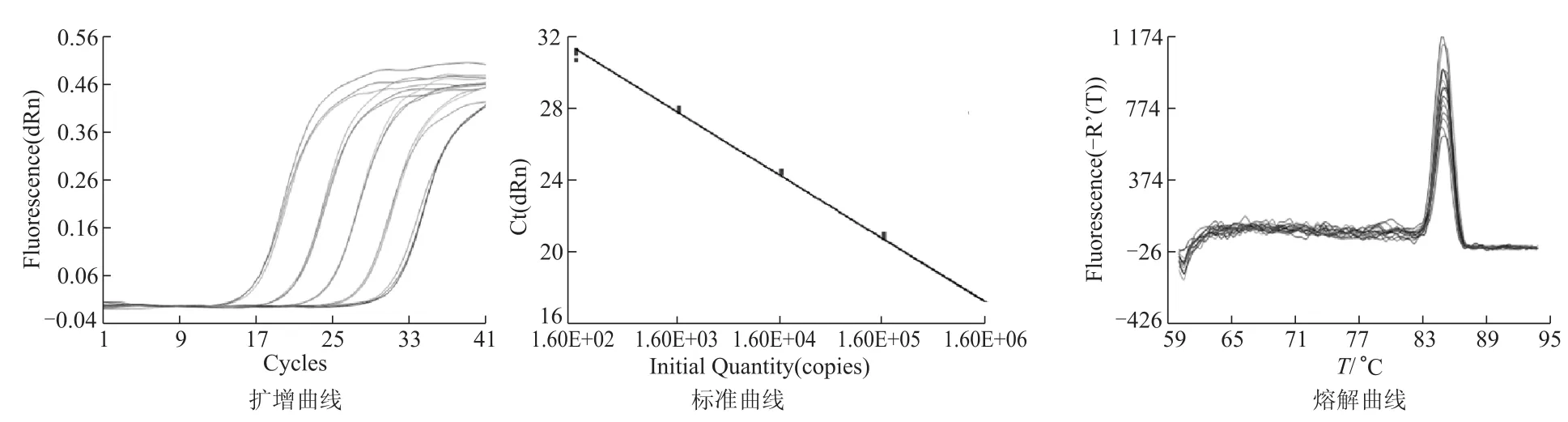
圖2 擴增曲線、標準曲線和熔解曲線
2.3 簡并引物設計
各亞型毒株分別在引物SK145(1359→1388)、SKCC1B(1359→1513)對應區域所占比例最高的5條序列(5個亞型×5條),匯總結果如圖3所示。分別比對這25條上游和下游引物對應區序列,并統計各一致序列條數,結果見圖3。
在充分考慮上述5種流行亞型序列特征的基礎上設計簡并引物,其序列如下:de-F:AGTGGGGGGACAYCARGCAGC,de-R:TACTAGTAGTTCCTGCTATRTCACTTCC。
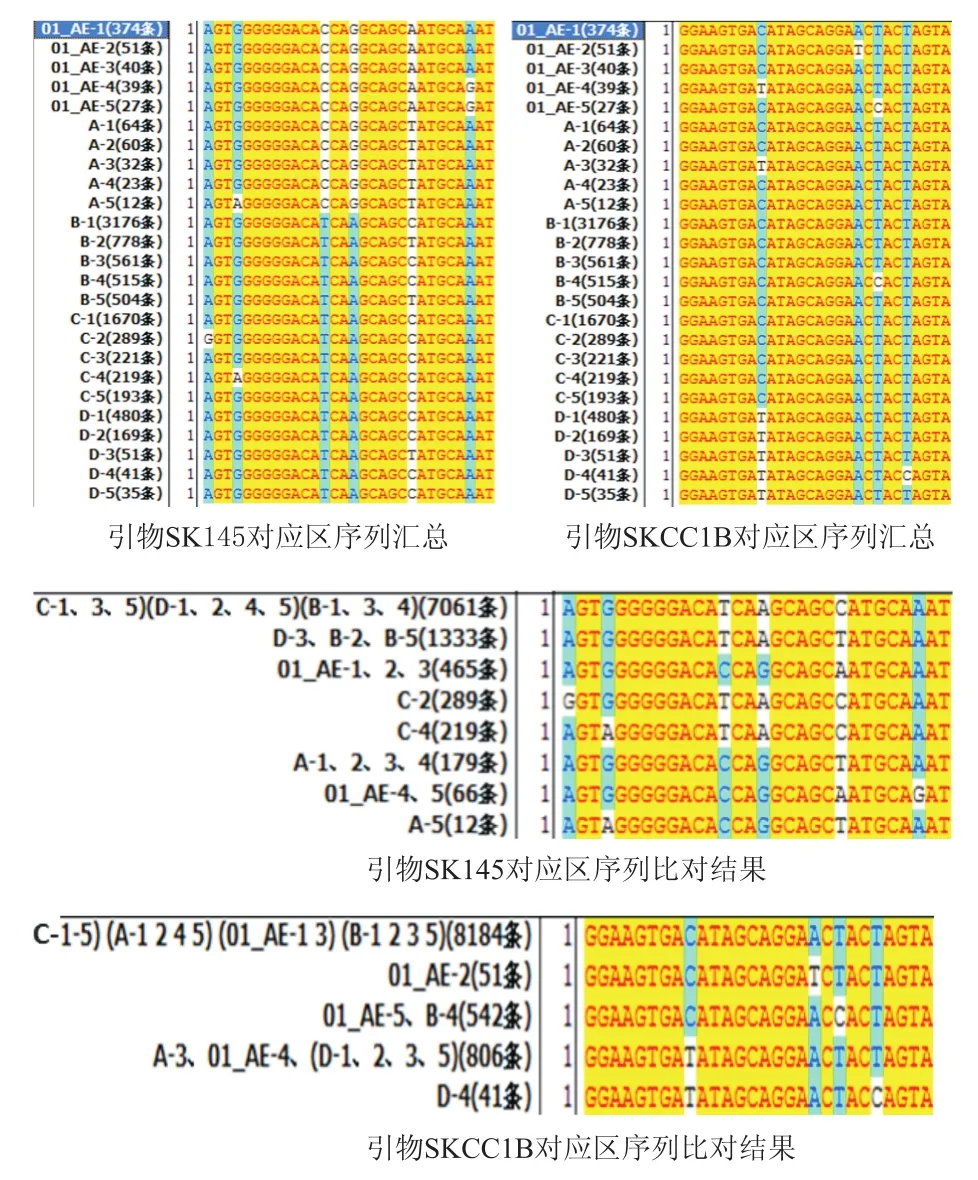
圖3 引物SK145、SKCC1B對應區序列比對及簡并引物設計
2.4 各引物對15個亞型基因片段定量的可靠性比較
分別以SK145、SKCC1B和簡并引物de-F、de-R為上下游引物,對15個亞型基因片段的標準品(1×108拷貝/mL、1×107拷貝/mL)進行SYBR Green實時定量,計算所得實驗值/理論值,各亞型各濃度分別重復定量3次,將實驗值/理論值的數據匯總并計算平均值與標準差(圖5),結果顯示引物SK145、SKCC1B對于B亞型的擴增最為有效,而對其他亞型的擴增效果則不太理想(對A、C、D、01_AE亞型病毒的擴增效率分別為25.3%、44.39%、42.43%、35.9%),這可能造成在對非B亞型HIV-1病毒定量時低估其病毒載量。使用簡并引物de-F、de-R后,除少部分D亞型和01_AE亞型的線性質粒外,其余大部分亞型的線性質粒擴增效果都有顯著改善(對A、C、D、01_AE這4個亞型病毒的擴增效率分別提高到31.58%、58.41%、47.82%、43.12%),說明所設計的簡并引物對各亞型HIV-1病毒的擴增效果比引物SK145、SKCC1B更好,用于病毒載量測定也會使定量結果更加準確可靠。
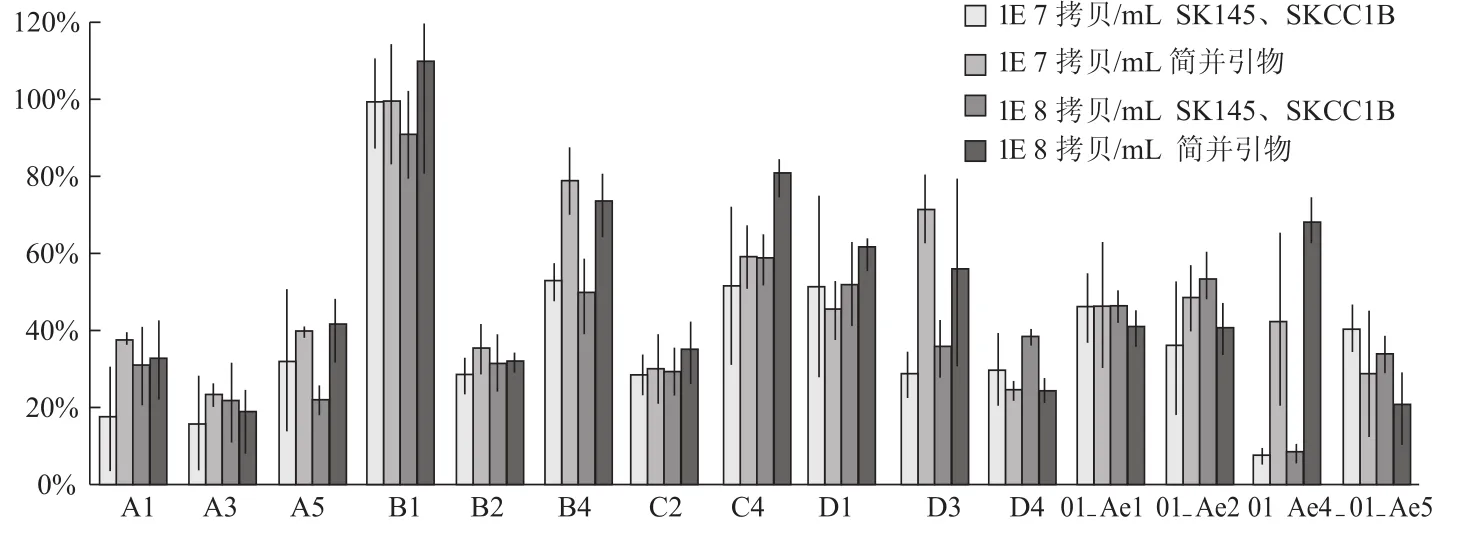
圖5 兩對引物對15個亞型基因片段擴增效果的比較
3 討論
血漿病毒載量對于疾病惡化的預測以及治療藥物和疫苗潛能的評估至關重要,并且血漿中HIV RNA的定量已經成為HIV-1感染者預后以及監控抗病毒治療效果的主要工具[3-4],也是治療方案的一大重要組成部分[5]。HIV-1亞型間的遺傳變異以及同一HIV亞型內的極端變異顯著影響了臨床樣本中病毒RNA的檢測和定量能力,而HIV-1血漿病毒血癥無論是假陰性還是過低定量甚至是過高定量都可能對患者的治療產生嚴重影響。目前現有的HIV-1病毒載量檢測技術能夠對HIV-1病毒載量進行較好的定量,羅氏分子系統的AMPLICOR?HIV-1 MONITOR Test version 1.5和COBAS?AMPLICOR HIV-1 MONITOR Test version 1.5更成為定量的金標準。
比較對這兩種診斷方法進行評估的國內外研究結果,發現他們大多采用對一定數量臨床樣品進行定量,然后比較這兩種方法所得定量結果與其他商業化檢測方法定量結果之間的一致性和相關性的策略。該評估策略不夠系統和全面,其缺陷主要有兩個方面,首先所用臨床樣品不能涵蓋大多數流行亞型,且樣品量不夠豐富;其次,雖與其他檢測方法進行了比較,但是并沒有與樣品中真正所含病毒載量進行比較,因而無法判斷其定量結果的準確可靠性。
為解決上述問題,本實驗精心設計實驗方案并全面搜集數據,對AMPLICOR?HIV-1 MONITOR Test version 1.5和COBAS?AMPLICOR HIV-1 MONITOR Test version 1.5中所使用的引物SK145、SKCC1B進行了全面而系統的評估,結果發現該對引物對B亞型病毒的擴增最為有效,而對其他亞型病毒的擴增效果并不理想,尤其是對A亞型病毒的定量結果顯著偏低。為改善引物的擴增效果,我們在原引物的基礎上設計了一對簡并引物de-F、de-R。使用簡并引物后,除少部分D亞型和01_AE亞型的質粒標準品外,其余大部分亞型的擴增效果都有顯著改善。
由于羅氏HIV-1檢測系統中的引物SK145和SKCC1B只對B亞型毒株有良好的擴增效果,因而適用于北美洲(B亞型流行比例為98.0%)、中美洲(B亞型流行比例為99.6%)等B亞型毒株盛行區域的HIV-1病毒載量檢測,但是對于中國(B亞型31.3%、07_BC占28.3%、01_AE占23.5%)等HIV-1多亞型共流行國家的HIV-1病毒載量檢測則不夠適用。我們優化設計的簡并引物對各亞型毒株的擴增效率都有顯著改善,可用于中國等HIV-1多亞型共流行國家的HIV-1病毒載量的檢測。然而由于HIV-1病毒的高度變異性,我們所設計的簡并引物并不能改善所有亞型的擴增效率,還需要繼續尋找更加保守的區段、采用更為縝密的方法來設計更為理想的引物與探針,以進一步改善HIV-1定量檢測方法的準確度和廣譜性。
[1]Cobb BR,Vaks JE,Do T,etal.Evolution in the sensitivity of quantitative HIV-1 viral load tests[J].JClin Virol,2011,52(Suppl 1):S77-S82.
[2]Palmer S,Wiegand AP,Maldarelli F,et al.New realtime reverse transcriptase-initiated PCR assay with single-copy sensitivity for human immunodeficiency virus type 1 RNA in plasma[J].JClin Microbiol,2003,41(10):4531-4536.
[3]Triques K,Coste J,Perret JL,etal.Efficiencies of four versions of the AMPLICOR HIV-1 MONITOR test for quantification of different subtypes of human immunodeficiency virus type 1[J].JClin Microbiol,1999,37(1):110-116.
[4]Luft LM,Gill MJ,Church DL.HIV-1 viral diversity and its implications for viral load testing:review of current platforms[J].Int J Infect Dis,2011,15(10):e661-e670.
[5]Skidmore SJ,Zuckerman M,Parry JV.Accuracy of plasma HIV RNA quantification:a multicentre study of variability[J].JMed Virol,2000,61(4):417-422.
Assessment and optim ization of Roche SK 145 and SKCC1B primers for quantification of human immunodeficiency virus type 1
FAN Lu-juan1,2,ZHANG Chun-xia1,XU Qing-gang1,ZHANG Chi-yu1,2
(1.Institute of Life Sciences,Jiangsu University,Zhenjiang Jiangsu 212013;2.Institute Pasteur of Shanghai,Chinese Academy of Sciences,Shanghai200025,China)
Objective:To assess and optimise applicability and accuracy of primers SK145 and SKCC1B for different HIV-1 subtypes in viral load quantification assay.M ethods:We downloaded and analyzed genomic sequences of fivemain HIV-1 subtypes(B,C,A,01_AE,D)with the primers SK145 and SKCC1B target.The top five dominant sequenceswere selected from each subtype sequences for the construction of quantification standards.We evaluated amplification efficiency of primers SK145 and SKCC1B for serially diluted standards of each HIV-1 subtype.To improve the amplified spectrum primers SK145 and SKCC1B for different HIV-1subtypes,re-designed this primer pair into degenerate primers according to the top dominant sequences of different HIV-1 subtypes.Results:The amplification efficiency of primers SK145 and SKCC1B was best on quantification HIV-1 subtype B,but not ideal for the non-B subtypes,indicating that primers SK145 and SKCC1B were not able to quantify accurately the viral load of non-B HIV-1 subtypes.When the degenerate primerswere used,we obtained relatively consistent amplification efficiency for various HIV-1 subtypes.Conclusion:Roche SK145 and SKCC1B primerswere unsuitable for viral RNA quantification of HIV-1 non-B subtypes.Compared to Roche SK145 and SKCC1B primers,the optimized degenerate primers can efficiently amplify various HIV-1 subtypes,suggesting that they can be used for HIV-1 viral load assay in China and other countrieswhere various HIV-1 subtypes are co-criculating.
human immunodeficiency virus type 1;real-time PCR;SK145;SKCC1B
樊路娟(1988—),女,碩士研究生;張馳宇(通訊作者),研究員,博士,E-mail:zhangcy1999@ips.ac.cn
R512.91
A
1671-7783(2014)01-0026-05
10.13312/j.issn.1671-7783.y130207
國家自然科學基金資助項目(81071391)
2013-09-16 [編輯]何承志

