吲哚胺2,3-雙加氧酶(IDO)的色胺酮類抑制劑篩選及其體外抗腫瘤作用
楊雙雙杜麗莎李豪男楊 青△
(1復旦大學生命科學學院生化系 上海 200433;2金日成綜合大學生命科學系 平壤)
吲哚胺2,3-雙加氧酶(IDO)的色胺酮類抑制劑篩選及其體外抗腫瘤作用
楊雙雙1杜麗莎1李豪男2楊 青1△
(1復旦大學生命科學學院生化系 上海 200433;2金日成綜合大學生命科學系 平壤)
目的評價色胺酮衍生物吲哚胺2,3-雙加氧酶 (indoleamine 2,3-dioxygenase,IDO)的抑制活性,并研究其作為IDO抑制劑的抗腫瘤作用。方法采用基因工程手段表達、純化重組人IDO(rhIDO),建立IDO活性檢測體系;以色胺酮衍生物作為對象,進行IDO抑制活性初篩,對抑制類型、半數抑制濃度以及抑制常數進行測定;構建高表達人IDO的pcDNA3.1(+)-hIDO轉染HEK 293細胞,評價色胺酮衍生物在細胞水平上的IDO抑制活性;采用MTT比色法考察色胺酮衍生物3對人非小細胞肺癌A549細胞的生長抑制作用。結果6個被測色胺酮衍生物均具有IDO抑制活性,且細胞水平上的抑制效力高于酶活水平,抑制效力均優于目前通用的IDO抑制劑1-甲基色氨酸(1-methyl-tryptophan,1-MT)。色胺酮衍生物3作為最強的IDO抑制劑,其Ki值為0.161μmol/L。MTT實驗結果顯示,色胺酮衍生物3顯著抑制 A549細胞生長,IC50為8.77μmol/L。結論色胺酮衍生物是一類新型高效的IDO抑制劑,在體外對A549細胞具有較強的抗腫瘤活性。
活性檢測; 色胺酮衍生物; 吲哚胺2,3-雙加氧酶 (IDO); 抗腫瘤作用
吲哚胺2,3-雙加氧酶(indoleamine 2,3-dioxygenase,IDO)是肝臟以外唯一催化色氨酸沿犬尿氨酸途徑(kynurenine pathway,KP)代謝的限速酶[1],已被證實與腫瘤、阿爾茨海默病、抑郁癥和老年性白內障等多種人類重大疾病密切相關。而IDO的表達或活性的異常增高,是導致上述疾病的一個重要因素[2],所以篩選高效的IDO抑制劑可以為這些疾病提供有效治療藥物。
自1967年IDO被發現以來,至今未被商品化,這給IDO活性檢測系統的建立帶來了困難,所以國內少有開展IDO抑制劑的化學合成與天然提取的相關工作。本研究采用基因工程手段獲得純化的rhIDO,以此建立了穩定的IDO生物活性檢測系統,利用該系統進行IDO抑制劑的篩選工作。盡管IDO抑制劑的研究在國外已經開展數十年,但是目前還沒有IDO抑制劑藥物問世。現有的IDO抑制劑普遍存在抑制效率低下、無法透過細胞膜以及產生吲哚環結構代謝物質等問題[3]。20世紀90年代發現的1-甲基色氨酸(1-methyl-tryptophan,1-MT)是目前體內外實驗中普遍使用的IDO抑制劑,其抑制常數(Ki)為34μmol/L[4]。
近年來,抑制IDO在腫瘤治療中的作用引起了眾多學者的關注[5-6]。研究證實IDO在多種實體腫瘤如肺癌、肝癌、乳腺癌、結腸癌等腫瘤組織中的表達明顯增強,且與預后密切相關[7]。Friberg等[8]研究發現1-MT體外能增強腫瘤細胞對T細胞免疫刺激的敏感性,體內在Lewis肺癌小鼠模型中能夠延緩腫瘤的生長。Muller等[9]發現在自發性乳腺癌 MMTVNeu小鼠模型中,1-MT與化療藥紫杉醇、順鉑、環磷酰胺和阿霉素合用,能引起腫瘤的消除。
因此,使用IDO抑制劑可能成為一種治療腫瘤的有效方法。本研究建立穩定的IDO活性檢測體系,篩選新型高效的IDO抑制劑,并進行IDO抑制劑抗腫瘤作用的初步研究。
材料和方法
藥品與試劑1-MT、L-犬尿氨酸、IPTG、MTT、DMSO (美國Sigma-Aldrich公司);L-色氨酸、亞甲基藍、過氧化氫酶、對二甲氨基苯甲醛(日本Wako公司);HEK 293 細胞(ATCC CRL-1573)、DMEM 培養基、opti-MEM 培養液、胎牛血清、Lipofectamin 2000、Hank's平衡鹽溶液(美國Gibco公司);大腸埃希菌BL21、Top10(博大泰克公司);Endofree Plasmid Kit(上海天根公司)。
儀器和設備電熱恒溫水浴鍋(上海精宏實驗設備有限公司),隔水式電熱恒溫培養箱(江蘇太倉實驗設備廠),SCS-24恒溫搖床(江蘇太倉實驗設備廠),722分光光度計(上海分析儀器總廠),倒置顯微鏡(CKX-41-32,日本 OLYMPUS公司),Forma series CO2培養箱、Multiskan MK3酶標儀(美國Thermo scientific公司),SW-CJ-1FD潔凈工作臺(蘇州安泰空氣技術有限公司)。
重組人IDO表達及純化經測序驗證的p ET28a-hIDO表達質粒轉化BL21感受態細胞,從轉化平板上隨機挑取單菌落于含50μg/m L卡那霉素的培養基中,37℃ 過夜培養;按1∶50將過夜培養物接種于含50μg/m L卡那霉素的LB中,當D600=0.6時加入血紅素生物合成中間體α-氨基乙酰丙酸(ALA)同時將溫度降至30℃,最后加IPTG至終濃度為0.5 mmol/L,30℃誘導表達6 h。3968×g離心10 min收集菌體;用適量PBS(含1 mmol/L PMSF)重懸菌體,超聲破碎;4℃下3968×g離心10 min,取上清。將上清注入預先用含10 mmol/L咪唑的磷酸鹽緩沖液(20 mmol/L,p H 7.4)平衡的Ni柱上,用含40 mmol/L咪唑的PBS洗去雜蛋白后,用含250 mmol/L咪唑的PBS洗脫下rhIDO,Sephadex G25柱脫鹽,得到純化的rhIDO蛋白質。
體外IDO活性檢測體系的建立IDO活性檢測體系在Littlejohn等[10]研究的基礎上進行優化。在500μL反應體系中,先將50 mmol/L磷酸鉀緩沖液(p H 6.5)、40 mmol/L抗壞血酸、200μg/m L過氧化氫酶、20μmol/L亞甲基藍、底物L-色氨酸和待測樣品混合,混合液37℃ 預熱5 min,再向上述混合液內加入0.05μmol/L rhIDO酶,37℃反應30 min,酶促反應后加入30%(W/V)三氯乙酸200 μL使終止反應,反應液在65℃加熱15 min,使之完成從N-甲酰犬尿氨酸到犬尿氨酸的轉化。然后13523×g離心10 min,取上清與等體積2% (W/V)對-二甲氨基苯甲醛的乙酸溶液混合,使用酶標儀在492 nm觀測犬尿氨酸與之反應產生的黃顏色。以1-MT作為陽性對照,驗證本實驗建立的IDO活性檢測體系是否有效。
抑制類型及Ki、IC50值測定利用上述反應體系,加入50μmol/L抑制劑和不同濃度的IDO酶,其他處理方法同上,最后以反應速度對酶濃度作圖,根據所得曲線的關系判斷抑制劑類型。抑制常數Ki及IC50值的測定同樣利用上述反應體系,加入不同濃度底物L-色氨酸,在一個底物濃度下,加入不同濃度的抑制劑,其他處理方法同上,最后以Dixon作圖法得到Ki值[11],利用改良寇氏法計算出IC50值。
細胞水平IDO抑制活性測定將 HEK 293細胞以2.5×104/孔的密度接種于96孔板中,DMEM培養基培養(含10% 胎牛血清、50 U/mL青霉素,50 mg/mL鏈霉素),置于37℃、濕度95%、5%CO2的培養箱中培養。24 h后使用脂質體Lipofectamin 2000介導pcDNA3.1(+)-hIDO質粒轉染。轉染24 h后加入待測藥物,孵育5 h后,取140μL上清到另一96孔板中,加入10μL 30%(W/V)三氯乙酸,65℃加熱15 min,13523×g離心10 min,取等體積2%(W/V)對-二甲氨基苯甲醛的乙酸溶液混合顯色,最后采用酶標儀在492 nm檢測吸光度(D)值。
MTT法測定色胺酮衍生物3對A549細胞的生長抑制作用取對數生長期的A549細胞接種于96孔培養板(細胞數為5×104/孔,100μL/孔),加入不同濃度的色胺酮衍生物3,使其終濃度分別為0、5、10、20、40、80μmol/L,最后用 DMEM 全培養基補充至每孔200μL,置于37℃、濕度95%、5%CO2的培養箱中培養。24 h后每孔加人20μL MTT溶液(5 g/L),繼續培養4 h后,吸去培養基,每孔加入150μL DMSO,37℃ 水平搖床振蕩10 min,使藍紫色結晶物充分溶解,酶標儀570 nm波長處測定吸光度(D)值。生長抑制率=(1-D實驗孔/D對照孔)×100%,并求IC50值,實驗重復3次。
結 果
體外IDO活性檢測體系的建立實驗檢測了純化rhIDO的活性,制作了酶反應進程曲線(圖1A)。通過繪制L-犬尿氨酸標準曲線(圖1B),得到吸光度與濃度關系曲線。從進程曲線中可以看出純化所得rhIDO具有色氨酸催化活性。利用該體系,測得1-MT的IC50為328μmol/L,與文獻報道的380μmol/L相近[4],并且可以重復。因此我們認為IDO抑制劑的體外酶活篩選體系已經成功建立,可用于IDO抑制劑的篩選。
IDO抑制劑的篩選利用上述體外IDO活性檢測體系對一系列色胺酮衍生物進行篩選,發現6個化合物均具有很強的IDO抑制活性,其中色胺酮衍生物3和4的IDO抑制效果比色胺酮顯著(圖2),6個化合物都是優于1-MT的IDO抑制劑。
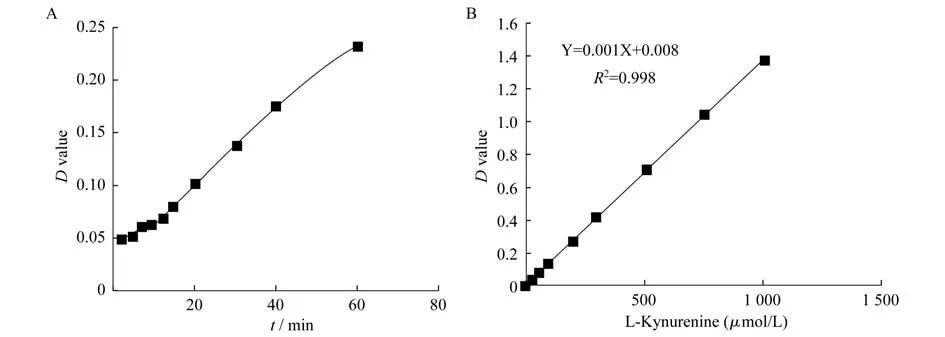
圖1 rhIDO酶反應進程曲線和L-犬尿氨酸標準曲線Fig 1 The curve of rhIDO enzyme reaction and the standard curve of L-kynurenineA:Curve of rhIDO enzyme reaction;B:Standard curve of L-kynurenine.
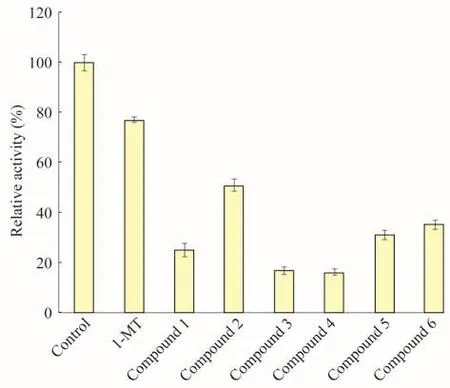
圖2 色胺酮衍生物的IDO抑制活性Fig 2 IDO inhihitory activity of tryptanthrin derivativesControl:No inhibitor.The concentrations of tryptanthrin derivatives and 1-MT were 100μmol/L.Results are expressed as±sfrom 3 independent experiments.
抑制類型判定及Ki、IC50的測定在固定抑制劑濃度的條件下,用一系列不同濃度的酶與抑制劑反應并測定反應速度。以反應速度對酶濃度作圖[12],根據曲線的特征可以判定6個色胺酮衍生物均為可逆抑制劑(圖3)。同時利用IDO活性檢測體系,測定抑制常數Ki及半數抑制濃度IC50(圖3,表1),結果發現6個化合物中3、4的Ki和IC50值已達到了納摩爾級別。
細胞水平IDO抑制活性利用質粒pcDNA 3.1(+)-IDO轉染 HEK 293細胞,使其高表達IDO,然后測定5個色胺酮衍生物在細胞水平的IDO抑制活性。結果顯示色胺酮衍生物對細胞內的IDO同樣具有抑制作用,并且抑制效果優于體外酶活效果 (圖4)。
色胺酮衍生物3對A549細胞的生長抑制作用體外酶活水平和細胞水平的IDO抑制結果表明,色胺酮衍生物3是一個具有很大潛力的IDO抑制劑(圖5)。MTT法進一步研究其對A549細胞生長的抑制作用,結果發現,隨著色胺酮衍生物3的濃度增加,其對A549細胞的生長抑制作用增強,半數抑制濃度IC50為8.77μmol/L,而1-MT即使在最高濃度80 μmol/L時也幾乎不能抑制A549細胞的生長。
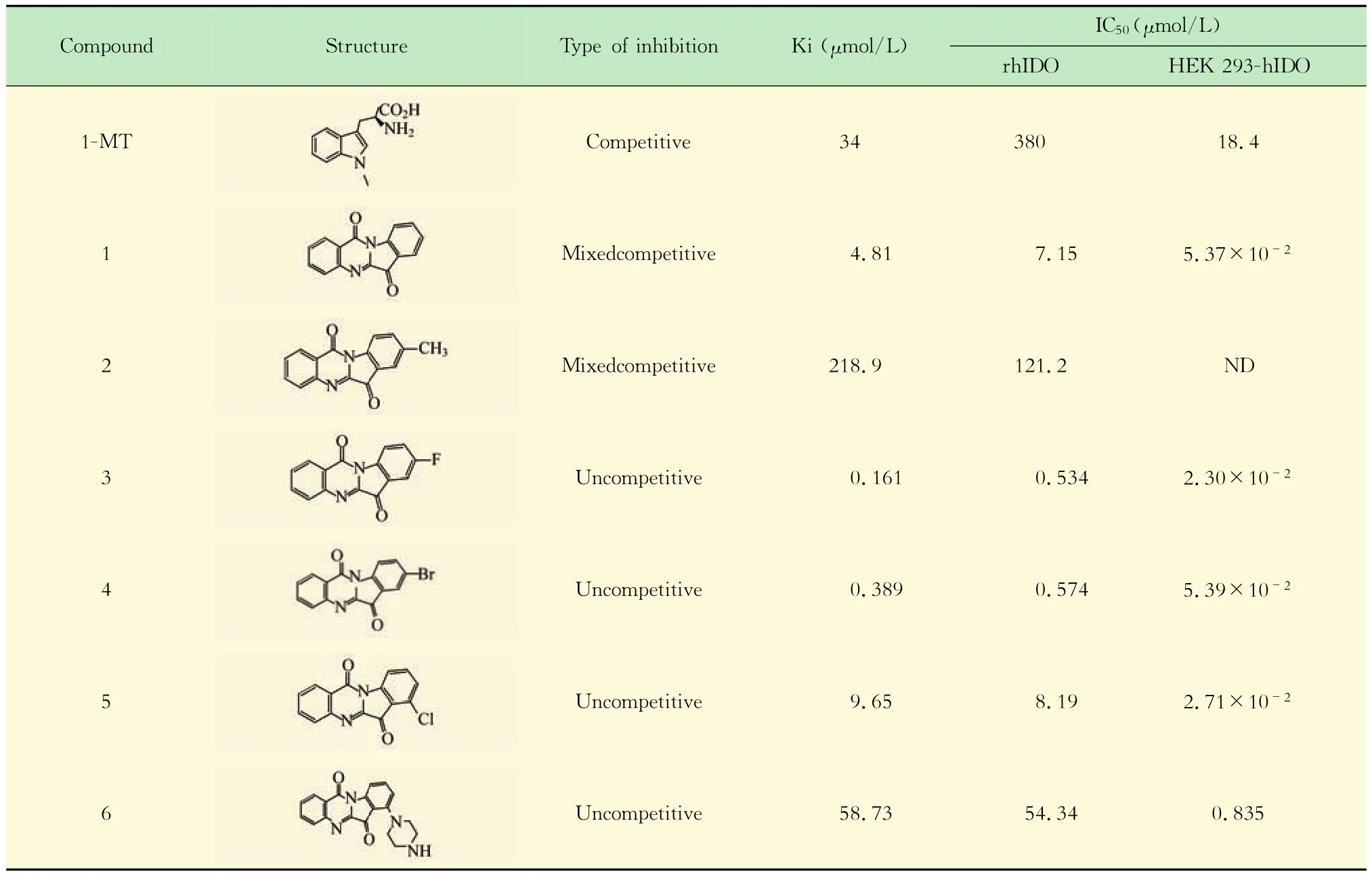
表1 色胺酮衍生物的抑制常數Ki和IC50值Tah 1 The kinetic parameters and IC50values of tryptanthrin derivatives
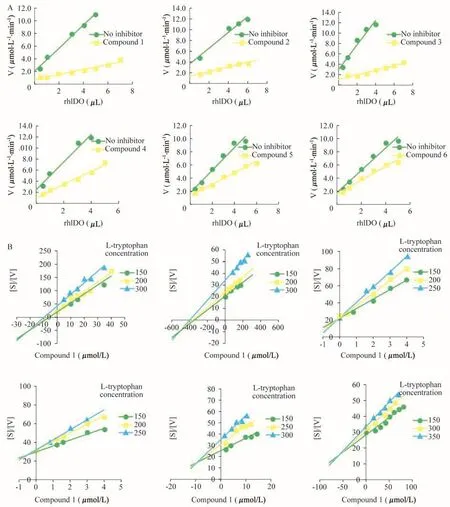
圖3 色胺酮衍生物的抑制類型和Ki值的測定Fig 3 Determination of the inhihition types and kinetic parameters of tryptanthrin derivativesA:Plot of reaction rate[V]against enzyme amount[E].The concentrations of L-tryptophan and the inhibitor were 300μmol/L and 50 μmol/L,respectively.B:Determination of the kinetic parameters.Plot of[S]/[V]against the concentration of the inhibitor([I]).L-tryptophan concentration varied from 150μmol/L to 350μmol/L.The intersection point in the plot stands for measuring the apparent inhibition constant Ki.
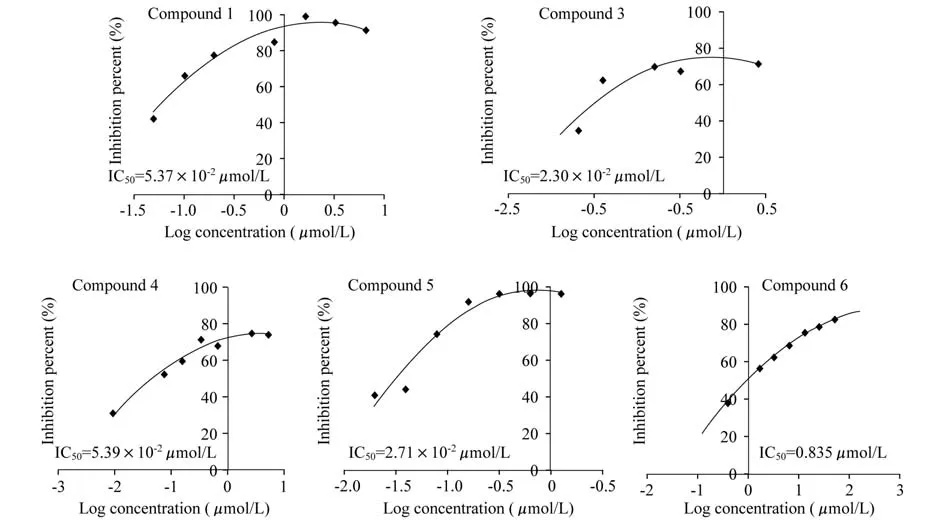
圖4 色胺酮衍生物細胞水平的IDO抑制活性Fig 4 Cell-hased assay of IDO inhihition of tryptanthrin derivativesPercent inhibition against log[I]was plotted and IC50value was determined.
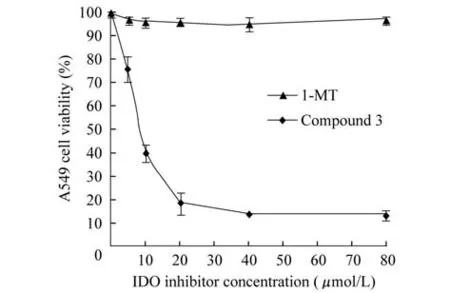
圖5 色胺酮衍生物3對A549細胞生長抑制作用Fig 5 Inhihitory effect of compound 3 on A549 cells
討 論
基于IDO在腫瘤免疫耐受的形成和維持中所發揮的重要作用,IDO已被證實是一個抑制惡性腫瘤形成和提高腫瘤免疫治療效果的新靶點[13]。IDO抑制劑作為相關治療的潛在藥物,具有非常廣闊的應用前景。
目前已有的IDO抑制劑主要分為以下幾個類別:競爭性抑制劑,如色氨酸衍生物1-MT[4];非競爭性抑制劑,如苯基咪唑[14];反競爭性抑制劑,如生物堿exiguamine A[15];通過其他作用機制的抑制劑。1-MT作為與底物色氨酸結構最接近的抑制劑,已經成為體內外實驗中普遍使用的IDO抑制劑。遺憾的是,雖然經過多年的努力,目前只有2個IDO抑制劑進入臨床研究[16-17],世界上還沒有IDO抑制劑類藥物上市。
本實驗通過建立穩定的IDO活性檢測體系,篩選得到6個具有IDO抑制活性的色胺酮衍生物,其中色胺酮衍生物3的抑制效果最強,其抑制常數Ki值為0.161μmol/L,IC50值為0.534μmol/L,抑制活性遠遠高于1-MT(Ki值34μmol/L,IC50值380 μmol/L)[4],其他5個化合物的抑制效果也在很大程度上優于1-MT。進一步實驗表明,色胺酮衍生物對細胞水平IDO同樣具有抑制作用,且抑制效果遠遠優于體外酶活水平,表明色胺酮衍生物能夠很好地穿過細胞膜,在細胞水平發揮IDO抑制作用。MTT實驗發現色胺酮衍生物3能夠對人非小細胞肺癌A549細胞具有明顯的抑制作用,且呈劑量依賴性,其半數抑制濃度為8.77μmol/L。
色胺酮作為一種喹唑啉酮生物堿,其具有抗菌、抗炎、抗腫瘤等多種藥理活性,但作為IDO抑制劑還是第一次被發現。近年來,色胺酮的抗腫瘤作用受到了越來越廣泛的關注,研究者對多種人類腫瘤細胞進行了體外實驗[18],但體內抗腫瘤實驗寥寥無幾,對人非小細胞肺癌A549的抗腫瘤作用研究尚未見報道。
本實驗通過抑制類型的判定、Ki和IC50值的測定,發現色胺酮衍生物是一類新型高效的IDO抑制劑,在體外對人非小細胞肺癌A549細胞具有較強的抗腫瘤作用。體內動物實驗有待進一步探索,通過使用色胺酮衍生物來控制IDO的活性,逆轉由IDO介導的腫瘤細胞免疫耐受,從而控制腫瘤細胞的生長,可能成為防治惡性腫瘤的有效方法,也可能成為色胺酮的一種新的抗腫瘤機制。
[1] Takikawa O,Yoshida R,Kido R,et al.Tryptophan degradation in mice initiated by indoleamine 2,3-dioxygenase[J].J Biol Chem,1986,261(8):3648-3653.
[2] Takikawa O.Clinical aspects of indoleamine 2,3-dioxygenase (IDO)-initiated tryptophan metabolism:IDO is a target of drug discovery for various diseases[J].Int Cong Seri,2007,1304:290-297.
[3] Vottero E,Balgi A,Woods K,et al.Inhibitors of human indoleamine 2,3-dioxygenase identified with a target-based screen in yeast[J].Biotechnol J,2006,1(3):282-288.
[4] Cady SG,Sono M.1-Methyl-DL-tryptophan,beta-(3-benzofuranyl)-DL-alanine (the oxygen analog of tryptophan),and beta-[3-benzo(b)thienyl]-DL-alanine(the sulfur analog of tryptophan)are competitive inhibitors for indoleamine 2,3-dioxygenase[J].Arch Biochem Biophys,1991,291(2):326-333.
[5] Prendergast GC.Immune escape as a fundamental trait of cancer:focus on IDO[J].Oncogene,2008,27(28):3889-3900.
[6] Soliman H,Mediavilla-Varela M,Antonia S.Indoleamine 2,3-dioxygenase:is it an immune suppressor? [J].Cancer J,2010,16(4):354-359.
[7] Uyttenhove C,Pilotte L,Theate I,et al.Evidence for a tumoral immune resistance mechanism based on tryptophan degradation by indoleamine 2,3-dioxygenase[J].Nat Med,2003,9(10):1269-1274.
[8] Friberg M,Jennings R,Alsarraj M,et al.Indoleamine 2,3-dioxygenase contributes to tumor cell evasion of T cellmediated rejection[J].Int J Cancer,2002,101(2):151-155.
[9] Muller AJ,Duhadaway JB,Donover PS,et al.Inhibition of indoleamine 2,3-dioxygenase,an immunoregulatory target of the cancer suppression gene Bin1,potentiates cancer chemotherapy[J].Nat Med,2005,11(3):312-319.
[10] Littlejohn TK,Takikawa O,Skylas D,et al.Expression and purification of recombinant human indoleamine 2,3-dioxygenase[J].Protein Expr Purif,2000,19(1):22-29.
[11] Cortes A,Cascante M,Cardenas ML,et al.Relationships between inhibition constants,inhibitor concentrations for 50%inhibition and types of inhibition:new ways of analysing data[J].Biochem J,2001,357(Pt 1):263-268.
[12] 王鏡巖,朱圣庚,徐長法.生物化學(上)[M].北京:高等教育出版社,2002:369-370.
[13] Liu X,Newton RC,Friedman SM,et al.Indoleamine 2,3-dioxygenase,an emerging target for anti-cancer therapy[J].Curr Cancer Drug Targets,2009,9(8):938-952.
[14] Sono M,Cady SG.Enzyme kinetic and spectroscopic studies of inhibitor and effector interactions with indoleamine 2,3-dioxygenase.1.Norharman and 4-phenylimidazole binding to the enzyme as inhibitors and heme ligands[J].Biochemistry,1989,28(13):5392-5399.
[15] Brastianos HC,Vottero E,Patrick BO,et al.Exiguamine A,an indoleamine-2,3-dioxygenase (IDO)inhibitor isolated from the marine sponge Neopetrosia exigua[J].J Am Chem Soc,2006,128(50):16046-16047.
[16] Hou DY,Muller AJ,Sharma MD,et al.Inhibition of indoleamine 2,3-dioxygenase in dendritic cells by stereoisomers of 1-methyl-tryptophan correlates with antitumor responses[J].Cancer Res,2007,67(2):792-801.
[17] Liu X,Shin N,Koblish HK,et al.Selective inhibition of IDO1 effectively regulates mediators of antitumor immunity[J].Blood,2010,115(17):3520-3530.
[18] Sharma VM,Prasanna P,Seshu KV,et al.Novel indolo[2,1-b]quinazoline analogues as cytostatic agents:synthesis,biological evaluation and structure-activity relationship[J].Bioorg Med Chem Lett,2002,12(17):2303-2307.
Screening of tryptanthrin derivatives of indoleamine 2,3-dioxygenase(IDO)inhihitor and their antitumor activityin vitro
YANG Shuang-shuang1,DU Li-sha1,RI Ho-nam2,YANG Qing1△
(1Department of Biochemistry,School of Life Science,Fudan University,Shanghai200433,China;2Department of Biochemistry,Faculty of Life Science,KimⅡSung University,Pyongyang,D.P.R.Korea)
activity assay; tryptanthrin derivatives; indoleamine 2,3-dioxygenase(IDO);antitumor activity
Q 331
A
10.3969/j.issn.1672-8467.2014.02.002
2013-03-13;編輯:王蔚)
國家自然科學基金(30873153)
△Corresponding author E-mail:yangqing68@fudan.edu.cn
【Ahstract】 OhJectiveTo evaluate the inhibitory activity of tryptanthrin derivatives of indoleamine 2,3-dioxygenase(IDO),and to explore the effects on human non-small cell lung cancer A549 cell growth.MethodsIDO activity assay system was established with recombinant human IDO (rhIDO),which was expressed and purified by the technology of genetic engineering.Based on the system,we detected the IDO inhibitory activity of tryptanthrin derivatives,and determined the inhibition type,kinetic parameters and IC50values.We also evaluated the IDO inhibitory effects of tryptanthrin derivatives on HEK 293 cells transfected with pcDNA3.1(+)-hIDO.Inhibitory activity of tryptanthrin derivatives on A549 cell growth inhibition was analysed by MTT assay.ResultsSix tryptanthrin derivatives displayed higher IDOinhibitory activity than 1-methyl tryptophan (1-MT),which is the commonly used IDO inhibitor.IC50values of tryptanthrin derivatives,obtained from the HEK 293 cell-based assay,were much lower than that from the enzyme assay.Compound 3 was the best inhibitor and had Ki value of 0.161μmol/L.Treating A549 cells with 3 remarkably inhibited the cell growth,and its IC50value was 8.77μmol/L.ConclusionsTryptanthrin derivatives are novel and potent IDOinhibitors,and can significantly inhibit human non-small cell lung cancerA549 cell growthin vitro.
*This work was supported hy the National Natural Science Foundation of China(30873153).

