重編程誘導多功能干細胞的研究進展*
郭曉令, 劉 慶, 王 嬋, 郭永龍, 余榕捷, 陳建蘇,2,△
(暨南大學 1再生醫學教育部重點實驗室, 2醫學院眼科研究所,3附屬第一臨床學院眼科, 4生命科學技術學院細胞生物學系,廣東 廣州 510632)
誘導多功能干細胞(induced pluripotent stem cells,iPSCs),即通過不同的轉導方法,將影響重編程的關鍵轉錄因子、RNA、蛋白或小分子化合物導入到成體細胞,使其“返老還童”回到胚胎干細胞狀態,并能夠被誘導分化產生不同的細胞類型。iPSCs的問世,對干細胞的發展具有劃時代的意義,使得患者來源的體細胞可以被誘導成iPSCs,用于相關疾病的檢測分析與干細胞治療,規避了免疫排斥和道德論理等問題。但是由于iPSCs誘導的低效性和致瘤性,使得這個“新星”在臨床中的應用被質疑,目前科學家一直圍繞這2個核心問題展開研究,通過改進轉導途徑,改變重編程方法來提高它的安全性和效率,并取得了一系列喜人的結果,從而使iPSCs未來用于臨床的前景變得越來越光明。
1 可誘導多功能干細胞取材不同的靶細胞
2006年,Takahashi等[1]首次實現將Oct4、Sox2、c-Myc及Klf4轉錄因子導入到小鼠皮膚成纖維細胞,獲得了類似于胚胎干細胞(embryonic stem cells, ES)的多能性干細胞, 并命名為“誘導多能性干細胞”,從而拉開了iPSCs研究的序幕。2007年,Takahashi等[2]和Yu等[3]又分別將人成纖維細胞誘導成iPSCs, 從而使iPSCs用于臨床治療的可能性又向前邁進了一步。2008年,Aoi等[4]將4種轉錄因子導入到鼠內胚層的肝臟細胞和胃上皮細胞,成功重編程出iPSCs。同年,Hanna等[5]又將4種轉錄因子導入到鼠中胚層的B淋巴細胞,成功誘導出iPSCs。2008年,Kim等[6]實現了將2種轉錄因子導入到人外胚層的神經干細胞,從而實現了iPSCs的重編程。2011年,Zhou等[7]從人的尿液中提取的腎小管細胞成功重編程出iPSCs,這使得誘導iPSCs取材細胞來源更加豐富和多樣化。由于取材細胞來自三胚層的體細胞(表1),所以從理論上講,機體的所有細胞均可被誘導成iPSCs。
2 通過不同途徑重編程iPSCs
Takahashi等[1]首次實現了iPSCs在DNA水平的重編程,但是重編程效率很低,而且由病毒介導,同時轉錄因子中包含了c-Myc 致瘤蛋白,安全性較差。近幾年,通過不斷的改進技術,分別實現了在RNA水平、蛋白質水平以及小分子化合物水平的iPSCs重編程,使重編程iPSCs的安全性和效率得到相應的提高。

表1 總結不同種屬的不同細胞重編程
2.1通過DNA途徑的重編程iPSCs 鼠和人的體細胞能通過一系列轉錄因子,在DNA水平實現重編程為iPSCs(表2)。2006年,Takahashi等[1]首次通過Oct4、Sox2、c-Myc和Klf4因子將鼠的體細胞重編程iPSCs。2007年,Yu等[3]報道另一套轉錄因子Oct4、Sox2、Nanog及Lin8,將體細胞重編程為iPSCs。2008年,Duinsbergen等[8]和Wernig等[9]又分別實現了利用3種轉錄因子(Oct4、c-Myc和Klf4;或Oct4、Sox2和Klf4)將體細胞重編程為iPSCs。同年,Kim等[6]也實現利用2種轉錄因子Oct4、Klf4或c-Myc將神經干細胞重編程為iPSCs, Huangfu等[10]成功利用Oct4和Sox2轉錄因子重編程成纖維細胞。通過進一步改進實驗方法,Kim等[11]僅用一種關鍵轉錄因子Oct4實現了對神經干細胞的重編程。
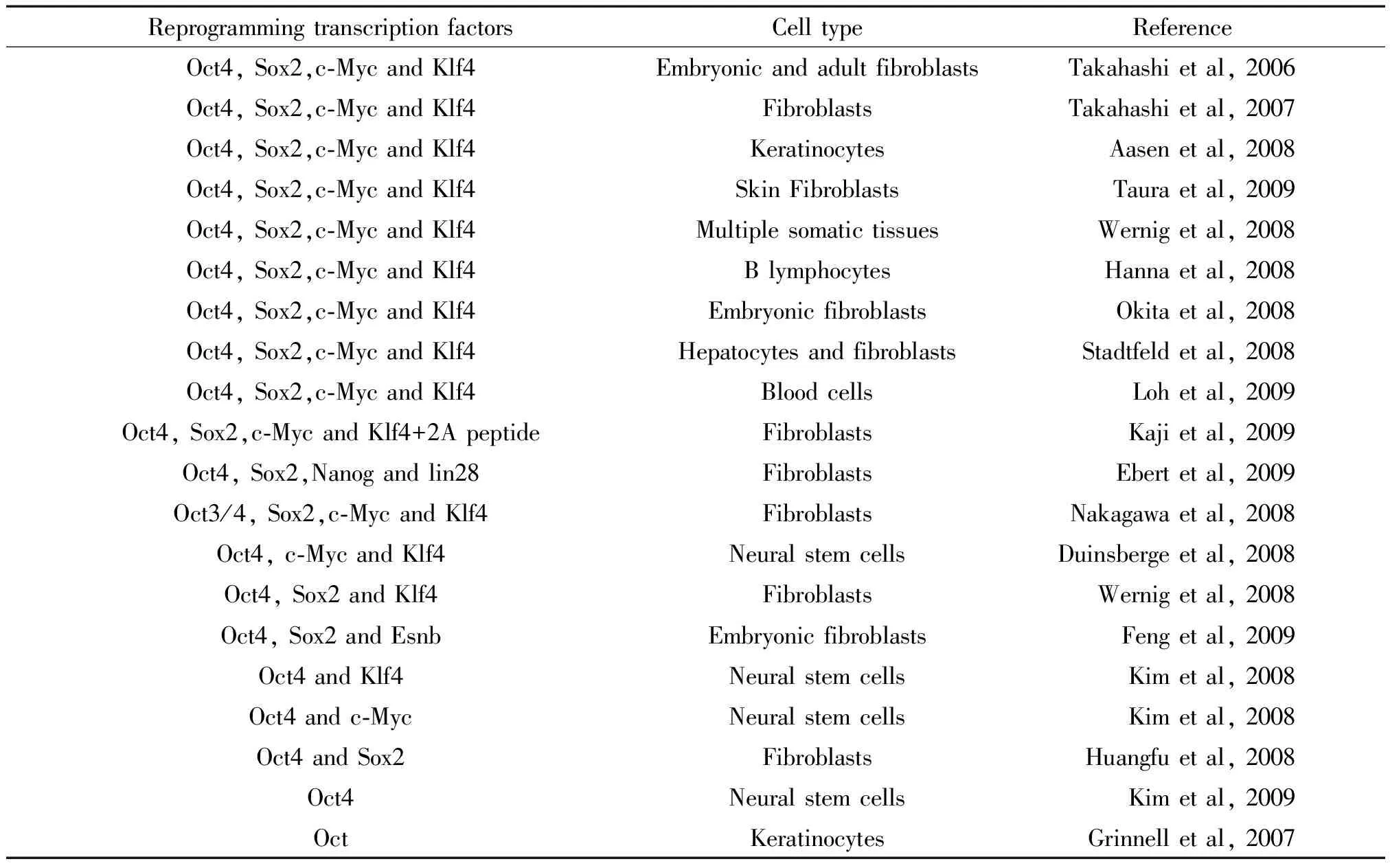
表2 總結重編程不同細胞的不同轉錄因子
2.2通過RNA途徑的重編程iPSCs DNA途徑的重編程無法規避基因插入而引起致瘤的風險,為了提高重編程iPSCs的安全性,2010年,Yakubov等[12]首次報道通過RNA途徑將人的體細胞重編程為iPSCs。通過在體外使用T7 RNA聚合酶和線性化質粒pTMA,構建合成Oct4、Lin28、Sox2及 Nanog的mRNA系統,合成4種轉錄因子的mRNA,利用脂質體轉染到人的體細胞,從而實現重編程iPSCs。但是由于mRNA的穩定性差,需要每間隔24 h 連續轉染mRNA,直到出現iPSCs陽性克隆為止,所以操作起來較麻煩。同年,Warren等[13]通過對體外合成Klf4、c-Myc、Oct4及Sox2 mRNA進行5’端糖基化和甲基化修飾,延長mRNA的半衰期,從而轉染1次可以穩定表達較長時間,顯著簡化重編程過程。2013年, Yashioka等[14]進一步改進技術,構造出能夠自我復制的VEE-RF RNA復制子,該復制子會在降解之前能高表達4種重編程因子(Oct4, Klf4, Sox2, c-Myc或Glis1)RNA,將其導入到人的體細胞,可成功重編程出iPSCs,從而使RNA水平重編程技術得到更大提高。另外,Anokye-Danso等[15]在外加Hdac2,將外源合成的miR302/367克隆到pLOVE載體上,將其轉染到人和鼠的成纖維細胞,成功重編程出iPSCs,使RNA水平的重編程更加多樣化。
2.3通過蛋白途徑的重編程iPSCs Zhou等[16]首次報道通過蛋白途徑實現了對小鼠體細胞的重編程,將Oct4、Sox2、Klf4、及 c-Myc 4種轉錄因子的基因克隆到原核生物表達載體上,并在其末端外加11個精氨酸殘基的基因,構建融合蛋白表達載體,使其在大腸桿菌中大量表達,從而純化獲取4種轉錄因子對應的蛋白。2013年,Nemes等[17]再次報道利用改造后的4種關鍵轉錄蛋白將鼠的體細胞重編程為iPSCs,并將iPSCs注射到小鼠的早期胚囊中,成功獲得嵌合體小鼠。不僅通過原核表達載體獲取的轉錄蛋白可以重編程iPSCs,來自真核表達載體的轉錄蛋白同樣能重編程iPSCs。Kim等[18]分別將Oct4、Sox2、Klf4及c-Myc的基因進行改造,在其末端加上具有細胞膜穿梭功能的CPP短肽基因,構建真核表達重組載體,使其在真核細胞內表達,從而獲取構象上更接近真核的4種融合轉錄蛋白,將其加入到誘導培養基,不用外加小分子化合物便可將人的體細胞重編程為iPSCs。隨后,Kim團隊基于蛋白途徑重編程的iPSCs,誘導其定向分化為功能性多巴胺神經元細胞,并移植這些細胞到患有帕金森疾病的小鼠模型中,成功達到了治療的效果[19]。由于沒有外源基因的介入,安全性高,從而為未來人類個性化的細胞治療帕金森疾病開辟了全新的道路。2012年,Zhang等[20]對帶有11個精氨酸的融合蛋白介導的重編程與帶有穿膜肽融合蛋白介導的重編程效率進行了比較,發現帶有穿膜肽的4種轉錄蛋白重編程的效率要明顯高于帶有11個精氨酸的轉錄蛋白。
2.4通過小分子化合物途徑的重編程iPSCs 重編程的發生主要與核小體中DNA的甲基化和組蛋白的酰基化以及一些關鍵信號通路有關,通過影響細胞的表觀遺傳學及關鍵信號通路,可以獲得重編程效果。2011年,Li等[21]通過尋找影響重編程的表觀遺傳和關鍵信號通路的抑制劑或激活劑,首次報道僅用Oct4一種轉錄因子,外加VC6T(VPA、CHIR 99021、616452和tranylcypromine)4種小分子化合物成功將鼠的體細胞重編程為iPSCs,從而實現了利用小分子化合物取代Sox2、Klf4 及c-Myc 3種關鍵轉錄因子。2013年,通過改進技術,我國的Hou等[22]成功利用6種小分子化合物VC6TF(VPA、CHIR99021、616452、Tranylcypromine、FSK和DZNep)徹底取代了4種關鍵轉錄因子,實現了在小分子化合物水平的重編程,將鼠的體細胞重編程為iPSCs,其中DZNep在啟動內源性Oct4的表達中發揮至關重要的作用。
3 重編程iPSCs的轉導方法
3.1病毒轉導 Takahashi等[1]首次通過反轉錄病毒將4種關鍵的轉錄因子導入到鼠的體細胞,成功實現了iPSCs在DNA水平的重編程。2008年,Stadtfeld等[23]采用腺病毒包裝4種轉錄因子,將其高效導入到鼠的體細胞,實現iPSCs的成功構建。同年,Hanna等[5]通過慢病毒包裝,將4種轉錄因子導入到鼠的B淋巴細胞,成功誘導出iPSCs。次年,Fusaki等[24]首次報道采用Sendai病毒成功實現了對人的體細胞重編程,Sendai病毒為RNA病毒,介導的重編程不會引起宿主基因插入,從而提高了iPSCs構建的安全性。
3.2脂質體轉導 2012年,Park等[25]采用脂質體轉染技術,將包含4種轉錄因子的2種重組載體pCX-OKS-2A及pCX-c- Myc共轉染導入鼠的胚胎成纖維細胞,實現非病毒轉導的重編程,極大提高了構建iPSCs的安全性,但是轉導效率要明顯低于病毒轉導。
3.3核酸轉導 2009年,Gonzalez等[26]首次報道采用核酸轉導技術,將融合4種轉錄因子基因的pCAG-OSKM重組載體導入鼠的胚胎成纖維細胞,成功將其重編程為iPSCs。2010年,Jia等[27]同樣采用核酸轉導技術,將含有4種轉錄因子的小環導入人的體細胞,構建出安全有效的iPSCs。
3.4納米高分子材料轉導 2011年,Montserrat等[28]首次報道利用納米高分子多聚β氨基酯,將融合4種轉錄因子Oct4、Sox2、Klf4、c-Myc和GFP報告基因的重組載體pCAG-OSKMG導入的成纖維細胞,成功構建出iPSCs。
4 體內重編程誘導iPSCs的研究
以上研究均是在體外進行的體細胞重編程,隨著技術的發展,目前可以實現在體內完成定向重編程[29],這樣獲得的iPSCs相比體外重編程的iPSCs更加接近胚胎干細胞(ES cells)的狀態,并且比ES細胞具有更好的可塑性和原始性。目前還可以直接將供體細胞導入到體內,在機體微環境和外源化合物的共同作用下,直接重編為目的細胞[30-34]。
5 展望
iPSCs的誕生,使干細胞在再生醫學方面的應用得到巨大突破,不僅解決了免疫排斥問題,同時也規避了道德論理等問題。隨著iPSCs研究的發展,用來誘導iPS細胞的供體細胞變得越來越廣泛和多樣化。雖然目前構建iPSCs的效率和安全性有了較大的提高,但是距離廣譜的臨床應用還有很大差距,需要進一步改進技術。在提高安全性方面,可以側重蛋白質結合小分子化合物的重編程;在提高效率方面,可以改變轉錄因子的添加順序[35],調整轉錄因子最佳濃度比例[13],改善轉導時間[36],優化培養條件[37]等。也可以探索影響重編程的關鍵信號通路,通過siRNA干擾使其在本體基因水平沉默,這樣既不會引起外源基因插入,同時干擾效率也較高。相信在不久將來,通過不斷的改進重編程技術和方法,iPSCs會被廣泛用于干細胞治療,造福人類。
[參 考 文 獻]
[1] Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126(4):663-676.
[2] Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J]. Cell, 2007, 131(5):861-872.
[3] Yu J, Vodyanik MA, Smuga-Otto K, et al. Induced pluripotent stem cell lines derived from human somatic cells[J]. Science, 2007, 318(5858):1917-1920.
[4] Aoi T, Yae K, Nakagawa M, et al. Generation of pluripotent stem cells from adult mouse liver and stomach cells[J]. Science, 2008, 321(5889):699-702.
[5] Hanna J, Markoulaki S, Schorderet P, et al. Direct reprogramming of terminally differentiated mature B lymphocytes to pluripotency[J]. Cell, 2008, 133(2):250- 264.
[6] Kim JB, Zaehres H, Wu GM, et al. Pluripotent stem cells induced from adult neural stem cells by reprogramming with two factors[J]. Nature, 2008, 454(7204):646-650.
[7] Zhou T, Benda C, Duzinger S, et al. Generation of human induced pluripotent stem cells from urine samples[J]. Nat Protoc, 2012, 7(12):2080-2089.
[8] Duinsbergen D, Eriksson M, ’t Hoen PA, et al. Induced pluripotency with endogenous and inducible genes[J]. Exp Cell Res, 2008, 314(17):3255-3263.
[9] Wernig M, Zhao JP, Pruszak J, et al. Neurons derived from reprogrammed fibroblasts functionally integrate into the fetal brain and improve symptoms of rats with Parkinson’s disease[J]. Proc Natl Acad Sci U S A, 2008, 105(15):5856-5861.
[10] Huangfu DW, Osafune K, Maehr R, et al. Induction of pluripotent stem cells from primary human fibroblasts with only Oct4 and Sox2[J]. Nat Biotechnol, 2008, 26(11):1269-1275.
[11] Kim JB, Sebastiano V, Wu GM, et al. Oct4-induced pluripotency in adult neural stem cells[J]. Cell, 2009, 136(3):411-419.
[12] Yakubov E, Rechavi G, Rozenblatt S, et al. Reprogramming of human fibroblasts to pluripotent stem cells using mRNA of four transcription factors[J]. Biochem Biophy Res Commun, 2010, 394(1):189-193.
[13] Warren L, Manos PD, Ahfeldt T, et al. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA[J]. Cell Stem Cell, 2010, 7(5):618-630.
[14] Yoshioka N, Gros E, Li HR, et al. Efficient generation of human iPSCs by a synthetic self-replicative RNA[J]. Cell Stem Cell, 2013, 13(2):246-254.
[15] Anokye-Danso F, Trivedi CM, Juhr D, et al. Highly efficient miRNA-mediated reprogramming of mouse and human somatic cells to pluripotency[J]. Cell Stem Cell, 2011, 8(4):376-388.
[16] Zhou HY, Wu SL, Joo JY, et al. Generation of induced pluripotent stem cells using recombinant proteins[J]. Cell Stem Cell, 2009, 4(5):381-384.
[17] Nemes C, Varga E, Polgar Z, et al. Generation of mouse induced pluripotent stem cells by protein transduction[J]. Tissue Eng Part C Methods, 2013, 78(43): 345-351.
[18] Kim D, Kim CH, Moon JI, et al. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins[J]. Cell Stem Cell, 2009, 4(6):472-476.
[19] Rhee YH, Ko JY, Chang MY, et al. Protein-based human iPS cells efficiently generate functional dopamine neurons and can treat a rat model of Parkinson disease[J]. J Clin Invest, 2011, 121(6):2326-2335.
[20] Zhang H, Ma Y, Gu JJ, et al. Reprogramming of somatic cells via TAT-mediated protein transduction of recombinant factors[J]. Biomaterials, 2012, 33(20):5047-5055.
[21] Li YQ, Zhang QA, Yin XL, et al. Generation of iPSCs from mouse fibroblasts with a single gene, Oct4, and small molecules[J]. Cell Res, 2011, 21(1):196-204.
[22] Hou P, Li Y, Zhang X, et al. Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds[J]. Science, 2013, 341(6146):651-654.
[23] Stadtfeld M, Nagaya M, Utikal J, et al. Induced pluripotent stem cells generated without viral integration[J]. Science, 2008, 322(5903):945-949.
[24] Fusaki N, Ban H, Nishiyama A, et al. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome[J]. Proc Jpn Acad Ser B Phys Biol Sci, 2009, 85(8):348-362.
[25] Park HY, Noh EH, Chung HM,et al. Efficient generation of virus-free iPS cells using liposomal magnetofection[J]. PLoS One, 2012, 7(9):e45812.
[26] Gonzalez F, Monasterio MB, Tiscornia G, et al. Generation of mouse-induced pluripotent stem cells by transient expression of a single nonviral polycistronic vector[J]. Proc Natl Acad Sci U S A, 2009, 106(22):8918-8922.
[27] Jia FJ, Wilson KD, Sun N, et al. A nonviral minicircle vector for deriving human iPS cells[J]. Nat Methods, 2010, 7(3):197-199.
[28] Montserrat N, Garreta E, Gonzalez F, et al. Simple generation of human induced pluripotent stem cells using poly-beta-amino esters as the non-viral gene delivery system[J]. J Biol Chem, 2011, 286(14):12417-12428.
[29] Abad M, Mosteiro L, Pantoja C, et al. Reprogramminginvivoproduces teratomas and iPS cells with totipotency features[J]. Nature, 2013, 502(7471):340-345.
[30] Ieda M. Heart regeneration using reprogramming techno-logy[J]. Proc Jpn Acad Ser B Phys Biol Sci, 2013, 89(3):118-128.
[31] Qian L, Huang Y, Spencer CI, et al.Invivoreprogramming of murine cardiac fibroblasts into induced cardiomyocytes[J]. Nature, 2012, 485(7400):593-598.
[32] Sanges D, Romo N, Simonte G, et al. Wnt/beta-catenin signaling triggers neuron reprogramming and regeneration in the mouse retina[J]. Cell Reports, 2013,4(2):271-286.
[33] Torper O, Pfisterer U, Wolf DA, et al. Generation of induced neurons via direct conversioninvivo[J]. Proc Natl Acad Sci USA, 2013, 110(17):7038-7043.
[34] Zhou Q, Brown J, Kanarek A, et al.Invivoreprogramming of adult pancreatic exocrine cells to beta-cells[J]. Nature, 2008, 455(7213):627-632.
[35] Liu XP, Sun H, Qi J, et al. Sequential introduction of reprogramming factors reveals a time-sensitive requirement for individual factors and a sequential EMT-MET mechanism for optimal reprogramming[J]. Nat Cell Biol, 2013, 15(7):829-838.
[36] Page RL, Ambady S, Holmes WF, et al. Induction of stem cell gene expression in adult human fibroblasts without transgenes[J]. Cloning Stem Cells, 2009, 11(3):417-426.
[37] Rais Y, Zviran A, Geula S, et al. Deterministic direct reprogramming of somatic cells to pluripotency[J]. Nature, 2013, 502(7469):65-70.

