對大麗輪枝菌具有拮抗作用的萎縮芽胞桿菌的分離和鑒定
孫崇思,陳曉敏,束長龍,齊放軍,高繼國,張 杰*
(1.東北農業大學生命科學院,哈爾濱 150030;2.中國農業科學院植物保護研究所,植物病蟲害生物學國家重點實驗室,北京 100193)
研究報告
對大麗輪枝菌具有拮抗作用的萎縮芽胞桿菌的分離和鑒定
孫崇思1, 2,陳曉敏2,束長龍2,齊放軍2,高繼國1*,張 杰2*
(1.東北農業大學生命科學院,哈爾濱 150030;2.中國農業科學院植物保護研究所,植物病蟲害生物學國家重點實驗室,北京 100193)
旨在從新疆棉花主產區的土壤中分離對重要植物病原菌大麗輪枝菌的拮抗菌,鑒定其種類,并探討其應用前景。采用平板對峙培養法對抗性菌株、發酵濾液進行初步篩選,并對其發酵濾液熱穩定性進行測試,采用16S rDNA和gyrB基因序列分析的方法確定該菌的分類地位。共分離出61株對大麗輪枝菌拮抗菌,其中59號菌株拮抗活性強,產色素,其發酵濾液經100 ℃加熱5 min后,仍然具有抑菌活性,抑菌圈直徑為15.8 mm,盆栽試驗結果表明該菌對大麗輪枝菌具有良好的拮抗作用,并能促進棉苗生長。經過16S rDNA和gyrB基因相結合構建的系統發育樹分析,結果顯示59號等9株菌株為萎縮芽胞桿菌(Bacillusatrophaeus)。這是萎縮芽胞桿菌對大麗輪枝菌有拮抗作用的首次報道。
大麗輪枝菌; 萎縮芽胞桿菌; 16S rDNA;gyrB基因; 鑒定
大麗輪枝菌(VerticilliumdahliaeKleb.)屬絲胞目(Hyphomycetales)淡色孢科(Moniliaceae)輪枝孢菌屬(Verticillium),廣泛存在于土壤中,是廣宿主的植物病原菌,能夠侵染400多種植物,特別是侵染棉花,引起棉花黃萎病的發生,嚴重影響棉花生產。我國從1973年第一次普查棉花枯、黃萎病,發病棉田為36.7萬 hm2,到1993年,發病棉田發展到267萬 hm2[1],發病棉田呈現逐年增加的趨勢。長期以來,黃萎病已發展成為制約我國棉花生產的主要障礙和頑癥[2]。國內外防控棉花黃萎病發生的主要技術措施有:培育抗耐病的棉花品種、種子處理、土壤處理、輪作倒茬等[3-6]。然而,由于大麗輪枝菌產生的微菌核在土壤中存活時間長、寄主廣泛、傳播途徑多,這些技術實際防效有限,難以滿足生產的需求。對于土傳病害而言,著眼于土壤生態改良的“以菌治菌”的生物防治措施逐漸引起了人們的重視,有望發展成為防控土傳性病害的重要手段[7]。
近年來,對大麗輪枝菌具有拮抗作用的細菌陸續被發現,如芽胞桿菌(BacillusCohn)、熒光假單胞菌[Pseudomonasfluorescens(Trev.) Migula]、嗜麥芽寡養單胞菌[Stenotrophomonasmaltophilia(Hugh) PalleronietBradbury]、腸桿菌屬(EscherichiaCastellani)[8-10]等;其中具有拮抗作用的芽胞桿菌主要包括枯草芽胞桿菌[Bacillussubtilis(Ehrenberg) Cohn]、解淀粉芽胞桿菌(B.amyloliquefaciensPriest)、蠟樣芽胞桿菌(B.cereusFranklandetFrankland)、多黏芽胞桿菌(B.polymyxaMacé)、漠海威芽胞桿菌(B.mojavensisRoberts)等[11-15]。萎縮芽胞桿菌(B.atrophaeusNakamura)屬芽胞桿菌,1989年Nakamura等曾對產生色素的40株枯草芽胞桿菌進行研究,發現其DNA相關性和多位點酶電泳分析(multilocus enzyme electrophoresis analyses)與其他枯草芽胞桿菌存在明顯差異,因此將這類產色素的芽胞桿菌從枯草芽胞桿菌中分離出來,命名為萎縮芽胞桿菌[16]。現已發現萎縮芽胞桿菌對尖孢鐮刀菌(FusariumoxysporumSchlechtendahl)、核盤菌[Sclerotiniasclerotiorum(Lib.) de Bary]等植物病原菌具有拮抗作用[17-18],但迄今未見萎縮芽胞桿菌拮抗大麗輪枝菌的報道。
隨著分子生物學的迅速發展,對于微生物的鑒定不再僅僅依賴于微生物形態和生理生化特性的分析,以16S rDNA[19]和gyrB基因序列為靶分子進行細菌分類和系統進化研究得以迅速發展。16S rDNA序列分析存在著基因進化速率慢、序列保守、無法有效區分親緣關系很近的物種等局限性,gyrB基因序列分析方法恰能很好地彌補。gyrB即促旋酶(gyrase)的B亞單位基因,Yamamoto建立了一種基于gyrB基因直接測序的快速鑒別微生物近緣種的方法[20]。Dauga等發現,16S rDNA基因序列適用于描述親緣關系較遠的細菌之間的關系,而gyrB序列更適用于屬內或屬間關系的比較分析[21]。因此選用16S rDNA與gyrB基因測序結合的方法,將能更加準確地鑒定細菌的種類,明確其分類地位。
本文報道從北疆棉花主產區常年發病棉田的棉株根系土壤中,分離出對大麗輪枝菌具有拮抗作用的芽胞桿菌,經16S rDNA及gyrB基因序列比對,同時構建系統發育樹,鑒定出部分拮抗菌為萎縮芽胞桿菌,豐富了選擇對大麗輪枝菌具有良好拮抗作用的芽胞桿菌新的種類。
1 材料與方法
1.1 材料
病原菌:大麗輪枝菌(VerticilliumdahliaeKleb.)V991。中國農業科學院植物保護研究所經濟作物病害組保存。
土壤樣品:從新疆農七師129團棉田棉株根圍采集。采集點黃萎病常年發生,中度偏重。
棉花種子品種:棉花感黃萎病品種‘新陸早7號’。
培養基:拮抗細菌的分離采用PDAY培養基(200 g 馬鈴薯煮20 min取濾液,20 g葡萄糖,5 g酵母提取物,15 g瓊脂粉,配成1 L的培養基,121 ℃滅菌20 min。),拮抗細菌的培養采用LB固體培養基和LB液體培養基,病原菌培養及對峙試驗采用馬鈴薯葡萄糖瓊脂(PDA)培養基[22]。
生化和分子生物學試劑購自北京冰達生物科技有限公司;引物由上海生工生物技術有限公司北京部合成,測序由中國農業科學院測序部完成。
1.2 芽胞桿菌的分離
刮取大麗輪枝菌V991的孢子,打散后用滅菌的脫脂棉過濾去除菌絲,制成孢子懸液。取5 g抗病棉花植株的根際土壤,加入無菌玻璃珠和無菌水50 mL,充分振蕩,80 ℃水浴20 min。取土壤懸液與大麗輪枝菌的孢子懸液混合,涂于PDA平板上,25 ℃培養3 d后挑取產生抑菌圈的細菌,在LB平板上進行畫線純化培養。
1.3 大麗輪枝菌拮抗細菌的篩選
采用傳統的對峙培養法進行初篩,挑取單菌落在LB液體培養基中,30 ℃培養過夜。在PDA平板上培養V99110 d后打圓形菌餅倒置于90 mm PDA平板中央,在平板對稱等距的4個位置放置無菌圓形濾紙片,滴加5 μL菌液,置于25 ℃暗培養至V991長滿平板。觀察并記錄測量抑菌圈直徑[22]。
初篩得到的菌株接種于LB液體培養基中,220 r/min、30 ℃恒溫振蕩培養44 h。4 ℃、12 000 r/min離心5 min,收集上清液,經0.22 μm微孔濾膜過濾后4 ℃保存備用。在PDA平板中央接種V991菌餅,在距培養皿邊緣等距處放置滅菌牛津杯,每杯中加入100 μL初篩菌株的發酵濾液,3次重復,25 ℃暗培養10 d后測量抑菌圈直徑。
1.4 拮抗菌胞外代謝產物的熱穩定性檢測
取0.5 mL發酵濾液,經過100 ℃煮沸5 min處理,進行對峙試驗。在PDA平板中央接種V991菌餅,在距培養皿邊緣等距處放置滅菌牛津杯,每杯中加入100 μL加熱處理過的發酵濾液,3次重復,25 ℃暗培養10 d后測量處理菌落直徑。
1.5 盆栽試驗
活化59號菌株過夜,按照1%的比例轉接于LB液體培養基中,30 ℃培養48 h。5 000 r/min,離心5 min收集菌體,菌體用同體積的無菌水懸浮均勻,制成濃度為1010cfu/mL的菌懸液。將1 L菌懸液與24盆量的土壤拌勻,為拌土處理,分別在拌土處理和未處理的24盆土壤中播種經過表面消毒的棉花種子。待棉苗顯露兩片真葉,并且第一片真葉展開時,進行黃萎病菌(大麗輪枝菌)的接種處理[23]。處理如下:拌土處理的24盆全部接種大麗輪枝菌,4盆為一組,6個重復;未處理的12盆接種大麗輪枝菌,4盆為一組,3個重復;未處理的12盆不接種作為空白對照,4盆為一組,3個重復。接種后在25 ℃,16 h光照,22 ℃,8 h黑暗條件培養,15 d后觀察黃萎病發病進程,按以下標準記錄黃萎病的發病級別:0=健株,無任何病癥;1=1片以下或部分子葉變黃或壞死;2=2片子葉變黃或壞死;3=出現1片真葉變黃或壞死的現象;4=2片真葉變黃或壞死,或完全脫落。
發病指數=[(∑發病級別×發病植株數)/
(4×總植株數)] ×100。
1.6 拮抗細菌黑色素形成量的測定
挑取抑菌效果最好的單菌落,PDA液體培養基中30 ℃活化過夜,按1%的接種量轉接于50 mL PDA液體培養基中,220 r/min、30 ℃振蕩培養;同時以不產生色素的蘇云金芽胞桿菌HD73作為對照。在培養12、24、36、48、60、72 h各取1.0 mL菌液,12 000 r/min離心10 min,取上清液在400 nm波長下測其吸光值[24],3個重復。
1.7 拮抗菌株的鑒定
提取拮抗菌株基因組DNA,方法參照《分子克隆實驗指南》[25]。
PCR擴增:以細菌16S rDNA通用引物27F(5′-AGAGTTTGATCATGGCTCAG-3′)和1492R(5′-TACGGYTACCTTGTTACGACTT-3′)[26]對基因組DNA進行擴增。16S rDNA PCR擴增反應體系(50 μL):2×TaqMix 25 μL、引物各1 μL、模板DNA 1 μL、 超純水22 μL。PCR反應條件:95 ℃預變性3 min;94 ℃變性1 min,55 ℃退火1 min,72 ℃延伸1.5 min,30個循環;最后72 ℃延伸10 min。以細菌gyrB基因擴增引物UP-1(5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′)和UP-2r(5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′)[20]對基因組DNA進行擴增。gyrB基因PCR擴增反應體系(50 μL):2×TaqMix 25 μL、引物各1 μL、模板DNA 1 μL、超純水22 μL。PCR反應條件:95 ℃預變性4 min;94 ℃變性1 min,62 ℃退火1 min,72 ℃延伸2 min,30個循環;最后72 ℃延伸10 min。產物經1%瓊脂糖凝膠電泳檢測,純化后送交測序。
序列比對分析:采用BLAST軟件,將測序獲得的序列與GenBank中的核酸序列進行比對分析;采用MAGE 5.1軟件構建系統發育樹。
2 結果分析
2.1 芽胞桿菌的分離
從供試土壤懸液和大麗輪枝菌孢子懸液涂布的PDA平板上觀察到有抑菌圈產生,挑取有抑菌活性的芽胞桿菌在LB固體平板上畫線得到單菌落,再挑取單菌落在LB平板畫線培養得到純化菌株,于4 ℃保存。共得到94株拮抗芽胞桿菌,編號為1~94。
2.2 對大麗輪枝菌產生拮抗作用的芽胞桿菌篩選
使用菌液進行平板對峙培養初篩,61株菌菌液對大麗輪枝菌具有拮抗作用,占所分離菌株的64.9%。利用61株菌株的發酵濾液與大麗輪枝菌V991進行對峙試驗,結果篩選出19株發酵濾液具有抑菌活性的菌株,其中59號菌株的菌液抑菌效果最好,產生的抑菌圈直徑為30.2 mm,發酵濾液產生的抑菌圈直徑為20.7 mm。如圖1中所示,59號菌株的菌液和發酵濾液在與大麗輪枝菌對峙試驗中均產生抑菌圈,對大麗輪枝菌均具有顯著的抑制作用。
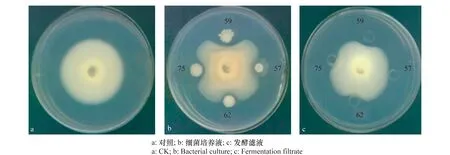
圖1 部分樣品抑菌試驗結果Fig.1 Antagonistic assay of partial samples
2.3 抑菌物質熱穩定性測定
19個具有抑菌活性的發酵濾液樣品加熱后,有9個樣品仍然具有抑菌能力,表明其中的抑菌物質具有一定的熱穩定性,菌株編號分別為15、46、54、59、61、70、75、77和89,其中59號菌樣品產生的抑菌圈直徑最大,為15.8 mm。進一步比較發酵濾液加熱前后的抑菌活性,54、77菌株的兩種處理產生的抑菌圈大小差異不顯著,而15、46、59、61、70、75和89菌株的兩種處理產生的抑菌圈直徑差異較明顯。
表1發酵濾液加熱前后的抑菌活性對比結果
Table1Comparisonofantagonisticactivitywithfermentationfiltrateandheat-treatment

菌株編號StrainNo.抑菌圈直徑/mmInhibitiondiameter發酵濾液Fermentationfiltrate加熱處理的發酵濾液Fermentationfiltrateheated59(20.7±1.0)a(15.8±0.2)b75(19.3±1.3)a(11.9±0.6)c15(15.1±0.9)b(10.1±0.4)c54(14.8±0.4)b(13.9±0.4)b89(11.1±0.6)c(8.9±0.5)d46(10.6±0.7)c(6.1±0.4)f70(10.3±0.4)c(9.8±0.4)d61(8.0±0.6)d(7.9±0.5)e77(6.3±0.4)f(5.1±0.9)f
2.4 盆栽試驗結果
未經過處理和經過拌59號菌處理的土壤中的棉花種子,萌發7 d后在生長狀態上有明顯的不同(如圖2a),拌有59號菌懸液的處理組中棉苗長勢優于未經處理的棉苗,說明59號菌株具有一定的促進棉苗生長的能力。在長出兩片真葉,第一片真葉完全展開時進行大麗輪枝菌的接種,15 d后調查棉苗發病進程時,只長有兩片子葉、兩片真葉,圖2b中觀察到,空白對照組棉苗無染病癥狀;只接種大麗輪枝菌處理組的棉苗葉片有枯黃現象,并且植株矮小;經過59號菌株拌土和接種大麗輪枝菌處理組的棉苗葉片有少數枯黃,但是植株長勢良好。對棉苗葉片的染病情況進行調查,結果如圖2c,空白對照的病情指數為0,接種大麗輪枝菌處理組的病情指數為38.43,接種大麗輪枝菌的拌土處理組的病情指數為9.03,結果表明59號菌株在盆栽試驗中對棉苗上的大麗輪枝菌具有顯著的拮抗作用,對棉花黃萎病具有一定的防效。
2.5 拮抗細菌黑色素形成量的測定
59號菌株液體培養基的顏色與不產生色素的HD73菌株對比,明顯偏深、變黑(如圖3a),說明59號菌株產生黑色素。測量A400 nm黑色素的吸光值,黑色素產生的變化結果表明(如圖3b),59號菌株在36 hA400 nm為0.89,產生黑色素達到頂峰,之后黑色素含量基本不變,明顯高于不產生色素的HD73菌株的吸光值(該樣品的A400 nm最大值為0.36)。

圖2 盆栽試驗結果Fig.2 The results of pot culture test
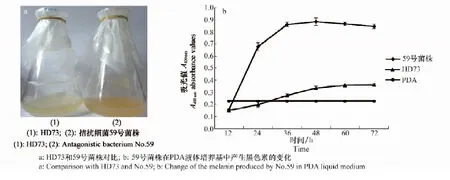
圖3 在PDA液體培養基中產生黑色素的測定結果Fig.3 The assay results of melanin production in PDA liquid medium
2.6 芽胞桿菌16S rDNA序列分析鑒定
選擇9株拮抗效果較好的菌株基因組DNA進行16S rDNA基因擴增,獲得1 465 bp的片段。PCR產物純化、測序后,序列比對分析結果表明(詳見表2):菌株9、10、19、30、32、59、62、75、78與B.atrophaeusN15的相似性為100%,同時,除32號菌株與B.subtilisJAM A-6-10的相似性為99%以外,其余菌株與B.subtilisJAM A-6-10的相似性為100%。系統發育樹構建結果表明(如圖4),拮抗菌株59等9株菌與B.atrophaeusATCC 51189、B.atrophaeusLSSC3、B.subtilisATCC 49822聚在一簇,親緣關系最近。
表2分離菌株16SrDNA和gyrB基因序列比對結果
Table2Comparisonof16SrDNAandgyrBgenesequencesfromtheisolatedstrainsandstandardstrains
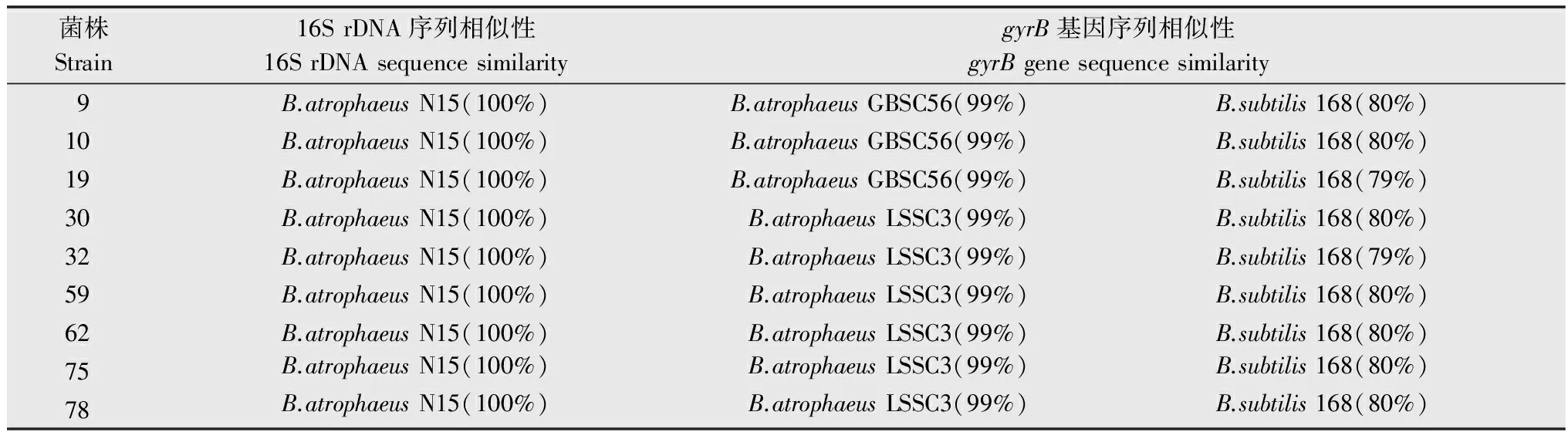
菌株Strain16SrDNA序列相似性16SrDNAsequencesimilaritygyrB基因序列相似性gyrBgenesequencesimilarity9B.atrophaeusN15(100%)B.atrophaeusGBSC56(99%)B.subtilis168(80%)10B.atrophaeusN15(100%)B.atrophaeusGBSC56(99%)B.subtilis168(80%)19B.atrophaeusN15(100%)B.atrophaeusGBSC56(99%)B.subtilis168(79%)30B.atrophaeusN15(100%)B.atrophaeusLSSC3(99%)B.subtilis168(80%)32B.atrophaeusN15(100%)B.atrophaeusLSSC3(99%)B.subtilis168(79%)59B.atrophaeusN15(100%)B.atrophaeusLSSC3(99%)B.subtilis168(80%)62B.atrophaeusN15(100%)B.atrophaeusLSSC3(99%)B.subtilis168(80%)75B.atrophaeusN15(100%)B.atrophaeusLSSC3(99%)B.subtilis168(80%)78B.atrophaeusN15(100%)B.atrophaeusLSSC3(99%)B.subtilis168(80%)
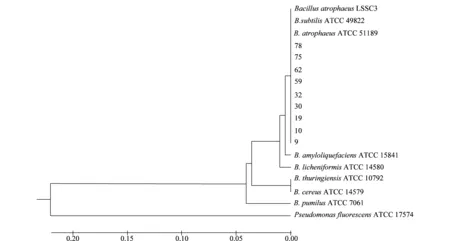
圖4 基于16S rDNA序列構建的系統發育樹Fig.4 Phylogenetic tree based on 16S rDNA sequences
2.7 gyrB基因序列分析鑒定
選擇9株拮抗效果較好的菌株基因組DNA進行gyrB基因擴增,獲得1300 bp的片段。PCR產物純化、測序后,序列比對分析結果表明(詳見表2):菌株9、10、19與B.atrophaeusGBSC56的相似性為99%,菌株30、32、59、62、75、78與B.atrophaeusLSSC3的相似性為99%;菌株9、10、30、59、62、75、78與B.subtilis168的相似性為80%,菌株19、32與B.subtilis168的相似性為79%。系統發育樹構建結果表明(如圖5),拮抗菌株59等9株菌與B.atrophaeusLSSC3聚在一簇,親緣關系最近。

圖5 基于gyrB基因序列構建的系統發育樹Fig.5 Phylogenetic tree based on gyrB gene sequences
2.8 16S rDNA-gyrB基因序列構建系統發育樹
將上述每一種類的標準菌株、待鑒定菌株均按照316 bp的16S rDNA與219 bp的gyrB基因序列的順序拼接在一起得到615 bp的序列,比對結果顯示(表略),菌株59等9株拮抗菌與B.atrophaeusLSSC3的相似性均為99%;菌株9、10、19與B.subtilisATCC 49822/168的相似性為93%,菌株30、32、59、62、75、78與B.subtilisATCC 49822/168的相似性為92%。9株拮抗菌與B.atrophaeus的序列相似性均高于B.subtilis。進行系統發育樹的構建,結果表明(如圖6),拮抗菌株59等9株菌與B.atrophaeusLSSC3聚在一簇,親緣關系最近,說明菌株59等9株拮抗菌為B.atrophaeus,與gyrB基因序列構建系統發育樹結果一致。
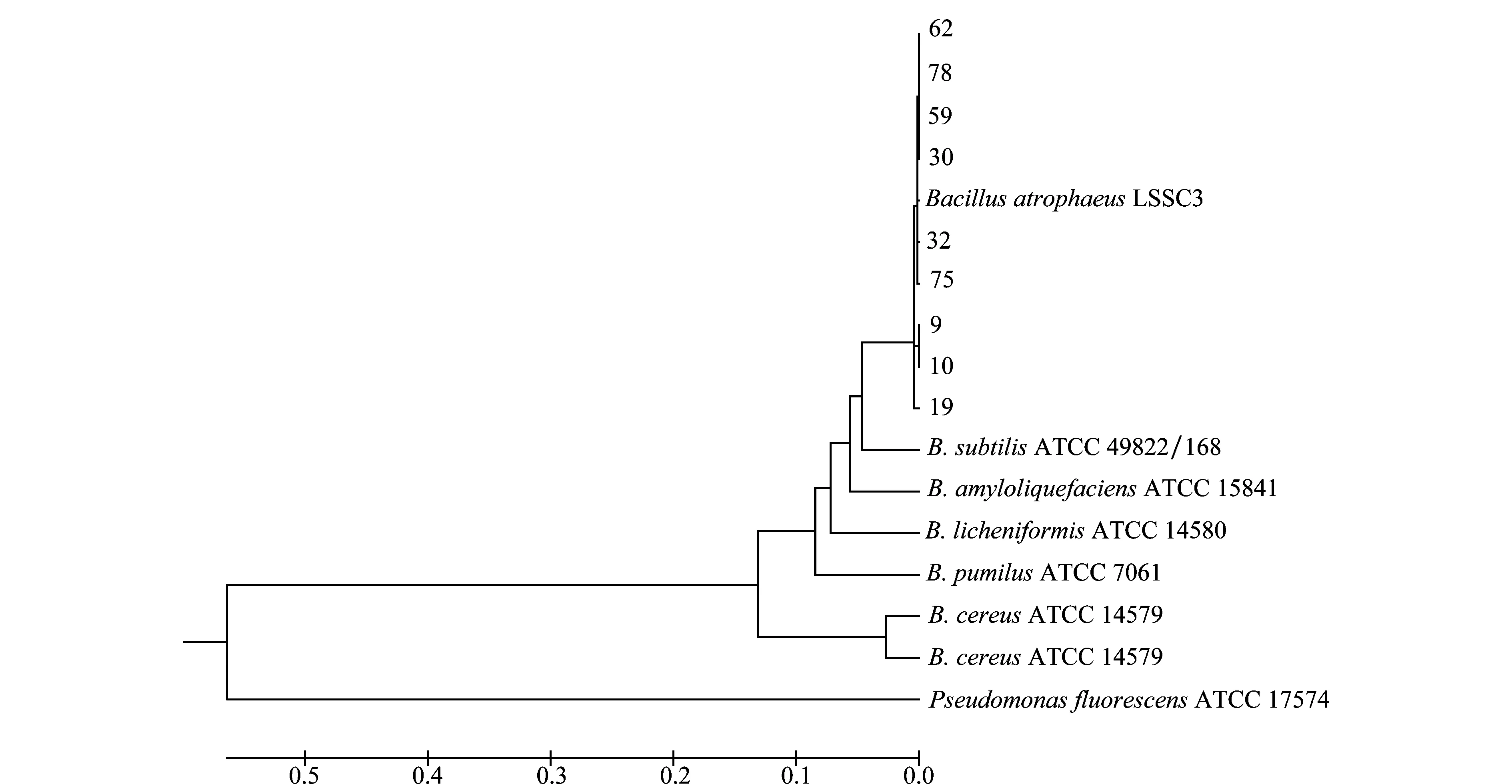
圖6 基于16S rDNA-gyrB基因序列構建的系統發育樹Fig.6 Phylogenetic tree based on 16S rDNA-gyrB gene sequences
3 討論
對棉花黃萎病具有抑制作用的芽胞桿菌已報道多種[11-15],但是對大麗輪枝菌具有拮抗活性的萎縮芽胞桿菌尚未見正式報道。本研究從新疆發病棉田分離到抑菌活性顯著的萎縮芽胞桿菌,分別測定了活菌和發酵濾液的抑菌活性,比較了發酵濾液中抑菌物質的熱穩定性;并測定了該菌產生黑色素的能力,最后運用16S rDNA及gyrB蛋白編碼基因鑒定的方法明確了該菌的分類地位,這是萎縮芽胞桿菌對大麗輪枝菌具有拮抗作用的首次報道。
我們從新疆棉區的棉花根際土壤中篩選對大麗輪枝菌具有拮抗作用的細菌,這些細菌更易于定殖在新疆地區的棉花根際土壤中,有利于發揮抑菌作用。黑色素能夠吸收陽光中的部分紫外線,減少紫外線對細胞的傷害[27]。59號菌在平板和液體培養條件下均能產生黑色素,因此,該菌可能比不產生色素的芽胞桿菌具有更強的抗逆性,更適合在新疆等紫外線較強的地區存活、繁殖。而通過盆栽試驗發現,59號對棉花幼苗生長有顯著的促進作用,對棉花黃萎病有顯著的抑制作用,說明該菌有望成為新的生防資源。分離出的拮抗細菌的發酵液經100 ℃加熱5 min后,有9株樣品仍然具有抑菌活性,推測其中分別含有熱穩定和熱敏感的不同的抑菌物質。根據報道,芽胞桿菌產生的熱穩定性抑菌物質主要為脂肽類化合物[28],而熱敏感抑菌物質多為幾丁質酶、葡聚糖酶[17]等。在以后的工作中,我們將針對抑菌物質進行更加深入的研究。
16S rDNA及gyrB基因鑒定方法已經廣泛地應用于細菌分類鑒定[19-20]。16S rDNA通常能夠鑒定到屬的水平,但是存在一定的局限性:由于16S rDNA具有高度保守性,且分子小、包含的信息量有限,對于親緣關系較近的細菌,其分辨率有限,而在種的分類上仍然需要借助其他手段加以輔助分析。gyrB基因屬于DNA復制、限制、修飾和修復的相關基因[29],微生物中gyrB基因的堿基變異頻率遠高于16S rDNA,因此gyrB基因序列鑒定的方法適用于區分和鑒定親緣關系較近的菌株[21],利用gyrB基因序列分類鑒定的方法能夠得到更準確的結果。此前已有使用16S rDNA與16S-23S ITS基因序列聯合分析的方法對菌株進行鑒定[30],本文嘗試了將16S rDNA和gyrB基因聯合使用的方法,并明確了所分離菌株的分類地位為萎縮芽胞桿菌,這些工作為其他細菌的分類鑒定提供了借鑒。
[1] 李慶基.對防治棉黃萎病根本措施的幾點看法[J].植物保護, 1994, 20(3): 40-41.
[2] Xu F, Yang L, Zhang J, et al.Prevalence of the defoliating pathotype ofVerticilliumdahliaeon cotton in central China and virulence on selected cotton cultivars[J].Journal of Phytopathology, 2012, 160(7-8): 369-376.
[3] Paplomatas E, Bassett D, Broome J, et al.Incidence of verticillium wilt and yield losses of cotton cultivars (Gossypiumhirsutum) based on soil inoculum density ofVerticilliumdahliae[J].Phytopathology, 1992, 82(12): 1417-1420.
[4] Hanson L.Reduction of verticillium wilt symptoms in cotton following seed treatment withTrichodermavirens[J].Journal of Cotton Science, 2000, 4(4): 224-231.
[5] Pullman G S, DeVay J E, Garber R H, et al.Soil solarization: Effects on verticillium wilt of cotton and soilborne populations ofVerticilliumdahliae,Pythiumspp.,Rhizoctoniasolani, andThielaviopsisbasicola[California][J].Phytopathology, 1981, 71(9): 954-959.
[6] El-Zik K M.Integrated control of verticillium wilt of cotton[J].Plant Disease, 1985, 69(12): 1025-1032.
[7] 李社增, 劉杏忠.利用拮抗細菌防治棉花黃萎病[J].華中農業大學學報, 2001, 20(5): 422-425.
[8] Erdogan O, Benlioglu K.Biological control of verticillium wilt on cotton by the use of fluorescentPseudomonasspp.under field conditions[J].Biological Control, 2010, 53(1): 39-45.
[9] Berg G, Ballin G.Bacterial antagonists toVerticilliumdahliaeKleb[J].Journal of Phytopathology, 2008, 141(1): 99-110.
[10]Li C H, Shi L, Han Q, et al.Biocontrol of verticillium wilt and colonization of cotton plants by an endophytic bacterial isolate[J].Journal of Applied Microbiology, 2012, 113(3): 641-651.
[11]李社增, 鹿秀云, 馬平, 等.防治棉花黃萎病的生防細菌NCD-2的田間效果評價及其鑒定[J].植物病理學報, 2005, 35(5): 451-455.
[12]陳妍, 李紅亞, 李術娜, 等.棉花黃萎病拮抗菌株DS45-2的分離鑒定[J].河南農業科學, 2010(1): 68-72.
[13]張洪濤, 于頻頻, 艾山江 阿布都拉, 等.棉花黃萎病高效拮抗菌XJUL-6的篩選鑒定及其特性研究[J].微生物學報, 2007, 47(6): 1084-1087.
[14]王笑穎, 孟成生, 雷白時.大麗輪枝菌拮抗細菌多粘芽胞桿菌7-4菌株的篩選與鑒定[J].湖北農業科學, 2011, 50(9): 1797-1925.
[15]李佳, 李術娜, 郭曉軍, 等.一株大麗輪枝菌拮抗細菌7-47菌株的分離與鑒定[J].棉花學報, 2009, 21(2): 156-158.
[16]Nakamura L K.Taxonomic relationship of black-pigmentedBacillussubtilisstrains and a proposal forBacillusatrophaeussp.nov.[J].International Journal of Systematic Bacteriology, 1989, 39(3): 295-300.
[17]Shanmugam V, Kanoujia N.Biological management of vascular wilt of tomato caused byFusariumoxysporumsp.lycospersiciby plant growth-promoting rhizobacterial mixture[J].Biological Control, 2011, 57(2): 85-93.
[18]薛鵬琦, 劉芳, 喬俊卿, 等.油菜菌核病生防芽胞桿菌的分離鑒定及其脂肽化合物分析[J].植物保護學報, 2011, 38(2): 127-132.
[19]Woese C R, Kandler O, Wheelis M L.Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, Eucarya[J].Proceeding of the National Academy of Sciences of the United States of America, 1990, 87(12):4576-4579.
[20]Yamamoto S, Harayama S.PCR amplification and direct sequencing ofgyrBgenes with universal primers and their application to the detection and taxonomic analysis ofPseudomonasputidastrains[J].Applied and Environmental Microbiology, 1995, 61(3): 1104-1109.
[21]Dauga C.Evolution of thegyrBgene and the molecular phylogeny of Enterobacteriaceae: a model molecule for molecular systematic studies[J].International Journal of Systematic and Evolutionary Microbiology, 2002, 52(2): 531-547.
[22]沈萍, 范秀榮, 李廣武.微生物學實驗[M].北京:高等教育出版社, 1999.
[23]Zhang B L, Yang T W, Chen T Z, et al.Island cottonGbve1 gene encoding a receptor-like protein confers resistance to both defoliating and nondefoliating isolates ofVerticilliumdahliae[J].PLoS One, 2012, 7(12): e51091.
[24]段曉紅, 毛歆, 彭珍榮.固定化細胞生產黑色素的研究[J].武漢大學學報(自然科學版), 1997, 43(2):249-253.
[25]詹姆布魯克J, 拉塞爾D W.分子克隆實驗指南(精編版)[M].第3版.黃培堂, 譯.北京: 化學工業出版社, 2008.
[26]Brosius J,Palmer M L,kennedy J,et al.Complete nucleotide sequence of a 16S ribosomal RNA gene fromEscherichiacoli[J].Proceeding of the National Academy of Sciences of the United States of America, 1978, 75(10): 4801-4805.
[27]Park T J, Kim J, Kim T K, et al.Characterization of melanin-TiO2complexes using FT-IR and C-13 solid-state NMR spectroscopy[J].Bulletin of the Korean Chemical Society, 2008, 29(12): 2459-2464.
[28]Benitez L B, Velho R V, Lisboa M P, et al.Isolation and characterization of antifungal peptides produced byBacillusamyloliquefaciensLBM5006[J].Journal of Microbiology, 2010, 48(6): 791-797.
[29]Yamamoto S, Bouvet P J M, Harayama S.Phylogenetic structures of the genusAcinetobacterbased ongyrBsequences: comparison with the grouping by DNA-DNA hybridization[J].International Journal of Systematic Bacteriology, 1999, 49(1): 87-95.
IsolationandidentificationofBacillusatrophaeusantagonisticagainstVerticilliumdahliae
Sun Chongsi1, 2,Chen Xiaomin2,Shu Changlong2,Qi Fangjun2,Gao Jiguo1,Zhang Jie2
(1.CollegeofLifeSciences,NortheastAgriculturalUniversity,Harbin150030,China;2.StateKeyLaboratoryforBiologyofPlantDiseasesandInsectPests,InstituteofPlantProtection,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
The purpose of this study is to isolate the bacteria antagonistic toVerticilliumdahliae, an important plant disease, from soil samples collected in cotton fields in Xinjiang Uygur Autonomous Region, and to identify bacterial species and discuss their application prospect.Antagonistic assay on the plates was conducted for the initial screening using strain culture and fermentation filtrate, and then the stability of heat treatment for fermentation filtrate was detected.16S rDNA andgyrBgene sequence analyses were used to classify antagonistic bacteria.Sixty-one strains inhibitingV.dahliaewere obtained.Among them, No.59 strain had highly antagonistic activity toV.dahliae, and could produce pigment.Its fermentation filtrate still kept antagonistic activity after heated at 100 ℃ for 5 min, and the diameter of fungistasis circle of the heated sample was 15.8 mm.The strain was antagonistic againstV.dahliaein pot tests, and promoted growth of cotton seedlings.The results indicated that No.59 strain belonged toBacillusatrophaeusthrough phylogenetic tree analysis based on 16S rDNA combined withgyrBgene sequences.This is the first report thatB.atrophaeushad antagonistic activity againstV.dahliae.
Verticilliumdahliae;Bacillusatrophaeus; 16S rDNA;gyrBgene; identification
2013-04-25
: 2013-07-10
“十二五”國家“863”計劃課題(No.2011AA10A203)
S 476
: ADOI: 10.3969/j.issn.0529-1542.2014.01.005
* 通信作者 E-mail:jzhang@ippcaas.cn; gaojiguo1961@hotmail.com

