單獨皮層電刺激對腦卒中大鼠MAP-2表達水平的影響研究
王嘉慧,李 濤,李承晏,高文蔚
(武漢大學人民醫院 1.放射科;2.神經內科,湖北 武漢430060)
神經調控是一個新興的快速發展的多學科交叉領域,涵蓋醫學、物理學和生物工程學,利用植入性和非植入性技術,依靠電或化學手段調節神經系統功能治療疾病、改善患者生活質量。皮層電刺激是通過神經調控、促進卒中后神經功能康復的一種新的治療腦卒中方法[1-3]。微管相關蛋白-2(MAP-2)是一種微管蛋白調節因子,主要存在于神經元的樹突、胞體和樹突棘中,MAP-2的丟失是神經功能障礙的誘因。為了探究皮層電刺激治療腦卒中的原理,本實驗運用皮層電刺激治療缺血性腦卒中模型大鼠,觀察電刺激對大鼠梗死灶周圍及對側皮層微管相關蛋白-2表達水平的影響。
1 材料與方法
1.1 實驗材料與儀器
Biospec4.7/30超導磁共振成像儀(中國科學院武漢物理與數學研究所,波譜與原子分子物理國家重點實驗室);珊頓石蠟切片機(英國);小鼠抗大鼠MAP-2 IgG (武漢博士德生物工程有限工程);山羊血清(武漢博士德生物工程有限工程);羊抗小鼠FITC熒光二抗(美國Jakson公司)。
1.2 方法
1.2.1 動物選擇和分組 健康成年SPF級雄性SD大鼠共105只,體重250 g左右。采用線栓法制作大腦中動脈阻塞模型后,選擇Bederson評分為1-4分的大鼠進行MRI,篩選24只皮層梗死大鼠,隨機分為電刺激組(cortical electrical stimulation,CES)13只和非刺激組(no stimulation,NS)11只。
1.2.2 刺激器植入術和電刺激治療 兩組大鼠均植入刺激器,刺激器為單級刺激模式,包括一個刺激電極、一對電極和一個脈沖發送器。于造模成功后1周植入。具體方法為:刺激器用環氧乙烷滅菌,模型鼠術前紫外線照射2 h后進行腹腔麻醉,取俯臥位固定于立體定位儀上,正中切口切開頭皮以暴露顱骨,于近梗死灶邊緣部位植入電極并標記。鉆開顱骨至硬膜,將孔擴至1.5 mm左右,挑開硬膜,將刺激電極植入硬膜下梗死邊緣皮質表面。電極的硅膠片用生物膠黏合固定在顱骨表面并密封,分離頸背部皮下組織,將脈沖發生器植入皮下,其中將電極與皮下組織表面貼附。非刺激組不施加電刺激治療,刺激組增加電刺激治療,具體為:刺激器每天8:00-8:30和20:00-20:30開啟,電流為0.65 mA。刺激脈沖是由50,20,5Hz組成的循環脈串,10s一個周期,脈沖寬200μs,電刺激治療持續2周后停止。
1.2.3 標本制備 從刺激器植入時開始,6周后取腦組織放入多聚甲醛固定,24 h后進行冠狀位石蠟包埋連續切片,片厚4 μm,對切片進行連續編號,每個組織在所有腦切片等間隔挑選10張腦片進行染色分析。
1.2.4 微管相關蛋白-2(MAP-2)免疫熒光染色 切片烤片,脫蠟,水化后PBS沖洗3次;抗原修復(微波修復法),室溫冷卻1 h后再PBS沖洗3次,5%山羊血清封閉20 min,滴加小鼠抗大鼠MAP-2一抗,4 ℃過夜后,37 ℃水浴箱復溫,PBS洗片3次,避光加羊抗小鼠FITC熒光二抗后,37 ℃孵育1.5 h,PBS洗片3次,避光封片。
1.2.5 圖像分析 每張切片隨機選取梗死灶周圍及對側相應皮層各5個視野進行照像(光學顯微鏡,400倍),用Image-Pro plus 6.0圖像分析系統測定梗死周邊區及與梗死灶對側相應皮層MAP-2免疫染色陽性細胞所占的單位面積。
1.3 統計學處理

2 結果
2.1 植入式皮層電刺激對缺血性腦卒中大鼠梗死周圍區MAP-2表達水平的影響
研究發現,電刺激組大鼠梗死周圍區MAP-2表達呈代償性的增多,而非刺激組大鼠MAP-2表達稀少。兩組大鼠梗死周圍區MAP-2表達水平差異有顯著統計學意義(t=12.189,P<0.01)。見圖1,圖2。

A為CES組,B為BNS組(SP,×400,標尺:100 μm)
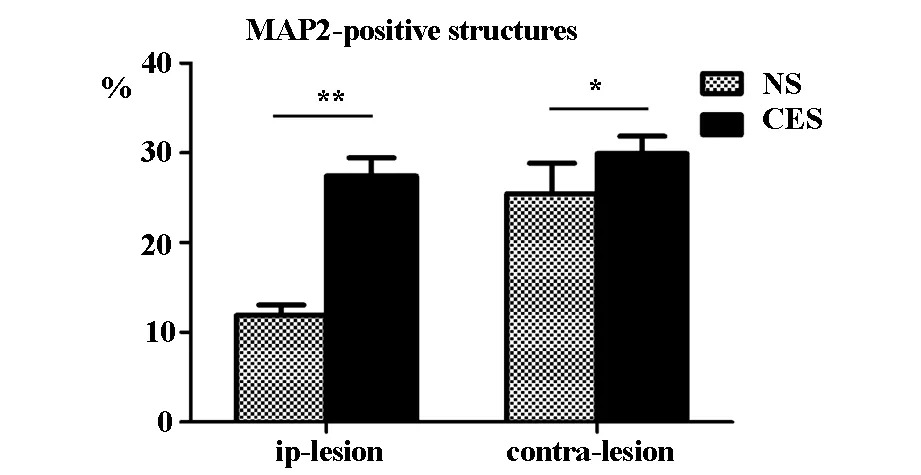
與NS組比較,*P<0.05,**P<0.01
2.2 植入式皮層電刺激對腦梗死大鼠梗死對側半球皮層中MAP-2表達水平的影響
研究發現,與非刺激組相比,電刺激組大鼠梗死對側半球相應皮層中MAP-2表達增加。兩組大鼠梗死對側半球MAP-2表達水平比較差異有統計學意義(t=2.454,P<0.05),見圖2、圖3。
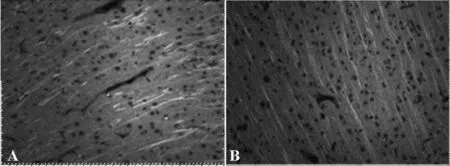
A為CES組,B為BNS組(SP,×400,標尺:100 μm)
3 討論
皮層電刺激是卒中后神經功能康復的一種新的治療腦卒中的方法,其機制尚不清楚。自2003年至今,一些動物實驗和Ⅰ期、Ⅱ期臨床試驗均成功地報道了皮層電刺激作為輔助性治療措施,結合康復訓練治療腦卒中后運動功能障礙的安全性和有效性,使得皮層電刺激可能成為促進腦卒中后神經功能康復的新方法[2-6]。Adkins等[2]將電極植入皮質硬膜外,對康復治療聯合皮層電刺激10天后的行為學研究發現,50 Hz刺激頻率相比250 Hz刺激頻率具有更好治療效果,且能增加微管相關蛋白-2的表達水平。Adkins等[3]則利用100 Hz頻率電刺激聯合康復治療18天,得出了類似的結果,同時電刺激可增加病灶周圍神經元和突觸密度,促進突觸結構可塑性。Kleim等[4]和Teskey等[6]分別用不同刺激參數進行類似實驗,均發現頻率為50-100Hz、強度為域值40%-70%的電刺激能夠顯著提高卒中大鼠運動功能恢復。
以往的皮層電刺激治療缺血性腦卒中大鼠實驗多采用單一頻率脈沖串。本課題組前期采用50、20、5 Hz變頻脈沖串治療缺血性腦卒中大鼠16天,可促進卒中后大鼠運動功能恢復,增加病灶周圍微管相關蛋白-2表達,其可能的機制是:電流達到皮質組織后可以維持和調節腦梗死邊緣區神經組織的興奮性,促進神經功能恢復[7],而變頻脈沖串則可能激活不同部位、不同類型的神經元,達到輔助康復治療的效果[8]。
突觸結構的可塑性是突觸可塑性重要的組成部分,其形態變化的內在機制是突觸可塑性相關蛋白表達水平的改變。微管相關蛋白-2屬于結構性微管相關蛋白家族,是調節微管蛋白組裝及動力學的重要調節因子。微管相關蛋白-2在維持神經元結構、細胞分化及調節神經元功能可塑性中發揮重要作用[9]。微管相關蛋白-2丟失可產生神經元形態和功能的改變。Li等[10]研究發現缺血中心區微管相關蛋白-2免疫反應消失,而長時間再灌注的缺血半暗帶區微管相關蛋白-2出現選擇性的增高,表明病灶周圍突觸結構重建,可能是一種短暫性局灶性腦缺血的補償與修復機制。
本實驗在已有研究基礎上,將觀察時間延長至電刺激治療結束后4周。結果顯示,微管相關蛋白-2在電刺激組大鼠梗死灶周圍及對側皮層表達均要高于非刺激組,表明皮層電刺激可以增加梗死灶周圍及梗死對側皮層神經元軸突密度,從而誘導雙側皮層神經元軸突的可塑性改變,而且這種改變在電刺激治療結束后仍然持續存在。另外,本實驗發現電刺激組與非刺激組大鼠梗死灶周圍微管相關蛋白-2表達較前期實驗差異更顯著,推測隨著時間的延長皮層電刺激誘導神經可塑性改變更明顯。然而,對于皮層電刺激會對梗死側和梗死對側神經元軸突的可塑性均會產生影響的機制尚待研究。Andres等[11]用干細胞移植治療腦梗死時發現干細胞移植可使雙側皮質軸突明顯增加,認為雙側皮層軸突的可塑性改變與損傷側殘存腦組織及對側腦組織間的神經纖維連接回路有關。因此,我們推測皮層電刺激促進雙側皮層的可塑性改變可能與電刺激活化大腦皮質間的神經纖維聯系通路有關。
本研究發現,單獨應用皮層電刺激而不聯合康復訓練對動物腦梗死后肢體功能的恢復亦是有效的。運用全植入式皮層電刺激器可以增加梗死灶周圍和對側皮層微管相關蛋白-2的表達,從而誘導雙側皮層神經元軸突的可塑性改變,并且這種改變在皮層電刺激結束后仍然存在,皮層電刺激可能通過誘導雙側神經元軸突的可塑性來改善腦卒中后運動功能的恢復。
作者簡介:王嘉慧(1987-),女,碩士研究生,住院醫師,主要從事神經病學和放射學的聯合應用研究。
參考文獻:
[1]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84.
[2]Adkins-Muir DL,Jones TA.Cortical electrical stimulation combined with rehabilitative training:enhanced functional recovery and dendritic plasticity following focal cortical ischemia in rats[J].Neurol Res,2003,25(8):780.
[3]Adkins DL,Hsu JE,Jones TA.Motor cortical stimulation promotes synaptic plasticity and behavioral improvements following sensorimotor cortex lesions[J].Exp Neurol,2008,212(1):14.
[4]Kleim JA,Bruneau R,VandenBerg P,et al.Motor cortex stimulation enhances motor recovery and reduces peri-infarct dysfunction following ischemic insult[J].Neurol Res.2003,25(8):789.
[5]Plautz EJ,Barbay S,Frost SB,et al.Post-infarct cortical plasticity and behavioral recovery using concurrent cortical stimulation and rehabilitative training:a feasibility study in primates[J].Neurol Res,2003,25(8):801.
[6]Teskey GC,Flynn C,Goertzen CD,et al.Cortical stimulation improves skilled forelimb use following a focal ischemic infarct in the rat[J].Neurol Res,2003,25(8):794.
[7]Zhou Q,Zhang Q,Zhao X,et al.Cortical electricalstimulation alone enhances functional recovery and dendritic structures after focal cerebral ischemia in rats[J].Brain Res,2010,1311:148.
[8]Baba T,Kameda M,Yasuhara T,et al.Electrical stimulation of the cerebral cortex exerts antiapoptotic,angiogenic,and anti-inflammatory effects in ischemic stroke rats through phosphoinositide 3-kinase/akt signaling pathway[J].Stroke,2009,40(11):e598.
[9]Pettiew L,Holtz ML,Craddoek SD,et al.Microtubular proteolysis in focal cerebral isehemia[J].J Cereb Blood Flow Metab,1996,16(6):1189.
[10]Li Y,Jiang N,Powers C,Chopp M.Neuronal damage and plasticity identified by microtubule-associated protein 2,growth-associated protein 43,and cyclin D1 immunoreactivity after focal cerebral ischemia in rats[J].Stroke,1998,29(9):1972.
[11]Andres RH,Horie N,Slikker W,et al.Human neural stem cells enhance Structural plasticity and axonal transport in the ischaemic brain[J].Brain,2011,134(Pt 6):1777.

