血紅素氧合酶-1介導(dǎo)金櫻子在阿霉素心肌損傷大鼠中的保護(hù)作用
羅衛(wèi)民,劉越峰,羅湘玉,張 軍*
(1.湖北醫(yī)藥學(xué)院附屬十堰市太和醫(yī)院 心胸外科,湖北 十堰442000;2.湖北醫(yī)藥學(xué)院附屬十堰市人民醫(yī)院)
阿霉素(Doxorubicin,DOX) 是一種廣泛應(yīng)用于腫瘤治療的蒽環(huán)類抗生素,是臨床上最有效的抗腫瘤藥物之一。盡管其對(duì)包括白血病在內(nèi)的多種惡性腫瘤具有抑制作用,但其蓄積性不可逆性心肌病以及充血性心衰限制了其使用[1]。DOX導(dǎo)致的毒性心肌病原因很多,其中活性氧(ROS)、鈣超載以及線粒體損傷介導(dǎo)的心肌細(xì)胞凋亡是其重要機(jī)制[2]。近年來,某些藥用植物在DOX所致的心肌細(xì)胞損傷中發(fā)揮重要作用[4],如上調(diào)血紅素氧合酶(Heme oxygenase-1,HO-1)的表達(dá),從而發(fā)揮抗氧化、抗凋亡等作用。金櫻子為薔薇科金櫻子(Rosa Laevigata Michx,RLM)的果實(shí),研究發(fā)現(xiàn)它具有強(qiáng)大的抗氧化和清除自由基能力[5,6]。本課題組的前期研究結(jié)果顯示,RLM對(duì)DOX誘發(fā)的心臟毒性具有一定的保護(hù)作用,但其機(jī)制尚未明了。本研究旨在觀察HO-1在RLM心肌保護(hù)作用中的作用。
1 材料與方法
1.1 主要實(shí)驗(yàn)試劑
DOX購(gòu)自意大利Pharmacia公司(批號(hào)為8NB002-A),血清LDH和CK-MB試劑盒為Stanbio產(chǎn)品。心肌caspase-3的比色測(cè)定試劑盒購(gòu)自Quantikine。HO-1和Nrf2多克隆抗體購(gòu)自Santa Cruz。金櫻子購(gòu)于十堰市中草藥材公司,經(jīng)去籽后用煎藥機(jī)進(jìn)行熬煎,提取液濃度為2.0 g/ml。SnPP和其他分析純?cè)噭┲饕?gòu)自Sigma-Aldrich公司。
1.2 實(shí)驗(yàn)分組
成年雄性Wistar大鼠由湖北醫(yī)藥學(xué)院實(shí)驗(yàn)動(dòng)物部提供,體重(250±5)g,在SPF環(huán)境下給予標(biāo)準(zhǔn)實(shí)驗(yàn)室的水和食物飼養(yǎng)2周。大鼠隨機(jī)分成4組(每組15只),如下:組1:對(duì)照組(15只),大鼠接受等體積的生理鹽水作為陰性對(duì)照;組2: DOX組:大鼠連續(xù)兩周每間隔48h注射DOX(2.5 mg/kg,i.p.) 共6次,使其累積劑量達(dá)15 mg/kg。組3:DOX 治療組:在組2的基礎(chǔ)上,大鼠每日給予RLM(5 g/kg)灌胃,DOX停止后,持續(xù)RLM灌胃4周。組4:SnPP干預(yù)組:在組3基礎(chǔ)上,給予20 μmol/kg SnPP腹腔注射,每周3次,持續(xù)時(shí)間同組3。
1.3 血清CK和LDH活性的測(cè)定
采用分光光度計(jì)在波長(zhǎng)340 nm處測(cè)量CK-MB的吸光度。LDH的測(cè)量按照南京建成生物工程研究所產(chǎn)品提供的診斷試劑盒進(jìn)行,計(jì)算血清總LDH的活性(U/L)。
1.4 心肌HO-1活性測(cè)定
將獲取的心肌組織勻漿18 000×g 4℃離心10 min,獲取400 μl上清加到反應(yīng)混合物中(含0.8 mmol/L NADPH、2 mmol/L葡糖糖-6-磷酸鹽、0.2U葡糖糖-6-磷酸鹽-1脫氫酶、2 mg大鼠肝臟胞漿、100 mmol/L PBS以及10 μmol/L氯化血紅素)。反應(yīng)在黑暗的環(huán)境中37℃孵育1h后加入1 ml氯仿終止反應(yīng)。并在463 nm和530 nm雙波長(zhǎng)測(cè)吸光度值(膽紅素吸光系數(shù)為40),以生成的膽紅素量表示HO-1活性,單位為nmol/(mg protein.h),并計(jì)算其與對(duì)照組的相對(duì)值。
1.5 caspase-3活性測(cè)定
50 mg心肌組織加入0.8 ml pH7.4的裂解緩沖液中制成勻漿。10 000 g 4℃離心15 min。獲取上清用于caspase-3測(cè)定。采用間接法測(cè)定caspase-3活性,基于caspase-3切除底物分子DEVD-pNA中的發(fā)光基團(tuán)pNA,隨后在405nm處測(cè)量其吸光度,從而間接反應(yīng)其活性。
1.6 Western blot檢測(cè)HO-1表達(dá)以及Nrf2核轉(zhuǎn)位
根據(jù)試劑盒(Pierce)提供的步驟提取心肌組織中的總蛋白和核蛋白,并測(cè)定其濃度。獲取100 μg蛋白用于SDS-PAGE。分離的總蛋白或核蛋白隨后轉(zhuǎn)印至PVDF膜上(Millipore),并利用含有質(zhì)量分?jǐn)?shù)為50 g·L-1脫脂牛奶的TBST封閉1 h,隨后加入抗HO-1(1∶500)、β-actin(1∶5 000)、抗Nrf2(1∶1 000),抗TBP(1∶1 000)的抗體4℃孵育過夜。多次洗滌之后,加入HRP標(biāo)記的二抗(1∶10 000 稀釋)孵育膜1 h。ECL法(Amersham)發(fā)光、顯影。
1.7 統(tǒng)計(jì)學(xué)分析
2 結(jié)果
2.1 RLM對(duì)血清CK-MB和LDH水平的影響
與正常組相比,DOX可導(dǎo)致血清LDH和CK-MB增高(P<0.01),與DOX處理組相比, RLM可導(dǎo)致血清LDH和CK-MB水平顯著降低(表1),而SnPP處理組中LDH和CK-MB水平明顯高于RLM組(P<0.05),但與DOX組相比差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。
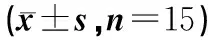
表1 RLM對(duì)血清CK-MB和LDH水平的影響
aP<0.05 VS 對(duì)照組;bP<0.05 VS DOX 組;cP>0.05 VS DOX組
2.2 RLM對(duì)心肌HO-1活性的影響
DOX處理后,與對(duì)照組大鼠相比,心肌組織中HO-1酶活性輕微增高。而經(jīng)5 g/kg RLM處理后,HO-1酶活性顯著增高。而同時(shí)用SnPP處理后,HO-1酶活性明顯低于RLM組,但仍高于對(duì)照組,見圖1。

1.陰性對(duì)照;2.DOX模型組;3.DOX+5 g/kg RLM;4.DOX+5 g/kg RLM+SnPP *P<0.05 VS 對(duì)照組;#P<0.01 VS DOX 組;△P>0.05 VS DOX組
2.3 RLM抑制caspase-3活性
DOX處理后,心肌組織中caspase-3活性增加了55%。同時(shí)經(jīng)5 g/kg RLM處理后,caspase-3活性有所降低,而SnPP處理能再次上調(diào)caspase-3的活性,見圖2。
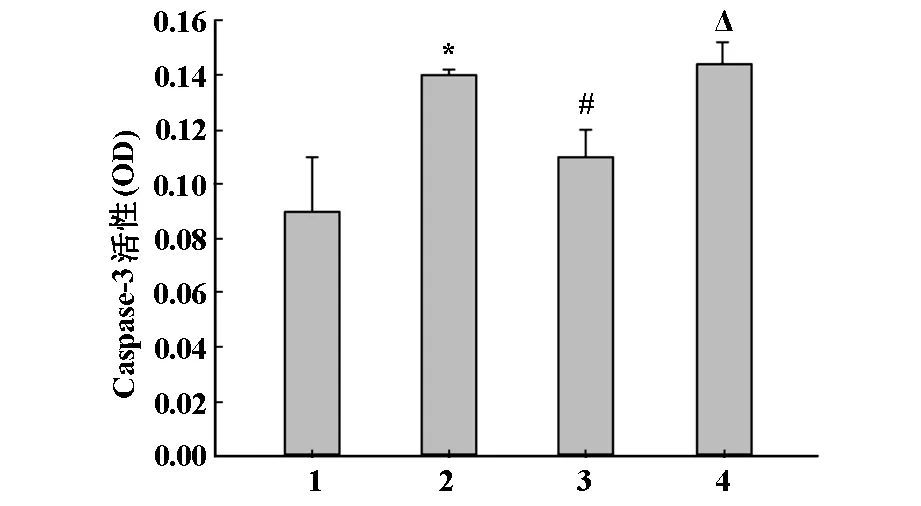
1.陰性對(duì)照;2.DOX模型組;3.DOX+5 g/kg RLM;4.DOX+5 g/kg RLM+SnPP *P<0.05 VS 對(duì)照組;#P<0.01 VS DOX 組;△P>0.05 VS DOX組
2.4 RLM對(duì)心肌組織中HO-1表達(dá)的影響
與對(duì)照組相比,DOX大鼠心肌組織中HO-1蛋白表達(dá)水平有輕微增高,而經(jīng)RLM處理后,HO-1表達(dá)進(jìn)一步增強(qiáng)(圖3)。SnPP處理能再次降低HO-1的表達(dá)。而內(nèi)參β-actin含量保持一致。

1.陰性對(duì)照;2.DOX模型組;3.DOX+5 g/kg RLM;4.DOX+5 g/kg RLM+SnPP
2.5 RLM對(duì)轉(zhuǎn)錄因子Nrf2活化的影響
Western blot結(jié)果顯示,DOX大鼠心肌組織內(nèi)細(xì)胞核中Nrf2含量與對(duì)照組相比增高不明顯,而RLM處理后,Nrf2轉(zhuǎn)位水平顯著增多,表明RLM能促進(jìn)Nrf2從細(xì)胞漿轉(zhuǎn)移至細(xì)胞核中(圖4)。

1.陰性對(duì)照;2.DOX模型組;3.DOX+5 g/kg RLM;4.DOX+5 g/kg RLM+SnPP
3 討論
DOX是一種作用于DNA的蒽環(huán)類抗生素,它能夠?qū)NA發(fā)生嵌入作用,在臨床中應(yīng)用廣泛。阿霉素的急性副作用包括惡心、嘔吐和心律不整。長(zhǎng)期使用后,在線粒體氧化磷酸化作用下,阿霉素和鐵相互作用產(chǎn)生大量活性氧,可以破壞心肌,造成肌原纖維損傷或凋亡。HO-1是催化血紅素降解為CO、亞鐵離子和膽紅素的限速酶,并在機(jī)體的抗炎癥、抗氧化損傷中發(fā)揮重要作用[4],本研究顯示,DOX毒性大鼠經(jīng)RLM處理后,可顯著上調(diào)HO-1的酶活性以及其蛋白表達(dá)。HO-1基因的啟動(dòng)子區(qū)域含有轉(zhuǎn)錄因子Nrf2的結(jié)合位點(diǎn),本研究也證實(shí)RLM能誘導(dǎo)Nrf2從細(xì)胞漿轉(zhuǎn)位至細(xì)胞核,從而激活Nrf2誘導(dǎo)HO-1表達(dá)。
Nrf2是機(jī)體一種重要的獲得性保護(hù)性核轉(zhuǎn)錄因子。在非激活情況下,Nrf2通過與抑制物keap1結(jié)合于細(xì)胞質(zhì)內(nèi)。當(dāng)細(xì)胞受到外源性刺激時(shí),Nrf2從keap1中分離出來,轉(zhuǎn)移至細(xì)胞核內(nèi),從而與應(yīng)激誘導(dǎo)性基因包括HO-1的啟動(dòng)子區(qū)域的抗氧化劑應(yīng)答元件結(jié)合[5]。本研究發(fā)現(xiàn)RLM處理后,Nrf2轉(zhuǎn)位增加,這與心肌組織中HO-1蛋白表達(dá)以及酶活性的趨勢(shì)一致,表明RLM誘導(dǎo)HO-1的表達(dá)可能是由于Nrf2的活化所致。HO-1的代謝產(chǎn)物如CO和膽綠素在多種肺部疾病包括ALI中發(fā)揮抗氧化和抗炎癥作用,包括抑制促炎癥細(xì)胞因子、趨化因子、ROS形成[6]。為了進(jìn)一步評(píng)價(jià)HO-1在RLM的保護(hù)效應(yīng)中的作用,在干預(yù)過程中加入SnPP,對(duì)RLM的保護(hù)作用進(jìn)行了分析。結(jié)果表明,DOX模型大鼠血清LDH和CK-MB顯著增高,而經(jīng)RLM處理后,這些心肌損傷指標(biāo)顯著降低。同時(shí)給予SnPP處理后,能顯著逆轉(zhuǎn)RLM的保護(hù)效應(yīng)。這表明RLM是通過上調(diào)HO-1蛋白的表達(dá)并上調(diào)其酶活性,從而發(fā)揮對(duì)心肌細(xì)胞的保護(hù)作用。
DOX致心肌細(xì)胞損傷的機(jī)制很多,包括離子和自由基假說、代謝機(jī)制和凋亡機(jī)制。心肌細(xì)胞是終末分化細(xì)胞,多種抗腫瘤藥物可引起其壞死或凋亡,從而引起心肌細(xì)胞減少而導(dǎo)致心臟收縮功能不足。研究顯示,DOX可通過內(nèi)源性和外源性機(jī)制引起心肌細(xì)胞凋亡,最終激活下游caspase-3,6和7。一旦caspase被激活,細(xì)胞即進(jìn)入凋亡執(zhí)行階段。本研究發(fā)現(xiàn),RLM可抑制DOX引發(fā)的caspase-3激活,而HO-1抑制劑SnPP處理后,caspase-3活性再次增高,這表明HO-1能在一定程度上削弱DOX的促凋亡效應(yīng),最終抑制DOX引起的心肌細(xì)胞凋亡、壞死及心肌纖維化。
綜上所述,本研究認(rèn)為RLM可以促進(jìn)Nrf2核轉(zhuǎn)位,從而誘導(dǎo)心肌組織內(nèi)HO-1表達(dá)上調(diào),增強(qiáng)其酶活性,進(jìn)而通過HO-1對(duì)DOX導(dǎo)致的心肌細(xì)胞凋亡產(chǎn)生抑制作用。
參考文獻(xiàn):
[1]Du B,An Y,Kang Y,et al.Characteristics of critically ill patients in ICUs in Mainland China[J].Crit Care Med,2013,41(1):84.
[2]Shih CM,Cheng SN,Wong CS,et al.Antiinflammatory and antihyperalgesic activity of C-phycocyanin[J].Anesth Analg,2009,108(4):1303.
[3]Cherng SC,Cheng SN,Tarn A,et al.Anti-inflammatory activity of c-phycocyanin in lipopolysaccharide-stimulated RAW 264.7 macrophages[J].Life Sci,2007,81(19-20):1431.
[4]Deshane J,Chen S,Caballero S,et al.Stromal cell-derived factor 1 promotes angiogenesis via a heme oxygenase 1-dependent mechanism[J].J Exp Med,2007,204(3):605.
[5]Zhang Z,Cui W,Li G,et al.Baicalein protects against 6-OHDA-induced neurotoxicity through activation of Keap1/Nrf2/HO-1 and involving PKCalpha and PI3K/AKT signaling pathways[J].J Agric Food Chem,2012,60(33):8171.
[6]Sarady-Andrews JK,Liu F,Gallo D,et al.Biliverdin administration protects against endotoxin-induced acute lung injury in rats[J].Am J Physiol Lung Cell Mol Physiol,2005,289(6):L1131.
[7]Perl M,Hohmann C,Denk S,et al.Role of activated neutrophils in chest trauma-induced septic acute lung injury[J].Shock,2012,38(1):98.
[8]Lomas-Neira J,Perl M,Venet F,et al.The role and source of tumor necrosis factor-alpha in hemorrhage-induced priming for septic lung injury[J].Shock,2012,37(6):611.
[9]Carnesecchi S,Pache JC,Barazzone-Argiroffo C.NOX enzymes:potential target for the treatment of acute lung injury[J].Cell Mol Life Sci,2012,69(14):2373.
[10]Wang L,Taneja R,Razavi HM,et al.Specific role of neutrophil inducible nitric oxide synthase in murine sepsis-induced lung injury in vivo[J].Shock,2012,37(5):539.
[11]Kwon DJ,Ju SM,Youn GS,et al.Suppression of iNOS and COX-2 expression by flavokawain A via blockade of NF-kappaB and AP-1 activation in RAW 264.7 macrophages[J].Food Chem Toxicol,2013,58:479.
[12]Chung SW,Liu X,Macias AA,et al.Heme oxygenase-1-derived carbon monoxide enhances the host defense response to microbial sepsis in mice[J].J Clin Invest,2008,118(1):239.

