Churg-Strauss綜合征4例誤診的臨床分析
李樹奇 薛 青 焦維克 鄧新宇 吳建輝
臨床資料
一、一般情況
患者4例,男、女各2例,年齡39~83歲,病程5~20年。其中合并高血壓1例,合并鼻竇炎4例。 4例患者雙肺均可聞及不同程度哮鳴音,1例患者軀干部及雙下肢可見散在紅色皮疹。(診斷參考1990年美國風濕病學會制定CSS診斷標準)。4例患者均有呼吸系統受累,除咳嗽、氣喘癥狀外,胸部CT可見雙肺呈游走性、浸潤性病變和實變影。周圍神經受累2例,其中四肢遠端麻木無力者1例,手指呈針刺樣疼痛1例。皮膚受累1例,可見雙下肢及軀干部散在紅色皮疹。骨關節受累1例,表現為雙側膝關節腫痛。肝臟受累1例,ALT、AST輕度增高。腎臟受累2例,尿蛋白及尿隱血陽性,尿素氮和血肌酐正常,見表1。
二、輔助檢查
4例患者末梢血嗜酸性粒細胞計數均明顯升高,最高達19.01×109/L,嗜酸粒細胞百分比均﹥10%,最高達75%。4例患者均行抗中性粒細胞胞漿抗體(antineutrophil cytoplasmic antibody,ANCA)+抗核抗體(antinuclear antibody,ANA)全套檢查。其中2例p-ANCA(核周型抗中性粒細胞胞漿抗體)陽性、1例p-ANCA(核周型抗中性粒細胞胞漿抗體)弱陽性,1例p-ANCA及p-ANCA均呈陽性。4例患者行血總IgE檢查,其中1例患者IgE水平正常,3例患者IgE呈不同程度升高,最高6000 ng/ml,見表2。4例患者肺功能檢查提示中重度阻塞性通氣功能障礙,其中2例患者支氣管舒張實驗陽性。3例患者行病理活檢,其中2例患者行骨髓穿刺檢查提示嗜酸粒細胞比例增高。1例行皮膚活檢提示:慢性炎癥病變,見大量嗜酸性粒細胞、淋巴細胞、組織細胞浸潤呈結節狀,中央壞死呈肉芽腫改變,皮下小血管周圍見大量嗜酸細胞浸潤。2例患者完善神經電生理檢查,神經傳導速度檢查發現運動與感覺神經均受累,相關運動神經傳導速度和感覺神經的傳導速度減慢,波幅下降55%~80%。
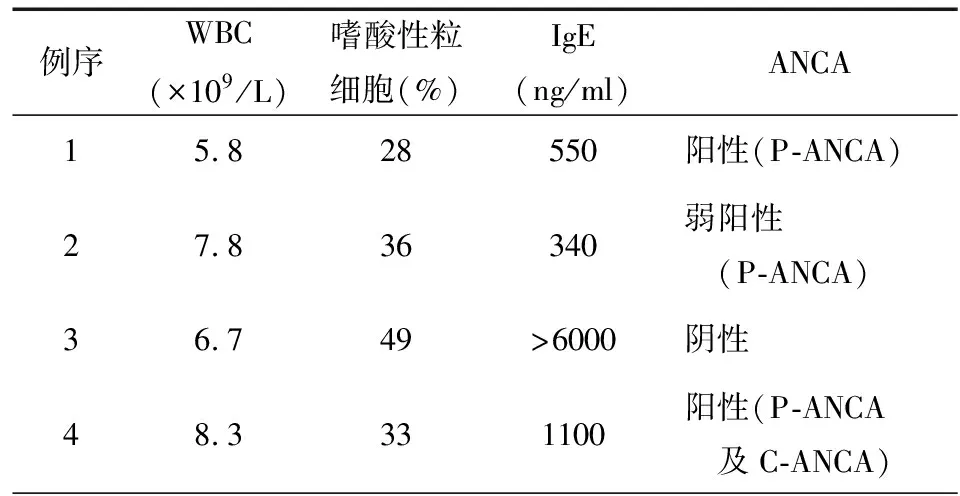
表2 4例CSS輔助檢查資料
三、治療情況
4例患者中,2例分別因咳嗽、咳痰25年及發作性氣喘15年癥狀就診呼吸內科,考慮慢性支氣管炎及單純支氣管哮喘,予以止咳、化痰、平喘等治療,上述癥狀反復,進一步完善相關檢查考慮CSS,予以改用口服激素治療咳嗽、氣喘明顯好轉。1例患者因四肢肢端麻木20年就診神經內科,當地醫院考慮周圍神經病變,予以營養神經等治療,四肢麻木反復,漸出現氣喘,后轉診我院呼吸內科完善相關檢查后考慮CSS予以加用全身激素治療,四肢麻木及氣喘癥狀逐漸改善。1例患者因雙側膝關節腫痛5年多次就診我院風濕科,考慮骨性關節炎,予以止痛對癥等治療,膝關節疼痛無明顯改善,并出現咳嗽、氣喘,經呼吸內科會診后考慮CSS,予以大劑量糖皮質激素+環磷酰胺( CTX )治療,上述癥狀明顯好轉。4例患者隨訪至今,1例患者自行停藥后病情反復,1年前死于腎衰竭,其余3例患者病情穩定,激素逐步減量治療。
討 論
Churg-Strauss綜合征(Churg-Strauss syndrome,CSS)又稱為變應性肉芽腫血管炎,表現為全身小至中等血管壞死性血管炎、血管內外肉芽腫形成、外周血嗜酸粒細胞增多以及組織及血管周圍嗜酸粒細胞浸潤。該病常為全身多器官受累,包括肺臟、心臟、神經系統、腎臟和皮膚等,國外報道年發病率為0.5~4.2/百萬人[1],其病理學特征主要為小血管(動脈和靜脈) 壞死性血管炎及血管內外肉芽腫形成并伴有嗜酸粒細胞浸潤。

表1 4例CSS患者臨床資料
CSS的臨床過程大致分為3個階段: 前驅期、嗜酸粒細胞浸潤期和血管炎期。前驅期常表現為哮喘樣發作,部分患者伴有過敏性鼻炎或鼻竇炎。嗜酸粒細胞浸潤期表現為受累器官或系統的組織中嗜酸粒細胞浸潤及肉芽腫形成,血管炎期主要表現為壞死性血管炎相應表現,但前驅期和血管炎期可重疊存在。CSS的全身癥狀無明顯特異性,主要包括: 發熱、體重下降、周身不適、乏力、關節腫痛等。周圍神經受累的表現形式以單肢不對稱性多發性神經病多見。
嗜酸粒細胞絕對或相對增高是CSS最突出的表現之一,其外周血比例通常高于0. 1或絕對值大于1.5×109/L,部分患者伴有血IgE水平升高,偶見類風濕因子和抗核抗體滴度的輕度升高[2]。CSS 患者ANCA可呈陽性,陽性比例約40%。核周型( pANCA) 和胞漿型(cANCA)均可呈現陽性,但以pANCA陽性多見。1990年美國風濕病學會制定診斷標準:①哮喘;②不論周圍血白細胞總數多少,嗜酸粒細胞超過10%;③單神經炎(包括多神經炎)或多發性神經炎;④X線表現為非固定的肺部浸潤;⑤鼻旁竇異常;⑥活檢示血管以外的嗜酸粒細胞浸潤。這6條標準中符合4條及以上者可診斷CSS[3]。但后續仍有學者在不斷對其完善[4],其中2002年日本學者認為對于該病診斷病理學并非必須,但有組織學所見的病例為變應性肉芽腫性血管炎(allergic granulomatous angiitis,AGA),而只有臨床表現的病例稱為CSS[5]。目前該病病因及機制至今尚未明確,Pagnoux等[6]認為其發病機制認為與IgE 介導的免疫異常、ANCA(尤其抗MPO 抗體)、嗜酸粒細胞等因素有關。
目前臨床上治療該病主要應用糖皮質激素,必要時合并免疫抑制劑環磷酰胺,周圍神經病變癥狀明顯的患者采用血漿置換同時靜脈注射免疫球蛋白,可減輕血管炎性神經損害[6]。
CSS易誤診的原因可能有:①CSS的臨床表現復雜,缺乏特異性臨床表現,且在疾病發展過程中不同癥狀可單獨或重疊出現,臨床醫師缺乏對該病全面系統認識,未重視患者動態隨訪;②CSS的首發癥狀多種多樣,收治科室比較分散,本組報告4例患者以不同首發癥狀,就診于呼吸內科、神經內科、風濕科等,限制了該病全面系統診斷,易導致誤診;③目前臨床學科過細,只注重本學科領域臨床表現,缺乏全面系統判斷。本組報道4例患者簡單診斷為單純支氣管哮喘、周圍神經病變、關節炎等,導致臨床誤診誤治。故對于以下患者:①臨床表現為哮喘樣發作、過敏性鼻炎等變態反應性疾病,治療效果較差,伴隨或漸出現腎臟、皮膚、心血管系統等多器官損害;②肺內多發病灶,呈游走斑片狀或結節狀浸潤陰影,趨向融合;HRCT可見不規則衛星灶樣的擴張血管影;③血嗜酸性粒細胞升高,ANCA陽性[7],應考慮CSS可能,及時行相關檢查或多學科會診進一步明確診斷、及時治療。
參 考 文 獻
1 WattsRA,Lane S,Scott DG. What is known about the epidemiology of the vasculitides?[J]. Best Pract Res Clin Rheumatol,2005,19(2): 191-207.
2 趙 立. Churg-Strauss綜合征[J]. 中國實用內科雜志,2008,28(8): 628-629.
3 Masi AT,Hunder GG,Lie JT,et al. The American College of Rheumatology 1990 ctiteria for the classification of Churg-Strauss syndrome(allergic granulomatosis angiitis)[J]. Arthritis Rheum,1990,33(88): 1094-1100.
4 WattsR,Lane S,Hanslik T,et al. Development and validation of aconsensusm ethodology for the classification of the ANCA associated vasculities and polyarteritis nodosa for epidemiological studies[J]. Ann Rheum Dis,2007,66(2): 222- 227.
5 宗田良,萬獻堯. Churg-Strauss綜合癥[J]. 日本醫學介紹,2002,23(4): 171-174.
6 Pagnoux C,Guilpain P,Guillevin L. Churg-Strauss syndrome[J]. Curr Opin Rheumatol,2007,19(1): 25-32.
7 馮晨璐,曾慶玉,平曉佳,等. 變應性肉芽腫性血管炎胸部CT表現與病理對照[J]. 中國醫學影像技術,2009,25(12):2319-2320.

