結腸癌組織中SLP-2蛋白的表達及SLP-2基因對HCT-116細胞侵襲、遷移力的影響
張 劍,吳 敏,張自森,王利娟,張紅巧,師廣勇,巴 楠,閆 琳,鄭曉珂,邢 鑫
鄭州大學第五附屬醫院腫瘤科 鄭州 450052
結腸癌組織中SLP-2蛋白的表達及SLP-2基因對HCT-116細胞侵襲、遷移力的影響
張 劍△,吳 敏,張自森,王利娟,張紅巧,師廣勇,巴 楠,閆 琳,鄭曉珂,邢 鑫
鄭州大學第五附屬醫院腫瘤科 鄭州 450052
△女,1977年6月生,碩士,主治醫師,研究方向:消化道腫瘤,E-mail:bluemoon630@163.com
結腸癌;SLP-2;siRNA;HCT-116細胞
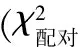
結腸癌是常見的消化系惡性腫瘤, 其在歐美國家發病率較高, 在發展中國家發病率較低, 但近30 a來, 隨著生活水平及飲食習慣的改變, 我國結腸癌的發病率和病死率明顯升高。SLP-2基因屬于stomatin基因家族成員,是最近發現的一個新基因[1]。近年來的研究[2-6]顯示,SLP-2在多種惡性腫瘤組織中過表達,可能是一個新的腫瘤相關基因。該研究采用免疫組化法檢測SLP-2蛋白在人結腸癌組織中的表達情況,并通過小干擾RNA(small interfering RNA, siRNA)下調結腸癌細胞HCT-116中SLP-2的表達,檢測轉染后HCT-116細胞中SLP-2的表達情況及細胞侵襲、遷移力的變化,旨在探討結腸癌組織中SLP-2的表達特點及SLP-2對結腸癌細胞的影響。
1 材料與方法
1.1結腸癌組織中SLP-2蛋白的表達
1.1.1 病例來源 結腸癌組織及距離癌組織邊緣>5 cm的癌旁正常結腸組織為鄭州大學第五附屬醫院2010年1月至2011年1月手術切除結腸癌標本,共50例患者,其中男27例,女23例;年齡40~72歲,中位年齡63歲,≤50歲21例,>50歲29例;腫瘤直徑≤5 cm 32例,>5 cm 18例;高-中分化35例,低分化15例;有淋巴結轉移34例,無淋巴結轉移16例;TNM分期Ⅰ+Ⅱ期13例,Ⅲ+Ⅳ期37例。所有患者均經病理學檢查確診為結腸癌,術前未接受過放、化療。
1.1.2 結腸癌組織中SLP-2蛋白表達的測定 鼠抗人SLP-2單克隆抗體稀釋度為1:200,購自美國Proteintech公司。免疫組化試劑盒購自邁新公司。用已知陽性切片作為陽性對照,用PBS代替一抗作為陰性對照。操作步驟按試劑盒說明書進行。結果判定標準參照文獻[7],由2位高年資病理科醫師在雙盲條件下進行評分,每張切片選取5個100倍視野進行觀察,根據陽性細胞百分比及陽性細胞染色程度進行評分。細胞染色評分:無著色,0分;淺黃色,1分;黃色,2分;棕黃色,3分。陽性細胞百分比評分:無陽性細胞,0分;陽性細胞百分比<25%,1分;25%~,2分;50%~,3分;75%~,4分。2項評分相乘為總分,≥8分為高表達,<8分為陰性或低表達。
1.2SLP-2siRNA轉染后HCT-116細胞中SLP-2mRNA及蛋白的表達
1.2.1 細胞培養 結腸癌細胞系HCT-116購自上海中國科學院典型培養物保藏委員會細胞庫。用含青霉素、鏈霉素和體積分數10%胎牛血清的RPMI 1640培養液于37 ℃、體積分數5% CO2培養箱中培養,3~5 d傳代1次。
1.2.2 siRNA轉染 SLP-2 siRNA序列:上游5’-UGCUGCCUGAUUUAUCUGUUCAGCC-3’,下游5’-GGCUGAACAGAUAAAUCAGGCAGCA-3’,由上海吉瑪公司設計合成。細胞按5×104孔-1接種于24孔板上。參考LipofectamineTM2000 說明書, 50 μL的RPMI 1640無血清培養液中加入20 pmol SLP-2 siRNA混勻,混勻Lipofectamin試劑,用50 μL無血清的RPMI 1640培養液稀釋1 μL Lipofectamin試劑,混勻。將稀釋好的SLP-2 siRNA和Lipofectamin試劑混合,輕柔混勻,室溫放置20 min,以形成siRNA/Lipofectamin復合物。將以上混合液加到含有細胞和培養基的培養孔中,在體積分數5% CO2培養箱中37 ℃溫育24 h后更換完全培養基繼續培養。實驗設陰性對照組和空白對照組。實驗重復3次。
1.2.3 RT-PCR及Western blot檢測 于轉染后48 h收集細胞,進行RT-PCR及Western blot檢測。①SLP-2擴增片段長度500 bp,上游引物5’-CTG GAGCCTGGTTTGAACAT-3’,下游引物5’-AGGATCT GGGCCTGTTTCTT-3’;內參β-actin擴增片段長度242 bp,上游引物5’-ACACTGTGCCCATCTACGACC-3’,下游引物5’-AGGGGCCGGACTCGTCATAGA-3’。引物均由上海生工生物工程技術服務有限公司合成。PCR反應體系:2×Taq PCR MasterMix 12.5 μL,SLP-2及內參上、下游引物(10 μmol/L)各 1 μL,cDNA 2 μL,ddH2O補至25 μL。PCR反應條件:94 ℃預變性5 min;94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸50 s,共30個循環;72 ℃延伸7 min。擴增產物經15 g/L瓊脂糖凝膠電泳,凝膠成像儀掃描電泳圖,以SLP-2與β-actin條帶灰度值的比值表示SLP-2 mRNA的相對表達量。②抗β-actin單克隆抗體及二抗均購自美國Santa Cruz公司。提取HCT-116細胞總蛋白,經120 g/L SDS-PAGE電泳,穩流冰浴電轉膜,分別與抗辣根過氧化物酶連接、孵育,DAB顯色。采用Image分析軟件分析條帶的灰度值。以SLP-2與β-actin條帶灰度值的比值表示SLP-2蛋白的相對表達量。
1.3SLP-2siRNA轉染對HCT-116細胞遷移力的影響用胰蛋白酶消化轉染48 h后的各組HCT-116細胞,計數后用無血清RPMI 1640培養液稀釋,調整細胞密度為1×107mL-1。在24孔Transwell小室(美國Costar公司)內下層加入含體積分數10%胎牛血清的培養液500 μL,上室加入細胞懸液200 μL,置細胞培養箱培養36 h。棄去上室液體,用棉簽拭去未穿過濾膜的細胞,經固定液固定,結晶紫染色。選擇5個200倍視野,計數移至微孔膜下層的細胞數,取平均值表示細胞遷移能力。實驗重復3次。
1.4SLP-2siRNA轉染對HCT-116細胞侵襲力的影響在冰浴條件下取400 μL無血清培養液,加入50 μL Matrigel基質(美國BD公司),混勻后加入24孔Transwell小室的聚碳酯膜上各100 μL,Transwell小室置細胞培養箱中孵育30 min以上,使Matrigel基質成固態。細胞加入、固定、染色等步驟同1.3。選擇5個200倍視野,計數移至微孔膜下層的細胞數,取平均值表示細胞侵襲力。實驗重復3次。
1.5統計學處理采用SPSS 13.0進行統計分析。結腸癌及配對正常組織中SLP-2蛋白表達的比較采用配對χ2檢驗,結腸癌組織中SLP-2蛋白的表達與臨床病理特征的關系采用χ2檢驗進行分析,轉染SLP-2 siRNA后各組HCT-116細胞SLP-2 mRNA和蛋白的表達量以及細胞遷移、侵襲能力的比較采用單因素方差分析和LSD-t檢驗。檢驗水準α=0.05。
2 結果


圖1 正常結腸黏膜(A)及結腸癌(B)組織中SLP-2蛋白的表達(SP,×100)

表1 正常結腸黏膜及結腸癌組織中SLP-2蛋白的表達 例
2.2SLP-2蛋白表達與結腸癌臨床病理特征的關系結果見表2。
2.3SLP-2siRNA轉染后HCT-116細胞中SLP-2mRNA及蛋白的表達結果見圖2、3和表3。
2.4轉染SLP-2siRNA后HCT-116細胞遷移、侵襲力的變化結果見圖4、表4。
表2SLP-2蛋白表達與結腸癌臨床病理特征的關系例
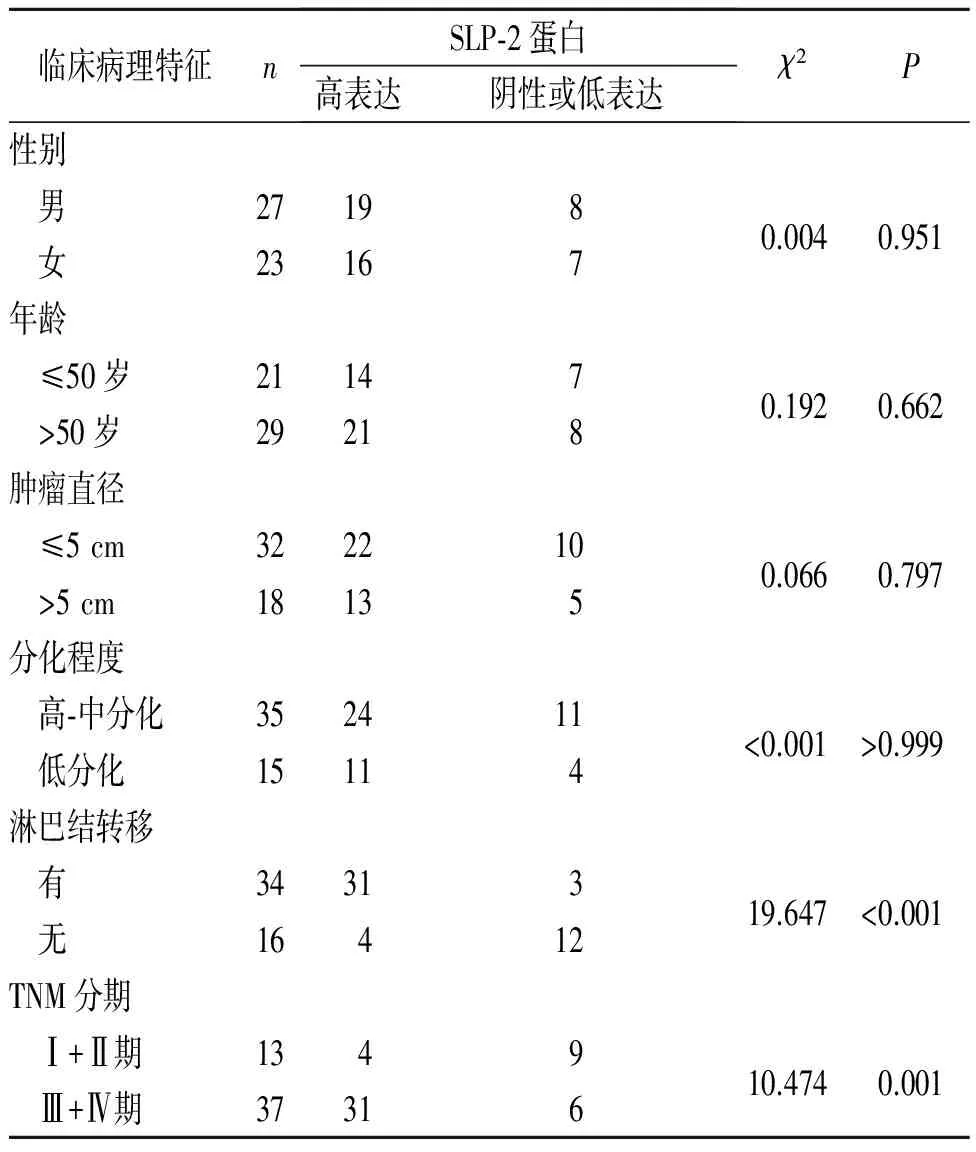
臨床病理特征nSLP?2蛋白高表達陰性或低表達χ2P性別男271980.0040.951女23167年齡≤50歲211470.1920.662>50歲29218腫瘤直徑≤5cm3222100.0660.797>5cm18135分化程度高?中分化352411<0.001>0.999低分化15114淋巴結轉移有3431319.647<0.001無16412TNM分期Ⅰ+Ⅱ期134910.4740.001Ⅲ+Ⅳ期37316

圖2 轉染48 h后各組HCT-116細胞中SLP-2 mRNA的表達
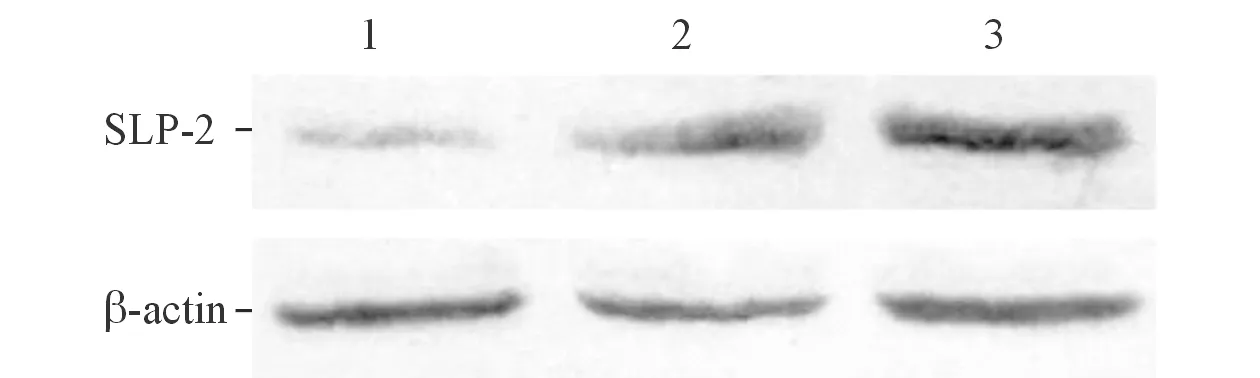
圖3 轉染48 h后各組HCT-116細胞中SLP-2蛋白的表達
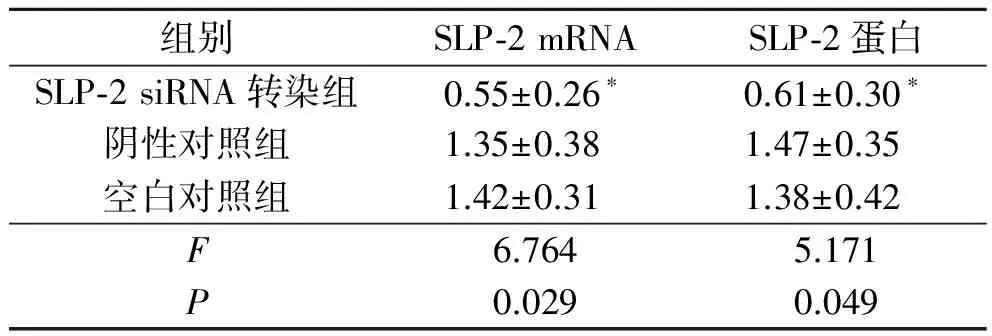
表3 轉染48 h后各組HCT-116細胞中SLP-2 mRNA及蛋白的表達(n=3)
*:與其他2組比較,P均<0.05。
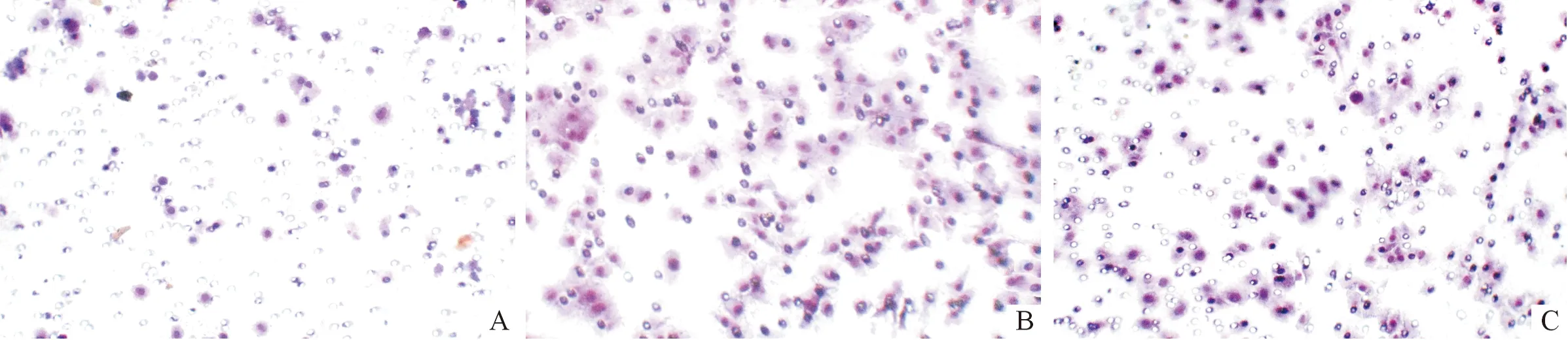
圖4 SLP-2 siRNA對HCT-116細胞體外侵襲力的影響(結晶紫染色,×200)
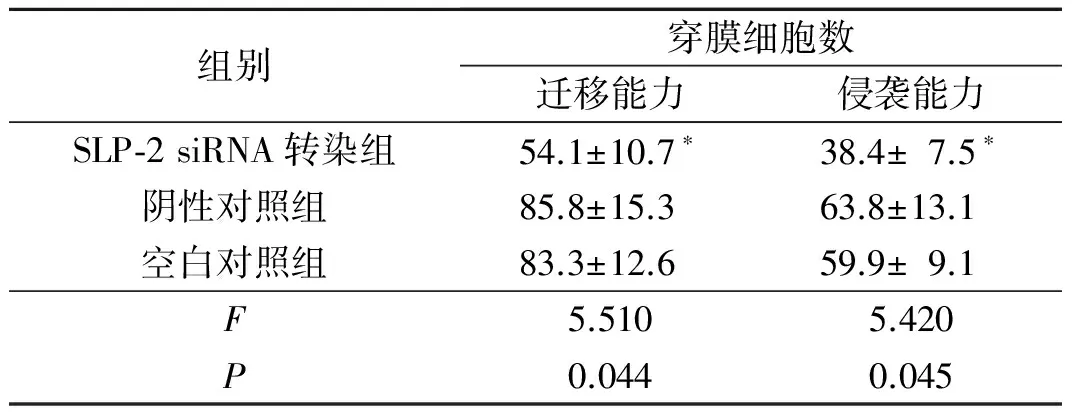
表4 3組SLP-2 siRNA對HCT-116細胞遷移能力和侵襲能力的影響(n=3)
*:與其他2組比較,P均<0.05。
3 討論
SLP-2基因是2000年首次發現并命名的一個新基因,在多種惡性腫瘤組織中呈高表達,可能是一個新的惡性腫瘤相關基因。該研究發現,結腸癌組織中SLP-2呈高表達,而且其高表達與結腸癌TNM分期和淋巴結轉移有關,提示SLP-2可能參與結腸癌的侵襲、轉移。為進一步明確SLP-2對結腸癌侵襲、轉移的影響,設計合成SLP-2 siRNA,將其轉染結腸癌細胞HCT-116,結果顯示轉染SLP-2 siRNA后HCT-116細胞體外遷移和侵襲能力均較對照組減弱。由此推測,SLP-2基因可能促進結腸癌細胞的侵襲和轉移。
綜上,該研究發現SLP-2蛋白在結腸癌組織中表達升高,并發現SLP-2可能參與促進結腸癌細胞的侵襲和遷移。該結果對尋找新的判斷結腸癌預后的指標及發現新的結腸癌治療的分子靶點具有一定意義。
[1]Wang Y, Morrow JS. Identification and characterization of human SLP-2, a novel homo-logue of stomatin (band 7.2b) present in erythrocytes and other tissues[J]. J Biol Chem, 2000, 275(11):8062
[2]張劍,李建生,吳敏,等.SLP-2在胃癌組織中的表達及對胃腺癌細胞SGC7901運動侵襲的影響[J].中華消化雜志,2013,33(1):37
[3]Chang D,Ma K,Gong M,et al.SLP-2 overexpression is associated with tumour distant metastasis and poor prognosis in pulmonary squamous cell carcinoma[J].Biomarkers,2010,15(2):104
[4]Liu DN,Zhang L,Shen ZY,et al.Increased levels of SLP-2 correlate with poor prognosis in gastric cancer[J].Gastric Cancer,2013,16(4):498
[5]Cao WF,Zhang B,Li J,et al.SLP-2 overexpression could serve as a prognostic factor in node positive and HER2 negative breast cancer[J].Pathology,2011,43(7):713
[6]張劍,李建生,吳敏,等.胃腺癌組織中SLP-2的表達及其對SGC7901細胞增殖能力的影響[J].鄭州大學學報:醫學版,2013,48(1):73
[7]Wang YQ, Cao WF, Yu ZC, et al. Downregulation of a mitochondria associated protein SLP-2 inhibits tumor cell motility, proliferation and enhances cell sensitivity to chemo-therapeutic reagents[J]. Cancer Biol Ther, 2009, 8(17):1651
(2013-11-26收稿 責任編輯姜春霞)
Expression of SLP-2 protein in colorectal cancer tissue and its effects on migration and invasion of HCT-116 cells
ZHANGJian,WUMin,ZHANGZisen,WANGLijuan,ZHANGHongqiao,SHIGuangyong,BANan,YANLin,ZHENGXiaoke,XINGXin
DepartmentofOncology,theFifthAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
coloretal cancer; SLP-2; siRNA; HCT-116 cell
10.13705/j.issn.1671-6825.2014.04.019
R73-3

