一種靶向TGR5的膽汁酸類化合物的18F標記與初步評價
賈麗娜,江大衛,程登峰,張 嵐
1.中國科學院 上海應用物理研究所 放射化學與工程技術部,上海 201800;2.中國科學院大學,北京 100049;3.復旦大學 附屬中山醫院,上海 200032
一種靶向TGR5的膽汁酸類化合物的18F標記與初步評價
賈麗娜1,2,江大衛1,2,程登峰3,張 嵐1,*
1.中國科學院 上海應用物理研究所 放射化學與工程技術部,上海 201800;
2.中國科學院大學,北京 100049;3.復旦大學 附屬中山醫院,上海 200032
G-蛋白偶聯受體(TGR5)是一類位于細胞膜上的膽汁酸受體,與體內的糖代謝、能量代謝和胰高血糖素樣多肽-1的分泌密切相關。相對于正常組織,TGR5在多種腫瘤組織中過量表達,并與患者的預后相關,是腫瘤診斷、治療和預后評估的一個潛在靶點。因此,利用點擊化學的方法簡單高效的制備了一種靶向TGR5的18F-PET探針[18F]FEA-LCA。該探針具有較高的放射化學產率(66%~74%)、比活度(大于300 PBq/mol)和放射化學純度(大于99%)。[18F]FEA-LCA具有其母體化合物LCA相似的親脂性,并具有良好的體外穩定性。本工作為進一步研究[18F]FEA-LCA作為TGR5過量表達的腫瘤的PET探針奠定了良好的基礎。
膽汁酸;TGR5;18F;石膽酸;PET顯像
膽汁酸是膽汁的主要成分,是在肝細胞內由膽固醇轉化而來的,能夠促進脂肪和脂溶性維生素的乳化和吸收[1]。膽汁酸更是一類重要的信號分子,既能激活各種核受體(如:法尼酯X受體),又能激活細胞膜受體G-蛋白偶聯受體(TGR5)[2]。TGR5又稱BG37或M-BAR,它與體內的糖代謝、能量代謝和胰高血糖素樣多肽-1的分泌密切相關[3-4]。人體中,TGR5在單核細胞、巨噬細胞、腸等高表達,在肺、脾、腎、子宮等中度表達,其他組織中弱表達或不表達[5-6]。TGR5通過多條信號通路調節細胞內的生理活性,它可以通過激活JNK通路調節膽汁酸誘導的肝細胞凋亡[7]。TGR5在單核細胞和巨噬細胞中高表達,可通過提升cAMP濃度阻斷促炎因子的分泌,從而起到抗炎效果[8]。在人胃癌細胞系AGS中,可由TGR5通過HB-EGF機制發生對EGFR的反式激活[9]。研究發現,TGR5在正常胃上皮細胞弱表達,而在胃癌細胞和胃癌腸轉移細胞中高表達,TGR5的表達情況與胃腺癌病人的生存率負相關[10]。在膽管細胞癌[11]、食管癌[12]和結直腸癌[13]中的研究也發現,TGR5相對于正常細胞會過量表達。因此,TGR5是一個非常有潛力的核醫學腫瘤診斷和預后評估靶點。
膽汁酸是TGR5的天然內源性配體,多種膽汁酸可以激活TGR5,激活能力的順序為(非結合型膽汁酸):石膽酸(LCA)>脫氧膽酸(DCA)>鵝去氧膽酸(CDCA)>膽酸(CA)。其中,LCA是最有效的非結合型膽汁酸,半最大效應濃度(EC50)為530 nmol/L[14],是TGR5生理水平的膽汁酸類配體。研究發現,在膽汁酸甾核的C-3和C-24位進行結構修飾后,膽汁酸依然保持了對其受體的識別能力[15]。目前,對于TGR5為靶點的顯像劑的報道很少見并極具潛力,因此,本工作擬通過點擊化學的方法對LCA進行18F標記,并對其體外穩定性進行評價,以期獲得一種能夠對胃癌、膽管癌和結直腸癌等腫瘤靶向性診斷和預后評估的新型PET顯像探針。
1 實驗部分
1.1試劑與儀器
石膽酸(LCA)、炔丙基胺和1-羥基苯并三唑(HOBt),純度均大于98%,上海泰坦化學有限公司;N-(3-二甲氨基丙基)-N′-乙基碳二亞胺鹽酸鹽(EDC·HCl)(純度大于98%)、L-抗壞血酸鈉(sodium L-ascorbate,純度大于99%)、超干乙腈(AcroSeal)、4-二甲氨基吡啶(DMAP)(純度大于99%),比利時Acros公司;疊氮化鈉(NaN3)(純度大于95%),上海景顏化工科技有限公司;4,7,13,16,21,24-六氧-1,10-二氮雙環[8.8.8]二十六烷(K222),法國ABX公司;1-辛醇,梯希愛(上海)化成工業發展有限公司;[18F]F-,上海原子科興藥業有限公司;三乙胺(TEA)、二氯甲烷(CH2Cl2)、五水硫酸銅(CuSO4·5H2O)、N,N-二甲基甲酰胺(DMF)等,國藥集團上海化學試劑有限公司。
400 MHz超導核磁共振波譜儀,瑞士Bruker公司;85-2型恒溫磁力攪拌器,上海閔行江浦儀器廠;RE-52-2旋轉蒸發儀,上海滬西分析儀器廠;TOF-ESI-MS質譜儀,日本島津公司;1100高效液相色譜儀,美國安捷倫公司;SUV-1箱式紫外分析儀,上海科學器材公司。
HPLC分離分析條件:流動相:A水相(含0.1%(體積分數,下同)三氟乙酸);B乙腈(含0.1%三氟乙酸),紫外檢測波長為205 nm,半制備柱:Agilent XDB C18,9.4 mm×300 mm,5 μm,流速:4 mL/min。分析梯度:0→20→21→24→25 min,30%→65%→95%→95%→30% B。
1.2標記前體(3)的合成
標記前體(3)的合成路線示于圖1。攪拌下,于石膽酸(1)377 mg(1 mmol)的30 mL CH2Cl2溶液中依次加入EDC·HCl 230 mg(1.2 mmol)、HOBt 162 mg(1.2 mmol)、三乙胺280 μL(2 mmol),攪拌10 min后加入炔丙基胺(2)82.5 μL(1.2 mmol)。上述反應液在室溫攪拌反應2 d。反應液依次用10 mL水、10 mL飽和碳酸氫鈉溶液、10 mL稀鹽酸各洗1次,再用飽和氯化鈉溶液洗2次(每次10 mL),有機層無水硫酸鈉干燥后,柱層析純化(固定相:層析硅膠75~48 μm;展開劑:石油醚,乙酸乙酯)得白色固體307.5 mg,收率為74.3%,純度大于99%(HPLC)。
1.3參比化合物[19F]FEA-LCA的合成
參比化合物[19F]FEA-LCA的合成示于圖2。

圖1 標記前體的合成路線Fig.1 Synthesis of the labeling precursor

圖2 參比化合物[19F]FEA-LCA的合成路線Fig.2 Synthesis of the reference compound [19F]FEA-LCA
1.3.1對甲苯磺酸氟乙酯(5) 冰浴下,將對甲苯磺酰氯(7.15 g,37.5 mmol)溶于80 mL CH2Cl2中,然后依次加入三乙胺(17.4 mL,125 mmol)和DMAP(0.2 g,1.64 mmol)。充分溶解后緩慢向上述溶液中滴加2-氟乙醇(4)的CH2Cl2(20 mL)溶液,滴加完畢后反應體系在室溫下攪拌反應2 d。反應液過濾,有機相濃縮后柱層析分離(固定相:層析硅膠75~48 μm;流動相:乙酸乙酯、石油醚梯度洗脫)后得到無色油狀物5.4 g。收率為65.3%。
1.3.22-氟疊氮乙烷([19F]FEA) 向化合物對甲苯磺酸氟乙酯(5)(4.26 g,19.54 mmol)的30 mL無水DMF溶液中,加入疊氮化鈉(3.81 g,58.63 mmol),反應混合物在室溫下攪拌反應,TLC監測(V(石油醚)∶V(EtOAC)=1∶5)無對甲苯磺酸氟乙酯時,過濾除去固體后得到[19F]FEA的DMF溶液,產物未進一步純化,直接用于后面的反應。
于是我們得到:拋物線y=ax2+bx+c上有一點C(m,n),直線l與拋物線交于A,B兩點,當∠ACB=90°時,直線l經過一定點
1.3.3參比化合物([19F]FEA-LCA)的點擊合成 磁力攪拌下,向1.5 mL pH=6.0磷酸鹽緩沖液中先后加入130 μL硫酸銅溶液(0.45 mol/L)和80 μL抗壞血酸鈉溶液(1.5 mol/L),混勻后加入化合物3(20 μmol,8.3 mg)的DMF溶液(1 mL),10 min后加入[19F]FEA的DMF溶液(100 μmol,155 μL),50 ℃攪拌反應3 h。冷卻至室溫,反應液加20 mL水稀釋,產物用氯仿萃取3次(每次15 mL)。合并有機層,用飽和氯化鈉溶液15 mL洗有機層,減壓濃縮后得到產物為白色固體,無需純化。m=8.6 mg,收率為85.3%,純度大于99%(HPLC)。
1.4[18F]FEA-LCA的點擊化學合成
[18F]FEA-LCA的合成路線示于圖3。
1.4.12-[18F]氟疊氮乙烷([18F]FEA) [18F]FEA的合成根據文獻[16]的步驟,有少量修改。氮氣保護下,向含有活化后的[18F]F-(370~950 MBq)反應瓶中迅速加入對甲苯磺酸疊氮乙酯(6)(5 mg)的無水乙腈溶液400 μL,95 ℃下密閉反應5~10 min,HPLC檢測標記率。將該反應液在85 ℃用氮氣流輔助蒸餾10 min,冰水浴冷卻下收集蒸餾液。得到[18F]FEA的乙腈溶液約400 μL。

圖3 [18F]FEA-LCA的合成路線Fig.3 Synthesis of [18F]FEA-LCA
1.4.2[18F]FEA-LCA的點擊化學合成 向200 μL pH=6.0磷酸鹽緩沖液中依次加入60 μL硫酸銅溶液(0.45 mol/L)和60 μL抗壞血酸鈉溶液(1.5 mol/L),混勻后加入標記前體3(4.0 mg,9.7 μmol)的DMF溶液(400 μL),渦旋混合1 min后,加入蒸餾冷凝得到的2-[18F]氟疊氮乙烷([18F]FEA)的乙腈溶液(100~185 MBq),振蕩器50 ℃反應15 min。標記產物用HPLC檢測并分離。收集產物峰(tR=23.5 min),減壓濃縮除掉溶劑,用含8%乙醇的PBS(pH=7.4)溶解,無菌濾膜過濾后得到[18F]FEA-LCA的制劑。
1.5脂水分配系數
取10 μL[18F]FEA-LCA的制劑于2 mL離心管中(含有600 μL正辛醇和590 μL PBS),密封好,在室溫下充分渦旋2 min后,高速離心3 min(10 000 r/min),至兩相平衡。用移液器從有機相和水相各取樣100 μL分置于兩只γ計數管中,用γ計數器測定計數。重復取樣測定三次。平行進行兩批次實驗,根據下面公式計算得到平均lgD7.4值。
lgD7.4=lg(N1/N2)
其中:N1,每毫升辛醇的放射性計數率,min-1·mL-1;N2,每毫升緩沖溶液PBS的放射性計數率,min-1·mL-1。
1.6體外穩定性
取[18F]FEA-LCA的制劑(約3.7 MBq,50 μL)分別置于新生牛血清(1 mL)和PBS(1 mL)中,置于37 ℃下,振蕩孵育30、60、180 min后,用HPLC測定其放射化學純度,以觀察其體外穩定性。
2 結果與討論
2.1標記前體(3)的合成表征
文獻報道膽汁酸類化合物在甾核的C-3和C-24進行結構修飾后,依然能被其特異性受體識別。據此,通過一步反應設計制備了標記前體(3),即在LCA的C-24上引入了端炔基,從而可以利用點擊化學反應Cu(I)催化的疊氮化物與端炔的1,3偶極環加成反應(CuAAC)來實現石膽酸的18F標記。標記前體的結構經質譜、核磁氫譜和碳譜表征確認。TOF-ESI-MS:M(C27H43NO2)=413.64(m/z),414.4[M+H]+,436.4[M+Na+],827.8[2M+H+],849.8[2M+Na+]。13C NMR(CDCl3),δ:12.06、18.39、20.83、23.38、24.21、26.42、27.20、28.26、29.19、30.56、31.57、33.31、34.58、35.35、35.45、35.86、36.47、40.19、40.44、42.10、42.76、55.98、56.51、71.56、71.89、79.69、173.11。1H NMR(CDCl3),δ:5.64(br s,1H,NH),4.06(d,1H,C25-αH,J=2.4 Hz),4.04(d,1H,C25-βH,J=2.4 Hz),3.63(m,1H,C3—H),2.3~0.92(m,32H),0.92(s,3H,C19—H),0.64(s,3H,C18—H)。標記前體(3)可獲得較高的收率(74.3%)和純度(大于99%),滿足后面18F標記的應用。
2.2參比化合物的合成([19F]FEA-LCA)
參比化合物的合成參照文獻[16],略有修改。[19F]FEA-LCA通過三步反應制備。點擊反應可在室溫進行,但需要反應過夜,反應時間較長。通過加熱到50 ℃進行此步反應,可極大加快反應速率,且HPLC監測反應無副產物生成,最終產物無需純化,即可獲得較高純度(純度大于99%)。三步反應的收率均較高。參比化合物[19F]FEA-LCA用于標記時所用的HPLC分離分析方法的建立和標記產物的確定。
反應產物經質譜、氫譜、碳譜表征確認。對甲苯磺酸氟乙酯(5),TOF-ESI-MS:M(C9H11FO3S)=218.25(m/z),241.0[M+Na]+,273.1[M+Na+CH3OH]+。1H NMR(CDCl3),δ:7.825~7.797(d,2H,Ar—H,J=8.4 Hz),7.372~7.345(d,2H,Ar—H,J=8.7 Hz),4.664~4.637(m,1H,—CH—F),4.507~4.480(m,1H,—CH—F),4.324~4.297(m,1H,—SO3—CH),4.234~4.207(m,1H,—SO3—CH),2.455(s,1H,—CH3)。[19F]FEA-LCA,TOF-ESI-MS:M(C29H47FN4O2)=502.71(m/z),503.55[M+H]+,525.55[M+Na]+。1H NMR(CDCl3),δ:7.65(s,1H,CH),6.18(br s,1H,NH),4.85(t,1H,—CHF,J=4.8 Hz),4.73(t,1H,—CHF,J=4.8 Hz),4.68(t,1H,CH,J=4.8 Hz),4.61(t,1H,CH,J=4.8 Hz),4.52(d,2H,CH2,J=5.6 Hz),3.62(m,1H,C3H),2.25(m,1H,CH),2.09(m,1H,CH),1.94(m,1H,CH),1.9~0.92(m,29H),0.91(s,3H,C19H),0.64(s,3H,C18H)。13C NMR(CDCl3),δ:173.69、145.15、123.17、82.24、80.52、71.88、56.48、55.97、50.67、42.74、42.10、40.43、40.17、35.85、35.48、35.35、34.82、34.58、33.42、31.62、30.55、28.25、27.19、26.41、24.21、23.38、20.82、18.37、12.03。
2.3[18F]FEA-LCA的點擊化學合成
由于18F具有優良的核性質和化學性質,其半衰期為109.8 min,能滿足多步化學反應的需要,并能監測較慢的生化過程;具有較低的正電子能(649 keV),易于獲得高分辨率的圖像,并且臨床使用更加安全,因此選擇18F對LCA進行了標記合成。
Click合成子[18F]FEA通過對甲苯磺酸疊氮乙酯(6)與18F-親核取代反應制備,并采用氮氣輔助蒸餾純化。通過優化蒸餾溫度(由95 ℃降低為85 ℃)可以減少疊氮前體6的蒸出,從而提高了合成子[18F]FEA的比活度,該步放射化學產率為68%~75%(n=5,衰變校正,含蒸餾步),比活度大于150 PBq/mol。[18F]FEA合成簡單,放射化學產率和比活度高,純化方法簡單快速,純化后可獲得高比活度的產品,對于下一步的Click反應極為有利。
[18F]FEA-LCA通過化合物3與[18F]FEA在Cu(I)催化下通過點擊化學反應制備,反應只需要15 min,標記率大于96%。該法不需要保護基,避免了羥基的保護和脫保護反應。并且由于CuAAC反應具有極高的化學選擇性和優越的區域選擇性,反應中沒有明顯的放射性副產物生成。[18F]FEA-LCA通過與參比化合物產物[19F]FEA-LCA共同HPLC進樣分析確認(圖4)。通過半制備HPLC純化,放射化學產率為90%~95%(n=3,從[18F]FEA計,衰變校正),兩步反應放射化學產率為66%~74%(n=3,從18F-計,衰變校正)。[18F]FEA-LCA的放射化學純度(>99%)和比活度(>300 PBq/mol)均較高。[18F]FEA-LCA總合成時間為70~85 min(含HPLC純化時間)。通過點擊化學對LCA進行18F標記的方法高效可靠,適合于大規模生產。
2.4脂水分配系數
[18F]FEA-LCA的脂水分配系數lgD7.4=1.78±0.05(n=2),保持了膽汁酸類化合物的親脂性。因此[18F]FEA-LCA具有其母體化合物LCA相似的性質。
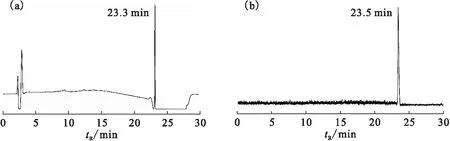
(a)——紫外譜圖(UV trace),(b)——放射性譜圖(γ-trace)

新生牛血清中(In NBCS):(a)——30 min,(b)——60 min,(c)——180 min;PBS中(In PBS):(d)——30 min,(e)——60 min,(f)——180 min
2.5體外穩定性
37 ℃下,[18F]FEA-LCA在新生牛血清和PBS中分別孵育30、60、180 min,其HPLC圖示于圖5。由圖5可知,均未發現脫氟或放射性降解產物,表明[18F]FEA-LCA具有良好的體外穩定性。這對于顯像劑進一步的體內評價奠定了基礎。
3 結 論
通過合成含端炔基的標記前體,并采用點擊化學的方法制備得到了一種潛在的靶向TGR5的PET分子顯像探針([18F]FEA-LCA)。其制備簡單快速,具有較高的放射化學產率、比活度和放射化學純度。[18F]FEA-LCA具有其母體化合物LCA相似的親脂性,并具有良好的體外穩定性,無明顯的脫氟或降解現象,為該PET探針進行進一步的體內評價奠定了良好的基礎。
[1]Russell D W. The enzymes, regulation, and genetics of bile acid synthesis[J]. Annu Rev Biochem, 2003, 72: 137-174.
[2]Fiorucci S, Cipriani S, Mencarelli A, et al. Counter-regulatory role of bile acid activated receptors in immunity and inflammation[J]. Curr Mol Med, 2010, 10(6): F579-595.
[3]Pols T W H, Noriega L G, Nomura M, et al. The bile acid membrane receptor TGR5 as an emerging target in metabolism and inflammation[J]. J Hepatol, 2011, 54(6): 1263-1272.
[4]Katsuma S, Hirasawa A, Tsujimoto G. Bile acids promote glucagon-like peptide-1 secretion through TGR5 in a murine enteroendocrine cell line STC-1[J]. Biochem Biophys Res Commun, 2005, 329(1): 386-390.
[5]Watanabe M, Houten S M, Mataki C, et al. Bile acids induce energy expenditure by promoting intracellular thyroid hormone activation[J]. Nature, 2006, 439 (7075): 484-489.
[6]Cipriani S, Mencarelli A, Chini M G, et al. The bile acid receptor GPBAR-1 (TGR5) modulates integrity of intestinal barrier and immune response to experimental colitis[J]. Plos One, 2011, 6(10): 1-11.
[7]Yang J I, Yoon J H, Myung S J, et al. Bile acid-induced TGR5-dependent c-Jun-N terminal kinase activation leads to enhanced caspase 8 activation in hepatocytes[J]. Biochem Biophys Res Commun, 2007, 361(1): 156-161.
[8]Kawamata Y, Fujii R, Hosoya M, et al. A G protein-coupled receptor responsive to bile acids[J]. J Biol Chem, 2003, 278(11): 9435-9440.
[9]Yasuda H, Hirata S, Inoue K, et al. Involvement of membrane-type bile acid receptor M-BAR/TGR5 in bile acid-induced activation of epidermal growth factor receptor and mitogen-activated protein kinases in gastric carcinoma cells[J]. Biochem Biophys Res Commun, 2007, 354(1): 154-159.
[10]Cao W B, Tian W, Hong J, et al. Expression of bile acid receptor TGR5 in gastric adenocarcinoma[J]. Am J Physiol-Gastroint Liver Physiol, 2013, 304(4): G322-G327.
[11]Keitel V, Reinehr R, Reich M, et al. The membrane-bound bile acid receptor TGR5 (GPBAR-1) is highly expressed in intrahepatic cholangiocarcinoma[J]. Hepatology, 2011, 54: 769A-769A.
[12]Hong J, Behar J, Wands J, et al. Role of a novel bile acid receptor TGR5 in the development of oesophageal adenocarcinoma[J]. Gut, 2010, 59(2): 170-180.
[13]鄭鵬.膽汁酸受體TGR5和FXR在結直腸癌中的表達及臨床意義[D].蘭州:蘭州大學,2012.
[14]Tiwari A, Maiti P. TGR5: an emerging bile acid G-protein-coupled receptor target for the potential treatment of metabolic disorders[J]. Drug Discov Today, 2009, 14(9-10): 523-530.
[15]Pellicciari R, Gioiello A, Costantino G, et al. Back door modulation of the farnesoid X receptor: design, synthesis, and biological evaluation of a series of side chain modified chenodeoxycholic acid derivatives[J]. J Med Chem, 2006, 49(14): 4208-4215.
[16]Jia L N, Cheng Z, Shi L L, et al. Fluorine-18 labeling by click chemistry: multiple probes in one pot[J]. Appl Radiat Isot, 2013, 75: 64-70.
SynthesisandPreliminaryEvaluationof18F-LabeledBileAcidCompoundforTGR5
JIA Li-na1, 2, JIANG Da-wei1, 2, CHENG Deng-feng3, ZHANG Lan1,*
1.Department of Radiochemistry and Engineering, Shanghai Institute of Applied Physics, Chinese Academy of Sciences,Shanghai 201800, China; 2.University of Chinese Academy of Sciences, Beijing 102413, China; 3.Zhongshan Hospital, Fudan University, Shanghai 200032, China
G protein-coupled receptor (TGR5) is a cell-surface bile acid receptor which is closely related to glucose metabolism, energy expenditure and the secretion of glucagon-like peptide-1. TGR5 is a potential target for diagnosis, treatment and prognosis evaluation of the tumors, whose expression is strongly upregulated in many tumors compared to expression levels in normal tissues and is associated with the prognosis of the patients. Therefore, the18F-PET probe [18F]FEA-LCA was prepared with the simply and efficiency click chemistry method with a high radiochemical yield (66%-74%), high radiochemical purity (>99%), and high specific activity (>300 PBq/mol). [18F]FEA-LCA has a similar lipophilicity to the parental bile acid lithocholic acid and a high metabolic stabilityinvitro. This work make a solid foundation for further study the [18F]FEA-LCA as the PET probe to the tumors of TGR5-overexpression.
bile acid; TGR5;18F; lithocholic acid; PET imaging
2013-11-27;
2014-01-20
國家自然科學基金資助項目(No.10875163)
賈麗娜(1985—),女,河北唐山人,博士研究生,主要從事放射性藥物研究
*通信聯系人:張 嵐(1974—),男,安徽淮南人,博士,研究員,主要從事放射性藥物研究,E-mail: zhanglan@sinap.ac.cn
R817
A
0253-9950(2014)04-0247-06
10.7538/hhx.YX.2014.2013076

