化學品生物降解影響因素研究進展
林春駿,劉濟寧,周林軍,石利利*,馮潔
1.南京信息工程大學環境科學與工程學院,江蘇 南京 210044 2.環境保護部南京環境科學研究所,江蘇 南京 210042
化學品的大量生產、使用帶來很多環境污染,已對生態系統及人類健康產生潛在的風險[1]。人體持續地暴露在這些物質下,即使極低濃度,也可能對自身健康產生巨大危害[2]。
生物降解是有機化學品在環境中的主要去除途徑之一。土壤和水體中的微生物(如細菌和真菌)在其生長過程中會以有機化學物質作為碳源,消耗基質中的化學物質使其濃度逐漸降低。
目前各國的新化學物質登記都要求提交化學物質的生物降解性數據,評價其在環境中的持久性。化學品的生物降解性測試普遍采用經濟合作與發展組織(OECD)的《化學品測試導則》中的快速生物降解(301)、固有生物降解(302)以及模擬生物降解方法(303)[3]。但是由于眾多的測試方法測試條件不同,導致化學品的生物降解過程多樣、影響因素復雜,且降解機理尚未完全明了,難以對測試結果進行合理有效的解釋。因此有必要對生物降解機理、生物降解過程、生物降解影響因素進行詳細的研究,從而指導化學品生物降解測試工作。
在化學品生物降解過程中,降解途徑(如生長代謝和共代謝)對化學品的生物降解性影響較大,此外微生物群落、溫度、pH、溶解氧、基質濃度以及化學結構都會對化學品的生物降解性產生影響[4-10]。
筆者闡述了化學品降解過程中生長代謝、共代謝的原理和作用,同時詳細分析了異養和自養微生物在化學品生物降解過程中的作用,以及各自降解酶對降解性的影響,以期為化學品的生物降解測試中化學品降解規律解釋以及提高化學品固有生物降解性測試能力提供指導。
1 化學品在環境中的生物降解途徑
生物降解是將大分子有機化合物轉變成小分子化合物或礦化為二氧化碳、水的復雜過程。在一般生物降解過程中,微生物利用有機物作為細胞生長的主要底物(生長基質),同時誘導酶進行同化作用,該過程一般稱為生長代謝。
化學品在自然環境中濃度一般在ng/L級別[11],很多化學品有毒或抑制微生物生長,微生物可能不利用化學品作為唯一碳源。在這種情況下,微生物可能利用其他物質或碳源,作為生長基質維持微生物的生長并誘導產生酶類,通過共代謝降解化學品,最終促進化學品的生物降解[12]。
化學品在自然界和污水處理廠(sewage treatment plant,STP)中,生長代謝和共代謝這2種降解方式是同時存在的,共同對化學品的去除起著決定性作用。
1.1 生長代謝降解方式
在化學品生長代謝過程中(圖1),微生物利用化學品作為唯一碳源以維持其生物量,同時產生有關的酶和輔酶對其進行氧化/還原。因此,如果化學品以微生物生長代謝的方式進行降解,則該化學品應該對微生物無毒或低毒,且具有足夠高的濃度。
一些學者研究了化學品生長代謝降解途徑。如Murdoch等[13]研究發現,菌株SphingomonasIbu-2能夠將布洛芬(ibuprofen)作為唯一碳源,以生長代謝方式降解。此外,Iasur-Kruh等[14]使用富雌激素降解菌(EDB)的菌株NovosphingobiumJEM-1對雌二醇(EstradiolE2)進行降解試驗,發現該菌株能夠通過生長代謝方式直接降解高濃度的E2(50 mg/L)。其他研究[13-15]發現,以生長代謝方式降解化學品的微生物只有異養細菌,沒有發現自養微生物。
1.2 共代謝降解方式
20世紀50年代,在含氯溶劑、芳香族化合物和石油烴的生物降解試驗中首次發現了共代謝現象[16]。圖2顯示了化學品的共代謝降解方式。許多化學品是有毒的或抑制微生物生長,且該類化學品通常在環境中含量很低。這2個特點使得化學品很難進入微生物細胞進行分解代謝和合成代謝,因此,化學品必須在生長基質或其他可利用的化合物的共同存在下才能進行降解。
進一步研究發現,共代謝能將一些難降解化學品轉化為易降解中間產物[17],但是最終降解產物可能比母體化合物的毒性更強,導致微生物不能進一步降解。Haiss等[18]研究發現,泛影葡胺(diatrizoate)是3,5-二氨基-2,4,6-三碘苯甲酸的好氧生物降解產物,該降解產物具有很強的毒性,不能被常見細菌降解。同樣,Groning等[19]研究發現,雙氯芬酸(diclofenac)很容易被河流沉積物中微生物降解,形成中間產物對苯醌亞胺,但是該中間產物具有毒性,也無法繼續降解。
化學品的共代謝降解過程中發現自養微生物(自養氨氧化菌)的參與,該菌的非特異性酶——氨單加氧酶(AMO)可以氧化大量有機污染物[20]。這主要是因為自養氧化菌能夠利用無機碳和氨作為其生長的能量來源,誘導產生AMO和輔酶因子(煙酰胺腺嘌呤二核苷酸 NAD和煙酰胺腺苷二核苷酸磷酸 NADH)對化學品進行降解[21]。對于異養微生物,降解過程可能為共代謝和/或生長代謝,具體取決于化學品的濃度和其對微生物的毒性[22]。
2 環境條件和化學結構對降解率的影響
化學品的生物降解過程中受到許多非生物因素和生物因素的影響,如溫度、pH、氧含量、生物利用度、生長基質、理化性質、分子結構和毒性等。這些條件可以限制或刺激微生物的生長,影響微生物的生物降解性。在STP中已經發現化學品的生物降解性存在顯著差異。
2.1 溫度影響
溫度會直接影響微生物的活性。微生物需要在合適的溫度范圍內才能生長,如氨氧化菌(AOB)可以在低溫下生長[23],而氨氧化古菌(AOA)在4~25 ℃生長緩慢[24]。
為了研究溫度對AOB和AOA的影響,Wu等[24]研究了AOB和AOA中的amoA因子的豐度變化,發現該因子能夠通過編碼AMO中的A亞單元,氧化氨和各種化學品。經過4周的培養發現,在4 ℃時AOB和AOA的amoA因子相對豐度較低,這可能是在低溫下DNA分解、細胞死亡加劇,生長速率減緩導致的。在37 ℃時,2種微生物中amoA因子豐度發生顯著增加。
Suarez等[25]研究發現,在16~26 ℃內E2和EE2降解結果無顯著差異,表明在正常溫度范圍內,溫度對化學品降解影響差異不顯著。
2.2 pH影響
pH可以影響微生物的生理活性及化學品的溶解度。pH大于10或小于3時會抑制微生物生長,pH也會影響體系中真菌和細菌的比例。Bothe等[26]研究了土壤中的pH對真菌和細菌生長的影響,發現細菌在酸性土壤中(pH為4.5)生物量減少了5倍,而真菌卻增長了5倍,表明細菌在酸性環境中競爭力減弱,不適宜生長,而真菌能夠適應酸性環境,快速增長。
pH能夠改變化學品的離子態和非離子態的比例,離子態部分易溶于水,非離子態部分易吸附于污泥,導致生物可利用性有所差異,最終影響生物降解性[27]。Urase等[28]研究證實,酸性受試物如布洛芬和酮洛芬(ketoprofen)的降解受pH影響明顯,pH越低,降解率越高。如異丁苯丙酸(ibuprofen)在pH<6時降解率能超過90%,酮洛芬在pH<5時降解率也能達到70%。而非電離化學品如異丙安替比林(propyphenazone)、卡馬西平(carbamazepine)的降解率比較恒定,與溶液的pH無關。
2.3 溶解氧的影響
水中的溶解氧(DO)濃度高低,會直接影響微生物的活性和種類,決定微生物的呼吸類型:厭氧、缺氧和好氧呼吸,從而直接影響微生物對化學品的降解能力。何起利等[29]模擬了濕地環境,研究發現DO與基質中細菌、真菌等微生物數量和多酚氧化酶、過氧化氫酶等酶存在顯著的正相關關系,DO濃度直接影響自然環境中污染物的降解能力。Czajka等[23,30]分別在有氧條件下和厭氧條件下對雌激素(17α-炔雌醇[EE2]和17β-雌二醇[E2])的生物降解性進行研究,發現EE2在厭氧條件下未觀察到生物降解,而在好氧測試中E2和EE2表現出了生物降解性。
2.4 化學結構的影響
化學結構直接決定化學品的降解性。Tran等[7]利用富硝化菌對10種化學品進行生物降解試驗,結果表明,分子結構含有一個氯原子及以上的化學品,如氯貝酸(clofibric acid)、雙氯芬酸(diclofenac)、吲哚美辛(dichloprop)降解率很低。
總結化學品的結構和降解性的關系,有以下規律:1)具有吸電子性基團(—SO3,—NO2,—Br,—Cl)的物質比推電子基團(—H,—NH2,—OCH3,—CH3,—COOH,—OH)的物質難降解,吸電子基團降低了氧化酶的親電攻擊性,導致生物利用度降低;2)取代基多的物質比取代基少的物質難降解,這主要是位阻效應也使生物利用度有所差別;3)飽和度高的物質穩定性更高,比飽和度低的物質難降解;4)短鏈烴比長鏈烴難降解,主要是因為長鏈烴的分子鍵更易斷裂。
3 微生物及其酶的影響
化學品降解率受微生物影響顯著,異養生物比自養硝化生物更易降解化學品[31]。筆者主要討論自養氨氧菌和異養細菌、異養真菌和相關代謝酶對生物降解的作用。
3.1 自養氨氧化菌與硝化作用
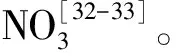
環境中的氨主要由AOA和AOB氧化。AOA的amoA基因相對豐度直接影響STP的氨氧化速率,而AOB的amoA基因和氨氧化速率之間沒有顯著相關性[10]。因此,AOA的amoA基因在STP的氨氧化過程中有著重要作用[34]。
許多有毒的和難降解化學品,如鹵代烴可通過硝化作用被有效地降解[35]。Helbling等[10]研究發現,AOB和AOA可以在氨存在的條件下,以其作為生長底物誘導產生AMO酶并提供還原劑來共代謝降解該類化學品。
3.2 氨單加氧酶共代謝作用
自養氨氧化菌對氨的氧化過程中需要AMO及羥胺氧化還原酶(HAO)2種關鍵酶。AMO催化氨氧化成羥胺(NH2OH)。HAO進一步將NH2OH氧化為亞硝酸鹽。AMO能夠氧化多種化學品如烷烴、烯烴和鹵代烴類化學品[36]。AMO是由A,B和C 3個亞基組成(也稱AMO-A、AMO-B和AMO-C),這3個亞基分別由amo操縱子amoA、amoB和amoC編碼[37]。

Yi等[17]發現了在一定范圍內氨氧化速率和EE2降解率之間呈線性關系:當氨氧化速率從0.3 mmol/(g·h)(以VSS計,下同)增加到5.1 mmol/(g·h)時,EE2的降解率從1.1 μmol/(g·h)提高到4.1 μmol/(g·h)。Helbling等[10]發現,AMO能夠顯著促進化學品的生物降解,且氨氧化率和化學品降解率僅與AOA的amoA基因有關。這意味著AOB和AOA產生AMO酶在化學品的共代謝降解中有著關鍵作用,但是具體功能尚未闡明。因此,需要進一步研究共代謝反應中AOA和AOB的AMO功能,以及其他AMO亞基(如AMO-B和AMO-C)在化學品生物降解中的作用。
3.3 異養細菌的作用
為了了解自養氨氧化菌和異養細菌對化學品生物降解性的影響,可使用烯丙基硫脲(ATU)作為AMO抑制劑,抑制AOB氨氧化酶活性。Tran等[7]發現在ATU(10 mg/L)存在下,布洛芬和其他幾個化學品仍然發生了降解,這表明在沒有自養硝化作用的情況下,這些化學品仍然能被異養微生物降解。同樣,Rol等[39]也發現在AMO抑制劑存在下,雙酚A和布洛芬都被完全降解。而只有自養氨氧化細菌(Nitrosomonaseuropea)時,布洛芬不能被降解,異養細菌在化學品的生物降解中也發揮重要作用。
Khunjar等[21]研究了AOB和異養微生物在EE2和甲氧芐氨嘧啶(trimethoprim, TMP)生物降解中的作用,發現AOB可降解EE2但不能降解TMP,而異養微生物不但可以礦化EE2,而且可以轉化TMP,降解AOB產生的EE2衍生物。同時,還發現AOB和異養微生物可協同促進EE2降解。
3.4 異養真菌胞外木質素酶的作用
白腐真菌顯示出與好氧菌明顯不同的代謝途徑,其底物特異性低,氧化能力強,可降解如鹵代芳烴、多環芳烴、農藥和工業廢物等多種持久性有機污染物[40]。
白腐真菌主要依靠細胞外木質素降解酶(氧化酶和過氧化物酶)起作用,這些酶包括木質素過氧化物酶(LiP)、錳過氧化物酶(MnP)和漆酶(Lac)。這些降解酶對底物特異性較低,對化學品具有廣譜性[41]。此外,白腐真菌還能分泌低分子量調節物,進一步擴寬氧化化學品的范圍。很多學者使用胞外木質素降解酶對化學品進行了降解性研究。漆酶可以很明顯地降解雙酚A、三氯生和E1等酚醛類化學品[42]。一些非酚醛類化學品(如雙氯芬酸和吲哚美辛)也可以被漆酶降解[43]。其他木質素降解酶(MnP和LiP)也可以降解化學品,但是MnP和LiP在自然條件下并不穩定[41]。
4 化學品生物降解性促進方法
4.1 添加生長基質
共代謝過程能夠提高化學品的生物降解性,在共代謝過程中相關降解酶的數量取決于生長基質的濃度,為了提高降解化學品微生物共代謝作用,必須提供功能微生物群充足的生長基質。生活污水中生長基質含量很高,這也是很多工業廢水必須要和生活污水合并處理的原因。
4.2 控制微生物群落結構
化學品的生物降解有自養微生物的共代謝降解、異養微生物的共代謝和/或生長代謝降解。典型的AOA可以通過非特異性酶AMO共代謝降解化學品,而異養微生物也能夠通過他們的各種加氧酶降解多種化學品。由于自養和異養微生物產生酶的差異,化學品的降解率也不同,通過合理控制微生物的群落結構可以促進化學品的生物降解性。
4.3 真菌漆酶和加氧酶的組合
白腐真菌的胞外漆酶具有較低的底物專一性和降解酚類化學品的能力。在沒有其他介質參與下,漆酶很難降解芳香族化合物或非酚結構的化學品。細菌加氧酶能夠羥基化許多芳香族化合物和非酚結構的化學品,但是細菌很難降解羥基化的化學品,且羥基化的化學品往往會抑制細菌活性,而真菌漆酶容易降解細菌羥基化的副產物(苯酚基)。因此,研究設計真菌漆酶和細菌混合培養方法對促進化學品的生物降解性也具有重要意義。
5 研究展望
與快速生物降解性測試不同,固有生物降解測試用于評價化學品具有的最大生物降解能力。目前OECD化學品固有生物降解性測試方法中,302A改進的半連續活性污泥試驗(SCAS)、302B贊恩-惠倫斯/EMPA試驗和302C改進的MITI試驗(Ⅱ),這3個測試方法在最大限度的評價化學品的降解潛能方面存在一定不足。
3個化學品固有生物降解性測試方法中,只有302A試驗在試驗過程中要求不斷加入生活污水,302B和302C試驗都在不含其他碳源的無機培養基中進行,因此,302B和302C試驗在某種程度上無法評估化學品的共代謝降解潛能。302A試驗過程中雖然要求加入生活污水,但是沒有明確規定生活污水的組成,由于不同地區、不同時間STP中生活污水差異較大,因此302A試驗結果預期差異較大。此外,現有的固有生物降解性測試方法中,也沒有對自養和異養微生物組成和比例進行明確規定。
為了評價化學品的最大生物降解能力,應該在OECD 302A、302B和302C試驗的基礎上,以化學品的生物降解機理為指導原則,充分考慮加入生長基質對化學品的共代謝促進作用。研究并規范生長基質(生活污水)的組成和含量,通過改變SRT、HRT以及添加生長基質等方式實現對微生物群落結構的控制。同時研究真菌漆酶和細菌等混合培養方法,合理設計試驗接種物中真菌和細菌的比例,實現化學品的增強生物降解性測試方法,更好地評估化學品的最大生物降解能力。
[1] KOLPIN D W,FURLONG E T,MEYER M T,et al.Pharmaceuticals,hormones,and other organic wastewater contaminants in U.S.streams,1999-2000:a national reconnaissance[J].Environ Sci Technol,2002,36:1202-1211.
[2] TRAN N H.,HU J,ONG S L.Simultaneous determination of PPCPs,EDCs,and artificial sweeteners in environmental water samples using a single-step SPE coupled with HPLC-MS/MS and isotope dilution[J].Talanta,2013,113:82-92.
[3] OECD.OECD guidelines for the testing of chemicals:revised introduction to the OECD guidelines for testing of chemicals:section 3:part 1:principles and strategies related to the testing of degradation of organic chemicals[M].Paris:OECD,2006.
[4] KREUZINGER N,CLARA M,STRENN B,et al.Relevance of the sludge retention time (SRT) as design criteria for wastewater treatment plants for the removal of endocrine disruptors and pharmaceuticals from wastewater[J].Water Sci Technol,2004,50:149-156.
[5] CLARA M,KREUZINGER N,STRENN B,et al.The solids retention time: a suitable design parameter to evaluate the capacity of wastewater treatment plants to remove micropollutants[J].Water Res,2005,39:97-106.
[6] CIRJA M,IVASHECHKIN P,SCHAFER A,et al.Factors affecting the removal of organic micropollutants from wastewater in conventional treatment plants (CTP) and membrane bioreactors (MBR)[J].Rev Environ Sci Biotechnol,2008,7:61-78.
[7] TRAN N H,URASE T,KUSAKABE O.The characteristics of enriched nitrifier culture in the degradation of selected pharmaceutically active compounds[J].J Hazard Mater,2009,171:1051-1057.
[8] TADKAEW N,SIVAKUMAR M,KHAN S J,et al.Effect of mixed liquor pH on the removal of trace organic contaminants in a membrane bioreactor[J].Bioresour Technol,2010,101:1494-1500.
[9] HAI F I,TESSMER K,NGUYEN L N,et al.Removal of micropollutants by membrane bioreactor under temperature variation[J].J Membr Sci,2011,383:144-151.
[10] HELBLING D E,JOHNSON D R,HONTI M,et al.Micropollutant biotransformation kinetics associate with WWTP process parameters and microbial community characteristics[J].Environ Sci Technol,2012,46:10579-10588.
[11] TRAN N H,URASE T,TA T T.A preliminary study on the occurrence of pharmaceutically active compounds in hospital wastewater and surface water in Hanoi,Vietnam[J].CLEAN:Soil Air Water,2014,42(3):267-275.
[12] ARP D J,YEAGER C M,HYMAN M R.Molecular and cellular fundamentals of aerobic cometabolism of trichloroethylene[J].Biodegradation,2001,12:81-103.
[13] MURDOCH R W,HAY A G.Formation of catechols via removal of acid side chains from ibuprofen and related aromatic acids[J].Appl Environ Microbiol,2005,71:6121-6125.
[14] IASUR-KRUH L,HADAR Y,MINZ D.Isolation and bioaugmentation of an estradiol-degrading bacterium and its integration into a mature biofilm[J].Appl Environ Microbiol,2011,77:3734-3740.
[15] ALMEIDA B,OEHMEN A,MARQUES R,et al,Modelling the biodegradation of non-steroidal anti-inflammatory drugs(NSAIDs) by activated sludge and a pure culture[J].Bioresour Technol,2013,133:31-37.
[16] VANNELLI T,LOGAN M,ARCIERO D M,et al.Degradation of halogenated aliphatic-compounds by the ammonia-oxidizing bacteriumNitrosomonaseuropaea[J].Appl Environ Microbiol,1990,56:1169-1171.
[17] YI T,HARPER W F.The link between nitrification and biotransformation of 17α-ethinylestradiol[J].Environ Sci Technol,2007,41:4311-4316.
[18] HAISS A,KUMMERER K.Biodegradability of the X-ray contrast compound diatrizoic acid,identification of aerobic degradation products and effects against sewage sludge micro-organisms[J].Chemosphere,2006,62:294-302.
[19] GRONING J,HELD C,GARTEN C,et al.Transformation of diclofenac by the indigenous microflora of river sediments and identification of a major intermediate[J].Chemosphere,2007,69:509-516.
[20] QUINTANA J B,WEISS S,REEMTSMA T.Pathways and metabolites of microbial degradation of selected acidic pharmaceutical and their occurrence in municipal wastewater treated by a membrane bioreactor[J].Water Res,2005,39:2654-2664.
[21] KHUNJAR W O,MACKINTOSH S A,SKOTNICKA-PITAK J,et al.Elucidating the relative roles of ammonia oxidizing and heterotrophic bacteria during the biotransformation of 17 alpha-ethinylestradiol and trimethoprim[J].Environ Sci Technol,2011,45:3605-3612.
[22] LIU Z,DAI Y,HUAN Y,et al.Different utilizable substrates have different effects on cometabolic fate of imidacloprid inStenotrophomonasmaltophilia[J].Appl Microbiol Biotechnol,2013,97:6537-6547.
[23] CZAJKA C P,LONDRY K L.Anaerobic biotransformation of estrogens[J].Sci Total Environ,2006,367:932-941.
[24] WU Y C,KE X B,HERNANDEZ M,et al.Autotrophic growth of bacterial and archaeal ammonia oxidizers in freshwater sediment microcosms incubated at different temperatures[J].Appl Environ Microbiol,2009,79:3076-3084.
[25] SUAREZ S,RAMIL M,OMIL F,et al.Removal of pharmaceutically active compounds in nitrifying-denitrifying plants[J].Water Sci Technol,2005,52:9-14.
[26] BOTHE H,JOST G,SCHLOTER M,et al.Molecular analysis of ammonia oxidation and denitrification in natural environments[J].FEMS Microbiol Rev,2000,24:673-690.
[27] KIM S,EICHHORN P,JENSEN J N,et al.Removal of antibiotics in wastewater:effect of hydraulic and solid retention times on the fate of tetracycline in the activated sludge srocess[J].Environ Sci Technol,2005,39:5816-5823.
[28] URASE T,KAGAWA C,KIKUTA T.Factors affecting removal of pharmaceutical substances and estrogens in membrane separation bioreactors[J].Desalination,2005,178:107-113.
[29] 何起利,梁威,賀鋒,等.人工濕地氧化還原特征及其與微生物活性相關性[J].華中農業大學學報,2008,26(6):844-849.
[30] SARMAH A K,NORTHCOTT G L.Laboratory degradation studies of four endocrine disruptors in two environmental media[J].Environ Toxicol Chem,2008,27:819-827.
[31] LARCHER S,YARGEAU V.Biodegradation of 17α-ethinylestradiol by heterotrophic bacteria[J].Environ Pollut,2013,173:17-22.
[32] LEININGER S,URICH T,SCHLOTER M,et al.Archaea predominate among ammonia-oxidizing prokaryotes in soils[J].Nature,2006,442:806-809.
[33] GAO J F,LUO X,WU G X,et al.Quantitative analyses of the composition and abundance of ammonia-oxidizing archaea and ammonia-oxidizing bacteria in eight full-scale biological wastewater treatment plants[J].Bioresour Technol,2013,138:285-296.
[34] ZENG Y,de GUARDIA A,ZIEBAL C,et al.Impact of biodegradation of organic matters on ammonia oxidation in compost[J].Bioresour Technol,2013,136:49-57.
[35] VADER J S,van GINKEL C G,SPERLING F M,et al.Degradation of ethinyl estradiol by nitrifying activated sludge[J].Chemosphere,2000,41:1239-1243.
[36] de GUSSEME B,PYCKE B,HENNEBEL T,et al.Biological removal of 17α-ethinylestradiol by a nitrifier enrichment culture in a membrane bioreactor[J].Water Res,2009,43:2493-2503.
[37] ROTTHAUWE J H,WITZEL,K P,LIESACK W.The ammonia monooxygenase structural gene amoA as a functional marker:molecular fine-scale analysis of natural ammonia-oxidizing populations[J].Appl Environ Microbiol,1997,63:4704-4712.
[38] YI T,HARPER W,HOLBROOK R,et al.Role of particle size and ammonium oxidation in removal of 17α-ethinyl estradiol in bioreactors[J].J Environ Eng,2006,132:1527-1529.
[39] ROH H,SUBRAMANYA N,ZHAO F,et al.Biodegradation potential of wastewater micropollutants by ammonia-oxidizing bacteria[J].Chemosphere,2009,77:1084-1089.
[40] 曾斌,寧大亮,王慧.白腐真菌降解五氯酚的初步研究[J].環境化學,2008,27(2):181-185.
[41] YANG S,HAI F I,NGHIEM L D,et al.Understanding the factors controlling the removal of trace organic contaminants by white-rot fungi and their lignin modifying enzymes:a critical review[J].Bioresour Technol,2013,141:97-108.
[42] CABANA H,ALEXANDRE C,AGATHOS S N,et al.Immobilization of accase from the white rot fungusCoriolopsispolyzonaand use of the immobilized biocatalyst for the continuous elimination of endocrine disrupting chemicals[J].Bioresour Technol,2009,100:3447-3458.
[43] TRAN N H,URASE T,KUSAKABE O.Biodegradation characteristics of pharmaceutical substances by whole fungal cultureTrametesversicolorand its laccase[J].J Water Environ Technol,2010,8(2):125-140. ?

