激活素A及卵泡抑素在肝切除小鼠肝組織的表達
閆 楓 劉軼丹
(長春醫學高等專科學校,吉林 長春 130031)
目前,對于肝臟占位性病變,肝臟的部分切除是主要的可能治愈方法之一,但手術本身能對剩余的肝臟造成急性損傷,患者甚至因肝衰竭而死亡。本研究通過建立肝切除急性損傷模型,研究激活素A(Activin A)及卵泡抑素(FS)在損傷肝組織的表達情況,探討ActivinA-FS系統在肝切除急性肝損傷發生機制中的作用,為肝臟疾病的術后干預及治療提供實驗數據。
1 材料與方法
1.1對象 選擇胚胎或纖維細胞素(BALB/c)40只雄性小鼠,體重18~22 g,適應性喂養7 d后,隨機分為模擬手術組、肝切除組,每組20只。于超凈操作臺內,肝切除組小鼠開腹,切除一個肝小葉1/3后縫合;模擬手術組開腹,暴露部分肝組織后縫合。所有小鼠于術后第5天摘眼球放血處死并留取血液樣品,4℃預冷磷酸鹽緩沖液(PBS)心臟灌流小鼠,收獲肝臟組織。
1.2方法 兩步法RT-PCR,逆轉錄條件:42℃ 60 min,96℃ 2 min。PCR條件:預變性95℃ 90 s,變性94℃ 30 s,退火53℃ 30 s,延伸72℃ 50 s,循環數35,72℃ 10 min停止反應。PCR產物電泳,測定電泳條帶灰度值對Activin A及其受體mRNA表達進行半定量分析。
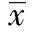
2 結 果
2.1兩組各指標比較 轉氨酶測定,與對照組比較,模型組小鼠血清轉氨酶水平明顯增高(P<0.01),而模型組小鼠肝組織轉氨酶水平有所降低(P<0.05)。模型組小鼠肝組織NO水平增高(P<0.05)。模型組小鼠肝臟指數增高(P<0.05)。見表1。
2.2半定量RT-PCR比較各樣本mRNA 以甘油醛-3-磷酸脫氫酶(GAPDH)內參cDNA灰度值為100%,結果顯示小鼠肝切除后,肝組織Activin A、Activin A受體(ActRⅡ)A、ActRⅡB、FS表達水平均有所增加,其中以Activin A mRNA表達量增加最大(P<0.01)。見圖1。
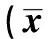
表1 兩組血清肝組織勻漿轉氨酶、NO、肝臟指數比較±s,n=20)
ALT:谷丙轉氨酶;AST:谷草轉氨酶;與對照組比較:1)P<0.01

與模擬手術組比較:1)P<0.05,2)P<0.01
3 討 論
對小鼠實施肝組織部分切除后,小鼠肝組織急性損傷,肝功能嚴重破壞,血清轉氨酶水明顯上升,而肝組織勻漿轉氨酶水平則相應下降,說明破壞的肝細胞將胞漿內ALT和線粒體內AST迅速釋放入血,急性肝損傷形成。
肝組織勻漿NO的測定顯示損傷肝組織表達NO增加,已有研究〔1〕表明,NO對肝細胞既有保護功能又有殺傷毒性與促炎的雙重作用。但在肝損傷特別是急性肝損傷時,誘導型NO合酶表達出活性,即可產生大量的NO,使NO在肝臟中的濃度遠高于其生理濃度,則損傷正常肝組織,導致肝細胞死亡。
急性肝損傷后,肝臟指數增加,表明肝切除后肝組織再生明顯,但再生肝組織難以恢復原有狀態而表現出腫脹和纖維化明顯,說明在損傷和修復過程中,損傷更為明顯。
Aotsrin A是機體多種生理和病理過程的重要調節因子〔2, 3〕,目前大多數認為肝臟、骨髓和血管壁是其主要來源〔4〕。有研究〔5〕表明,Activin A及其受體表達受其他細胞因子的影響。轉化生長因子(TGF)-β、表皮生長因子及血小板衍生生長因子(PDGF)等可以促進培養的成纖維細胞和角朊細胞激活素βA亞基表達。組織損傷后,這些因子從血小板釋放,它們可能是促進損傷部位Activin A表達上調的早期因素。各種組織損傷及炎癥病理過程中都有Activin A的表達增高,其水平與損傷及炎癥程度顯著相關。促炎因子可強烈誘導Activin A表達,提
示Activin A在炎癥損傷過程中可能發揮重要作用。一定程度的Activin A表達有助于損傷及炎癥修復過程正常進行,但其過度表達可能與器官纖維化及某些慢性病變的形成有關〔6〕。
本研究結果表明肝損傷后炎性因子誘導Activin A、ActRⅡA、ActRⅡB的表達,而Activin A、ActRⅡA、ActRⅡB的結合,激活下游蛋白,參與抑制肝細胞生長,誘導肝細胞進一步發生炎癥及凋亡,這是一個正反饋過程。因此,Activin A是肝生長抑制及肝損傷性介質。
FS是Activin A的特異性結合蛋白,其組織分布與ActRⅡA、ActRⅡB大致相同〔7〕,肝臟細胞外基質中蛋白多糖上結合的FS可與周圍細胞分泌的Activin A結合,從而阻斷其與ActRⅡA、ActRⅡB結合。
本試驗結果表明FS與Activin的特異性結合,可能競爭性抑制Activin A與其受體的結合,從而阻斷Activin A的生物學效應,進而對急性肝損傷起到抗炎、抗損傷,促進組織修復再生的作用。
4 參考文獻
1Sergent O,Griffon B,Morel I,etal.Effect of nitric oxide on iron-mediated oxidative stress in primary rat hepatocyte culture〔J〕.Hepatology,1997; 25(1):122-7.
2Feijen A,Goumans MJ,van den Eijnden-van Raaij AJ.Expression of activin subunits,activin receptor and follistatin in postimplantation mouse embryos suggests specific developmental functions for different activins〔J〕.Development,1994;120(12):3621-37.
3Harrison CA,Gray PC,Vale WW,etal.Antagonists of activin signaling:mechanisms and potential biological applications〔J〕.Trends Endocrinol Metab,2005;16(2):73-8.
4Wada W,Kuwano H,Hasegawa Y,etal.The dependence of transforming growth factor-beta induced collagen production on autocrine factor activin A in hepatic stellate cells〔J〕.Endocrinology,2004;145(6):2753-9.
5朱 輝,劉國藝,李慶雷,等.激活素A對離體培養大鼠卵泡發育的影響〔J〕.基礎醫學與臨床,2001;21(6):560-2.
6黃 新,李定國,陸漢明,等.激活素和卵泡抑素mRNA在肝纖維化形成過程中的作用〔J〕.中華肝臟病雜志,2002;10(2):85-7.
7Sugino H, Sugino K,Hashimoto O,etal.Follistatin and its vols as an activin-binding protein〔J〕.J Med Invest,1997;44(1-2):11-4.

