高濃度氯化銨分解生成氨聯產固體氯化鈣的研究
劉潤靜,張振昌,胡永琪,蔡守軍,侯元昇
(1.河北科技大學化學與制藥工程學院,河北 石家莊 050018;2.青海鹽湖工業股份有限公司,青海 格爾木 816000)
目前,我國純堿的工業生產主要以氨堿法(索維爾法)、聯堿法(侯氏制堿法)為主,分別占52.5%和40.2%。氨堿法是純堿生產的主要方法,該過程在生產純堿的同時,副產低濃度的氯化銨溶液,目前一般采取向10%左右的氯化銨溶液中加入石灰乳的方法,使氯化銨分解生成氯化鈣和氨,然后通過蒸氨工藝將氨蒸出,氨再返回純堿系統,實現氨循環。但此法會產生大量的濃度約為10%左右的氯化鈣廢液,造成了嚴重的環境污染和水資源浪費[1]。生產純堿的另一個工業方法是聯堿法,該方法通過冷析、鹽析等過程將氯化銨從系統中以固體的形式產出,從而避免了蒸氨廢液帶來的污染[2-5]。固體氯化銨的主要用途是農用化肥,目前95%以上的氯化銨主要作為化肥使用。由于氯化銨是酸性含氯肥料,會造成瓜果類作物的甜度下降,口感不好,同時長期使用氯化銨化肥會造成土壤板結,因此出現了氯化銨大量過剩,造成資源的浪費[6,7]。因此本論文提出將高濃度氯化銨與粉體氫氧化鈣進行反應,在實現氨循環利用的同時,直接副產固體氯化鈣,其可以直接作為產品用作融雪劑和其他用途。該方法既可以避免環境污染,又可以實現資源的循環利用,從根本上解決了氨堿法所帶來的環境污染問題,并且省去了蒸氨過程,降低了生產成本。對純堿行業的發展具有重要意義。
1 實驗
1.1 主要原料及儀器
氫氧化鈣,工業品;氯化銨,工業級。

圖1 高濃度氯化銨分解反應器圖
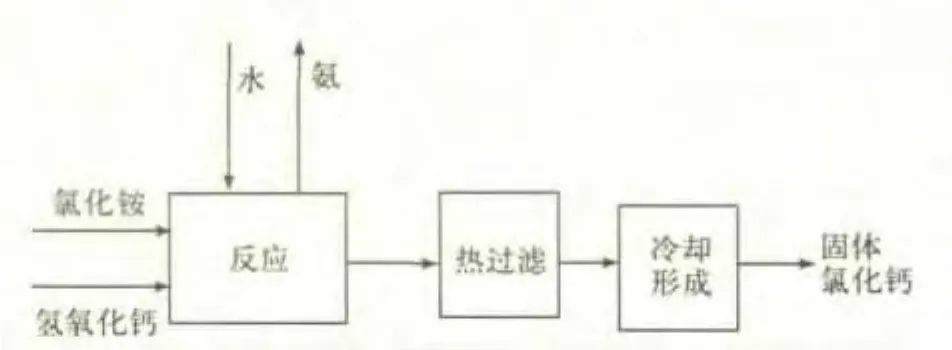
圖2 高濃度氯化銨分解工藝流程圖
1.2 高濃度氯化銨分解
高濃度氯化銨分解工藝流程如圖2所示,將高濃度氯化銨和粉體氫氧化鈣按一定比例加入反應器中,在一定溫度下反應一段時間后,產物進行熱過濾處理,得到的漿料進入冷卻成型器,得到固體氯化鈣。
本論文采用凱氏定氮法分析總氮量,再采用酸堿滴定檢測游離氨含量,進而計算出氯化銨的分解率。
本論文探討了反應溫度、物料配比、反應時間、加水量對氯化銨分解率的影響,并進行了正交試驗。
2 結果與討論
2.1 單因素分析
2.1.1 加水量對氯化銨分解率的影響
取氫氧化鈣與氯化銨摩爾比為1.1∶2,反應時間60min,溫度115℃。考察加水量對氯化銨分解率的影響。實驗結果如圖3所示。
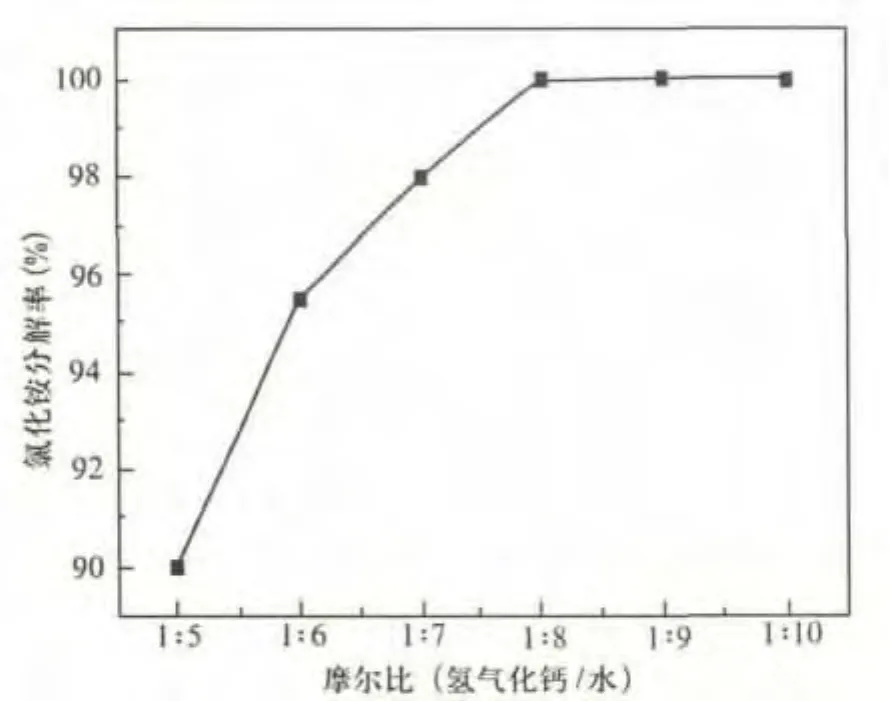
圖3 加水量對氯化銨分解率的影響
由圖3可知,隨著水量的增加,氯化銨分解率不斷提高,當氫氧化鈣與水的摩爾比為1∶8時,氯化銨分解率達到100%。經分析當氫氧化鈣與水的摩爾比為1∶8時,反應結束后氯化鈣濃度為68%左右,這是由反應過程中水分蒸發所導致的。將漿料過濾、結晶可以得到固體氯化鈣。使得氯化銨分解利用的同時,直接得到了固體氯化鈣產品,從圖中可以確定反應最佳加水量為氫氧化鈣與水的摩爾比為1∶8。
2.1.2 溫度對氯化銨分解率的影響
取氫氧化鈣與氯化銨摩爾比為1.1∶2,反應時間60min,加水量為氫氧化鈣與水的摩爾比為1∶8。考察溫度對氯化銨分解率的影響。實驗結果如圖4所示。

圖4 溫度對氯化銨分解率的影響
由圖4可以看出,隨著溫度的增加,氯化銨的分解率不斷上升。當溫度達到115℃時,氯化銨的分解率接近100%。從圖中可以判定氫氧化鈣濕法分解氯化銨的最佳溫度是115℃。因為高濃度氯化銨的沸點在115℃左右,由于溶液的沸騰,使大量的游離氨解析,加快反應進行。
2.1.3 時間對氯化銨分解率的影響
取氫氧化鈣與氯化銨摩爾比為1.1∶2,溫度115℃,加水量為氫氧化鈣與水的摩爾比為1∶8。考察時間對氯化銨分解率的影響。實驗結果如圖5所示。
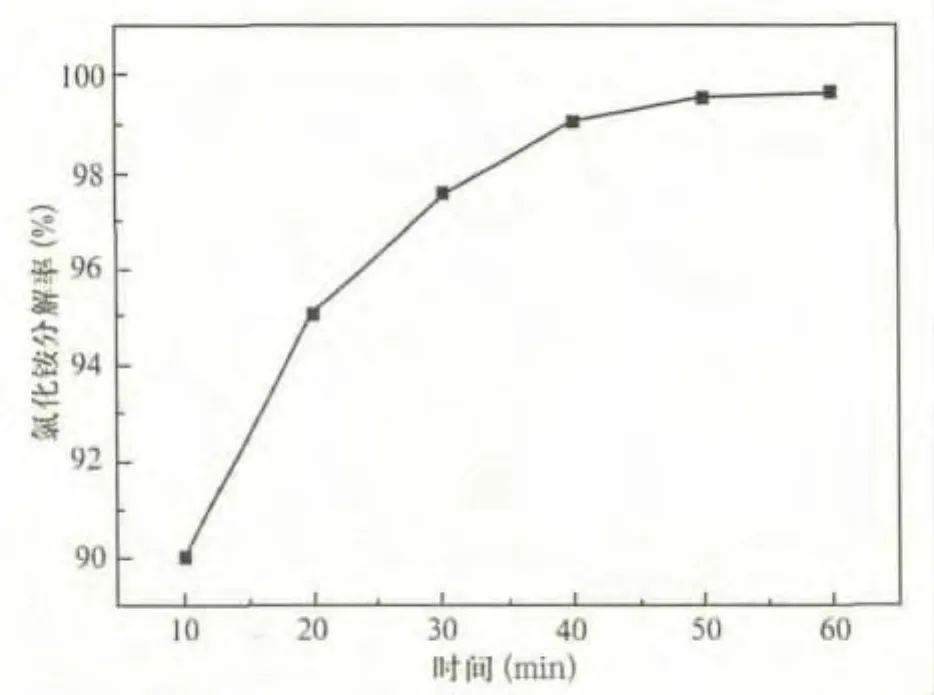
圖5 時間對氯化銨分解率的影響
由圖5可以看出,隨著反應時間的延長,氯化銨分解不斷上升。當反應時間達到50min時,氯化銨的分解率達到了最大值100%。
2.1.4 氫氧化鈣與氯化銨摩爾比對氯化銨分解率的影響
取加水量為氫氧化鈣與水的摩爾比為1∶8。溫度115℃,時間為60min,考察氫氧化鈣與氯化銨摩爾比對氯化銨分解率的影響。實驗結果如圖6所示。

圖6 氫氧化鈣與氯化銨摩爾比對氯化銨分解率的影響
從圖6可以看出,隨著氫氧化鈣的增加,氯化銨的分解率在不斷上升,當摩爾比達到氫氧化鈣/氯化銨為1.15∶2時,氯化銨的分解率達到100%。氫氧化鈣過量才能完成氯化銨完全分解,這是由于氫氧化鈣的純度所引起的。從圖中可以判斷,反應的最佳摩爾比為氫氧化鈣與氯化銨的摩爾比為1.15∶2。
上述實驗結果表明,適宜的反應條件為:當加水量為氫氧化鈣與水的摩爾比為1∶8,溫度為115℃,反應時間為50min,氫氧化鈣與氯化銨的摩爾比為1.15∶2。
2.2 正交試驗
2.2.1 正交試驗方案
以氯化銨分解率為目標,分析前期實驗數據后確定了主要影響因素為加水量、反應溫度、反應時間和氫氧化鈣與氯化銨的摩爾比。每個因素選擇三個水平,列出了四因素三水平的正交試驗因素水平表,見表1所示。按照正交試驗表排列了9組實驗,正交試驗方案表見2所示。

表1 正交試驗因素與水平表
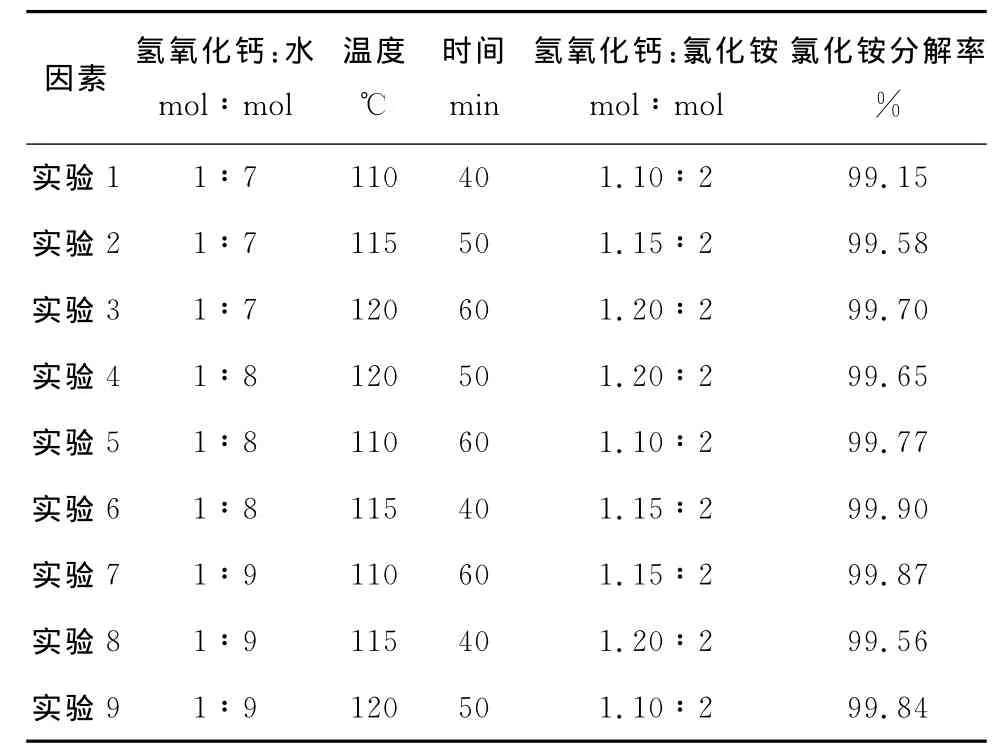
表2 正交試驗方案表
2.2.2 正交試驗結果分析
以氯化銨分解率為目標進行極差分析,分析結果見表3。
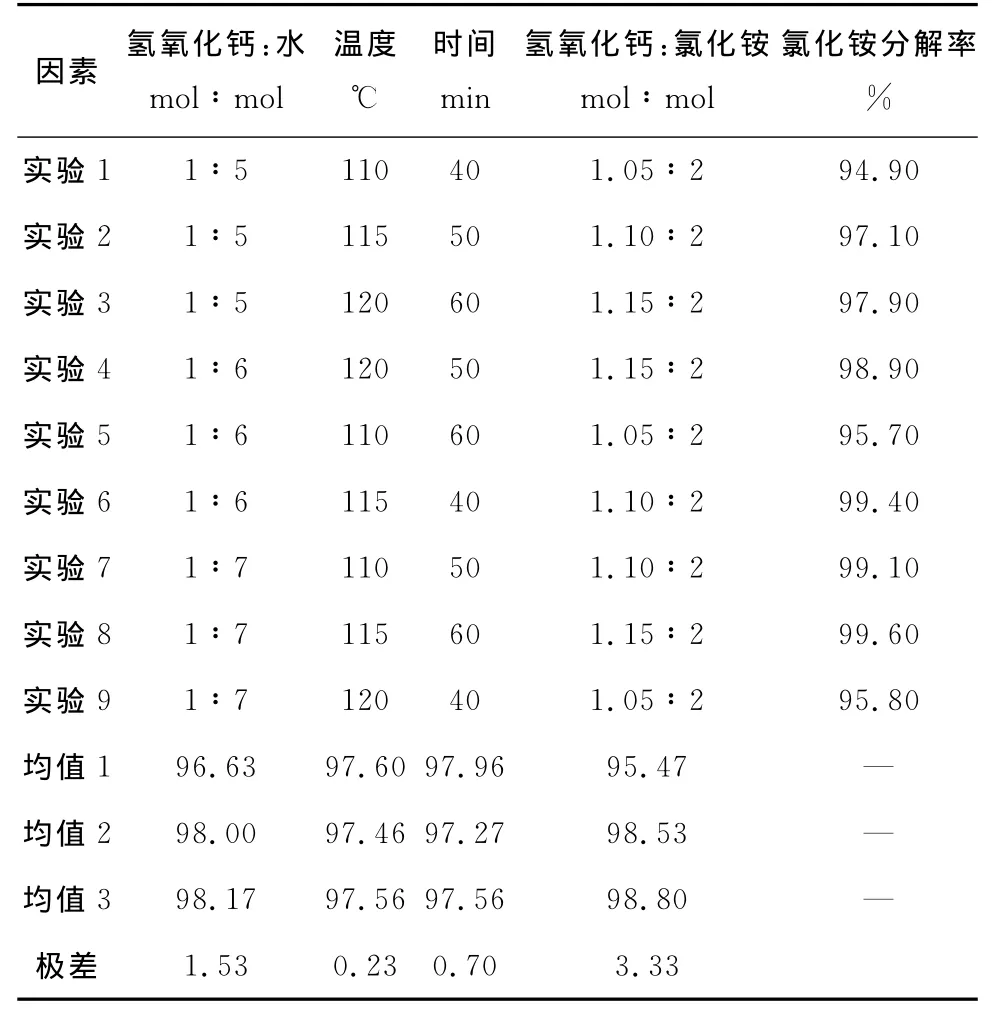
表3 氯化銨分解率極差分析表
由表2可知,第六組實驗氯化銨分解率最高,氯化銨分解率為99.9%。即加水量為氫氧化鈣與水的摩爾比為1∶8,溫度為115℃,時間為40min,氫氧化鈣與氯化銨摩爾比為1.15∶2。而從表3極差分析結果顯示的較優組合為加水量為氫氧化鈣與水的摩爾比為1∶7,溫度為115℃,時間為60min,氫氧化鈣與氯化銨摩爾比為1.15∶2。從此表3也可以看出對氯化銨分解率影響由強到弱的因素分別為加水量、氫氧化鈣與氯化銨的摩爾比、溫度和時間。
2.2.3 驗證試驗
對正交試驗所得最優配方和極差分析所得最優配方進行驗證試驗。實驗結果見表4所示。

表4 驗證試驗表
通過驗證試驗可知,由極差分析結果選出的最優組的氯化銨分解率高于實驗最優組的氯化銨分解率,但兩組結果相差不大。從能耗方面考慮,由極差分析結果選出的方案需要更多的能耗,不適合其工業化應用。所以最終確定方案為加水量為氫氧化鈣與水的摩爾比為1∶8,溫度為115℃,時間為40 min,氫氧化鈣與氯化銨摩爾比為1.15∶2。
3 結 論
1)從經濟和環保角度考慮,本論文采用半干法分解氯化銨是一種既經濟且環保的方法:①得到經濟效益高、有價值的新產品氨氣和氯化鈣;②避免了氯化銨大量過剩堆積造成的污染問題;③避免了10%的氯化鈣廢液對環境的污染問題。
2)實驗確定了最佳的工藝條件:加水量為氫氧化鈣與水的摩爾比為1∶8,溫度為115℃,時間為40min,氫氧化鈣與氯化銨摩爾比為1.15∶2。對于實現工業化打下了良好的基礎。
[1] 楊燎原.淺析氨堿法環保工作面臨的形勢與對策[J].純堿工業,2011(5):8-11
[2] 中國純堿工業協會.純堿工學[M].北京:化學工業出版社,1990
[3] 侯德榜.制堿工學[M].北京:化學工業出版社,1960
[4] 李祉川,陳歆文.侯德榜[M].天津:南開大學出版社,1990
[5] 裴正建.純堿生產工藝綜述[J].內蒙古石油化工,2011(5):38-39
[6] 毛知耘,周則芳,石孝均,等.再論氯化銨氮肥的發展前景[J].純堿工業,2000,38(4):3-9
[7] 唐國昌,唐仁濤.氯化銨在復混肥加工中的應用[J].磷肥與復肥,2001,16(2):59-59

