用7.0 T 1H MR波譜對腦膠質瘤不同部位腦代謝特征的實驗研究
易美芝,延根,張桂珊,耿寬,吳仁華
腦膠質瘤是顱內最常見的原發性腫瘤。雖然先進的外科技術得以進一步發展,新穎的局部放射治療和化療不斷涌現,腦膠質瘤復發率仍居高不下,最主要的原因還是膠質瘤的侵襲性生長模式[1]。惡性侵襲性腦膠質瘤具有從瘤體中心向瘤周腦組織浸潤生長數厘米特性[2]。膠質瘤侵襲邊界的識別能為臨床對腦膠質瘤的評估和治療提供重要的參考信息,而常規MR結構成像序列對肉眼無法識別瘤體以外的腫瘤細胞探測并不敏感。
MR波譜(MRS)是一項非侵襲性的檢測腦代謝物變化手段,它能準確定量腦內主要代謝物濃度。據研究報道,不同腦代謝物的絕對濃度或代謝物之間比率能預測腦膠質瘤的級別、侵襲范圍[3]及預后[4]情況。目前對腦膠質瘤代謝物MRS研究時感興趣區主要是放在瘤體實質部分,但是實質部分以外其他部位,尤其是腫瘤周邊組織代謝情況卻很少給予分析,且對代謝物定量方面也僅僅局限于利用各代謝物間濃度比率。本實驗目的是在7.0 T這一超高磁場下,利用MRS技術及LCModel后處理軟件獲得腦膠質瘤不同部位代謝物絕對濃度、分析其代謝特征。希望實驗方法能為評斷腦膠質瘤潛在邊界提供有效的診斷價值。
1 材料與方法
1.1 材料
雌性SD大鼠20只,購于汕 頭大學醫學院動物實驗中心,體重250~300 g,隨機等量分成2組,置于SPF級環境飼養。C6膠質瘤細 胞購于上海中科院 細胞庫,在含有10%胎牛血清 的DMEM/F12的培養基,5% CO2、37 ℃細胞孵育箱中培養。Agilent 7.0 T (USA)動物專用MR掃描儀,以及與其匹配的直徑160 mm表面線圈。立體定向儀購于中國RWD Life Science公司, Gd-DTPA購于中國北陸公司。
1.2 方法
(1)動物模型的制備:當C6細胞處于對數生長期時,將腫瘤細胞制成懸液,濃度為106/10 μl。用10%的水合氯醛(3.3 ml/kg)腹腔注射麻醉實驗鼠后,在立體定向儀引導下,選定鼠腦右側基底節區為進針靶點,具體坐標是:前囟前1 mm,矢狀縫右3 mm,硬膜下6 mm,接種量為10 μl。細胞懸液注射速度要不超過1 μl/min,注射完畢后停針5 min,最后緩慢拔針,骨蠟封閉骨孔,縫合皮膚,切口消毒,重置于 SPF環境培養。(2)動物模型MR掃描:荷瘤大鼠及正常組大鼠于術后7 d行MRI和MRS檢查,同樣用10%的水合氯醛(3.3 ml/kg)腹腔注射麻醉實驗室,取俯臥位固定于上,先后完成MRI常規平掃、1H MRS和MRI增強掃描,掃描均選用冠狀位。MRI及MRS參數設定:T1WI選擇SEMS序列,TR 350 ms,TE 最小,FOV 25 mm×25 mm,Average 8,Matrix 192×192。T2WI掃描選擇FSEMS序列,TR 2500 ms,ESP 12 ms,Average 8,Matrix 192×192。MRS采集于T1、T2掃描以后,采用STEAM序列,TR 5000 ms,TE 60 ms,在3個層面T2WI上定位,Average 320次,FOV 3 mm×3 mm×3 mm,ROI分別放在腫瘤中心、腫瘤實體部分、腫瘤周邊和對側正常腦組織。定位,勻場及壓水后得到原始波譜圖像。再將原始波譜數據通過LCModel軟件量化分析處理可以得到代謝物的絕對濃度。最后行Gd劑增強MRI,參數如上T1掃描。增強掃描是經尾靜脈注入Gd-DTPA (1.2 ml/kg)后立即進行。(3)組織病理學檢查:所有上述掃描序列完成后,將實驗鼠處死,把實驗鼠腦組織經石蠟包埋后切4 um薄片,HE染色。(4)統計學分析:最終波譜數據統計學分析應用SPSS 17.0軟件。采用One-Way Anova檢驗,檢驗標準:雙側 ɑ=0.05,P<0.05有統計學意義。
2 結果
2.1 動物模型臨床表現
種植腫瘤細胞7 d后SD大鼠活動量減少,飲水及攝食降低,毛發失去光澤,眼周淤血,逐漸出現偏癱、昏迷直至死亡。
2.2 MRI表現
所有荷瘤鼠右側基底節區見異常信號影,呈橢圓形膨脹性生長。T1WI上等、低信號,T2WI上等、高信號,邊界欠清晰。瘤灶周邊的腦組織與瘤體分界欠清,瘤灶周邊腦組織與對側正常腦組織在任何一層MRI上從肉眼上觀察信號幾乎無差異。Gd增強動態掃描病灶呈明顯延遲強化(圖1)。
2.3 MRS結果
行MRS掃描時,波譜數據通過LCModel和SPSS軟件分析、統計,最終得到了一系列有規律性的結果。
(1)從腫瘤中心、腫瘤實體部分、腫瘤周邊組織到對側正常腦組織,NAA和tCr濃度呈逐漸上升趨勢:腫瘤周邊組織與對側正常腦組織間NAA濃度比較無統計學差異(P=0.996),其他各組間NAA濃度兩兩比較有統計學差異(P=0);腫瘤周邊組織與對側正常腦組織間 tCr濃度比較也無統計學差異(P=0.053),其他各組間tCr濃度兩兩比較有統計學差異(其中腫瘤實體部分與腫瘤周邊組織間P=0.012,其余各組間P值均=0)。(2)從腫瘤中心到對側正常腦組織,Ala濃度呈逐漸下降趨勢,僅腫瘤實體部分與對側正常腦組織間Ala濃度有統計學差異性(P=0.016),其他各組間Ala濃度均無統計學差異性。(3)Tau和Ins濃度在腫瘤周邊組織達到最低:腫瘤中心、腫瘤實體部分和對側正常腦組織與腫瘤周邊組織間Tau濃度均有統計學意義(P值分別為0.019、0.016、0.009);腫瘤中心、腫瘤實體部 分和對側正常腦組織與腫瘤周邊組織間Ins濃度均有統計學意義(P值分別為0.036、0、0.018)。Glx濃度在腫瘤周邊達到最高:腫瘤中心與對側正常腦組織、腫瘤中心與腫瘤周邊組織、腫瘤實體部分與腫瘤周邊組織間Glx濃度有統計學差異性(P=0),腫瘤實體部分、腫瘤周邊組織與對側正常腦組織間Glx濃度有統計學差異性(P值分別為0.003、0.012),腫瘤實體部分與腫瘤中心組織間Glx濃度有統計學差異性(P=0.002)。Cho、Lip、Lac濃度在各組間并無明顯規律可循(圖2)。
2.4 病理學結果
HE染色低倍鏡下觀察見腫瘤無包膜,腫瘤細胞呈巢狀排列,瘤內常見出血及壞死灶,高倍鏡下觀察, 瘤細胞形態多樣,核大、多核、核質深染、異形性高(圖3)。
3 討論
3.1 檢測膠質瘤侵襲性的新技術
雖然病理學檢查是診斷和評估腦膠質瘤的金標準,但在臨床工作中,神經影像學仍然是檢測腦膠質瘤發生和發展的重要手段,尤其當腫瘤生長在腦功能區域時。許多前期研究發現,膠質瘤瘤體周邊那些看似正常的腦組織內其實包含了自由水,具有侵襲的腫瘤細胞,小膠質細胞及反應性膠質細胞[5]。常規MRI成像序列因其有較高的分辨率及信噪比能清晰顯示膠質瘤的形態、提供豐富的解剖學信息,但在顯示瘤體潛在浸潤邊界上尚有一定局限性。MRS同樣是以MRI基本原理為基礎,從分子學角度監測腦組織的代謝情況,能反映出瘤周腦組織受腫瘤細胞侵襲情況,繼而可以判斷腫瘤的分級、增殖及預后。
3.2 腦膠質瘤灶不同部位代謝物MRS特征及分析
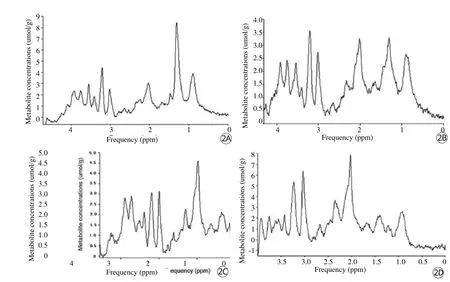
圖2 載瘤模型4個不同部位氫質子MRS圖。A:腫瘤中心部分;B:腫瘤實體部分;C:腫瘤周邊部分;D:對側正常腦組織Fig.2 Representative proton MR spectroscopy spectra from 7.0 T in four different areas.A: Localized proton spectrum of the tumour center.B: Localized proton spectrum of the tumour solid part.C: Localized proton spectrum of the peritumoral normal-appearing tissue.D: Localized proton spectrum of the contralateral white matter.
NAA的化學位移是在2.0 ppm處,它被視為是神經元的標志,許多疾病如:腦白質營養不良、多發硬化及惡性腦腫瘤都會引起一定程度NAA下降[6],其含量可以單獨或聯合Cho來鑒別腫瘤及非腫瘤組織[7]。NAA的濃度也與腫瘤級別和患者年齡呈反比。本實驗病理切片顯示腫瘤中心區域有明顯壞死及出血灶,故其內NAA含量比腫瘤實體部分要低,在常規MRI下肉眼無法識別腫瘤周邊組織信號的改變,而腫瘤周邊組織內NAA濃度卻低于對側正常腦組織,雖然濃度差異無統計學意義,但仍在一定程度上提示腫瘤周邊組織結構可能存在的破壞。從對側正常腦組織到腫瘤中心部分,NAA濃度的梯度變化,可以反映正常神經元被腫 瘤細胞取代這一過程。tCr峰在3.02 ppm處可以探測到,tCr由Cr和Pcr共同組成的,被認為是能量代謝標記物,目前其含量一直被大多數人認為是比較穩定的[8],但仍有部分研究者還是發現在一些腫瘤,尤其是高級別膠質瘤中,其濃度會有相應程度的減低,并被認為導致其濃度減低原因是腫瘤代謝率增高了,但是其具體的特異性生化機制目前暫未知。從對側正常腦組織到腫瘤中心tCr濃度逐漸減低的趨勢提示相應部位組織代謝率可能在逐步增加。
Ala共振峰在1.47 ppm處,它的變化與Lac相似,依據TE的長短顯示為正立或倒置的雙峰,有時與Lac峰很難鑒別,與其他腦腫瘤相比較,Ala在腦膜瘤中的出現頻率會稍高一點[9]。從腫瘤中心到對側正常腦組織,Ala濃度呈逐漸減低趨勢,這個結果與Ziegler等[10]的研究結果相符合。Lac和Ala是能量代謝的中間產物,故這兩種物質與腫瘤代謝密切相關。同Lac一樣,腫瘤內增高的糖酵解可以解釋增高的Ala濃度。
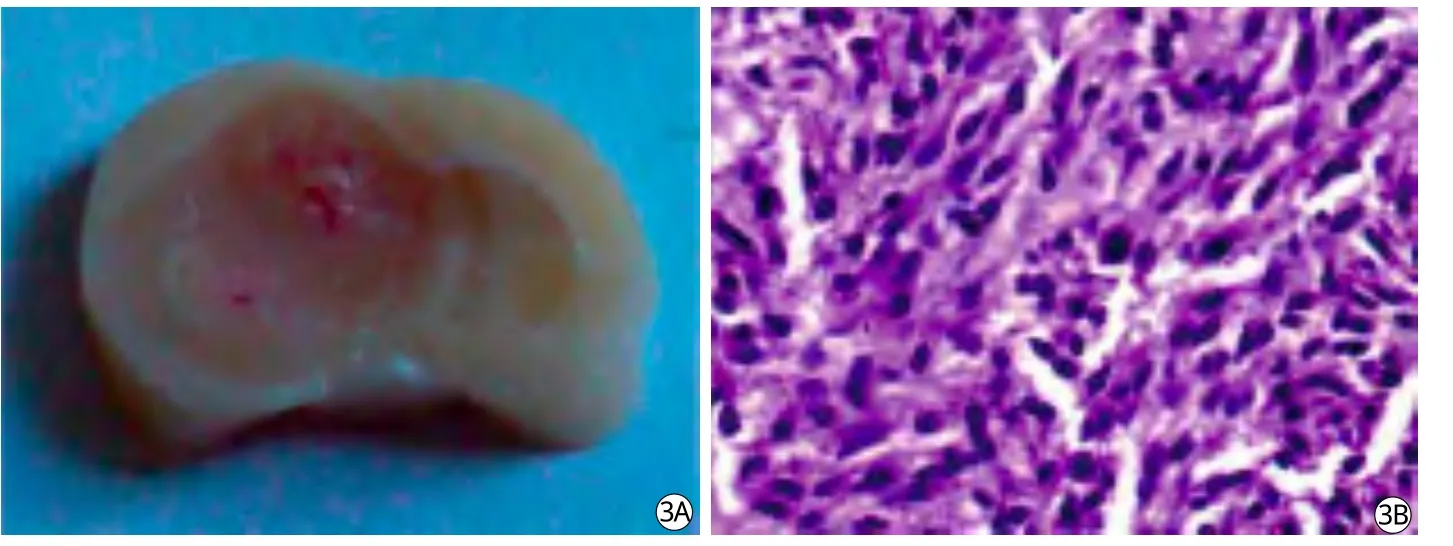
圖3 荷瘤模型病理學結果。A:肉眼所見病理切片橫斷面,病灶中心可見明顯出血及壞死;B:HE染色,可見多個大的深染的核異性細胞,腫瘤細胞聚集呈巢樣生長Fig.3 Pathology photos of a rat C6 glioma model.A: Globular brain-tumor can obviously be seen in naked eye with a central hemorrhage and necrosis.B: HE staining confi rms tumors specimen in all tested tissues.The tumor cells are spindle-shaped into density, with large and deep stained nuclear, which arranges into whirlpool nest in the tumor.
本實驗結果顯示Tau和Ins濃度在腫瘤周邊組織達到最低,Glx濃度在腫瘤周邊組織達到最高,且這三種物質的濃度在腫瘤周邊與其他各組之間均有統計學差異性,筆者認為這三種物質濃度的改變在判別腫瘤的潛在邊界具有相對特異性。Tau是一種氨基磺酸,在3.3 ppm處能夠被探測到其共振峰,發育中的小腦和小腦皮質層中這種物質的含量很豐富。Hekmatyar等[11]研究發現模擬人類腦成神經管細胞瘤的荷瘤鼠瘤灶內Tau 濃度顯著高于對照組正常鼠,其實驗結果表明Tau與腫瘤的侵襲性行為密切相關。Opstad等[12]研究發現患有成神經管細胞瘤的幼兒腦病灶內Tau濃度明顯升高,并證實Tau是一種可以鑒別不同種類腦腫瘤的特殊代謝物。這些發現奠定了Tau和其他某些代謝物一樣可被納入腫瘤侵襲性及分類標志的基礎。Ins是在氫質子波譜內可探測到的含量最豐富的代謝物之一。它是一種與細胞膜的更新和細胞磷脂層結構有關的物質[13],因此任何一種形式的細胞膜更新的加快或細胞膜磷脂層的破壞都可以導致Ins濃度的升高。體外實驗發現星形膠質細胞內有高濃度的Ins[14],并且還證實了它是同膠質細胞的激活相關聯。在腦膠質瘤內升高的Ins可以反映星形膠質細胞密度的增加,同時在一定程度上提示腫瘤細胞膜的更新和細胞增殖的加快,故也是一種潛在的MRS診斷標記物。近些年來,研究者對Glx的研究逐年增多,它起源于2.35 ppm和3.76 ppm處的譜峰,是由Glutamate和Glutamine組成。Glx濃度的變化被認為是一種反映腫瘤代謝旁 路變化的指標。至于為什么Tau、Ins、Glx在瘤周腦組織濃度有如此特殊的分布還有待于后期實驗的進一步研究。 Cho、Lip、Lac濃度在本實驗各組間無明顯規律可循,故本實驗結果無法對其作出有價值的分析。
3.3 實驗設計優勢與不足
本實驗最大優勢在于利用7.0 T超高場動物專用MR掃描儀采集相關實驗數據,它比臨床上常用的MR掃描儀器場強更高、勻場更均勻,配有兩路射頻通道、四路接收通道、多種體線圈和表面線圈。該掃描儀具有高達100 μm的空間分辨率和300 mT/rn的梯度磁場強度,組織分辨率高,高場強MR成像系統則提高了空間分辨率且縮短了成像時間,對研究組織器官微觀結構,以及其生化代謝過程等有十分重要的作用[15]。實驗不足之處是MRS數據采集時用到的STEAM序列,STEAM序列是最常用的單體素波譜采集序列,其與多體素波譜序列明顯不同之處是采集目標組織的空間涵蓋量,多體素波譜序列能在同一時間內多部位采集波譜數據,后期實驗若能使用多體素波譜序列將能進一步提高實驗準確性及效率。
綜上所述,本研究證實,在7.0 T高場MRI下,能夠獲得實驗小鼠腦膠質瘤的小ROI的有效的1H波譜。1H MRS技術是一種獲取腦膠質瘤不同部位代謝特征、判斷其潛在受侵范圍的重 要手段。同時,Tau、Ins和Glx可能對判斷腦膠質瘤潛在瘤體邊界提供重要的參考信息。
[References]
[1]Huang J, Chen K, Chen J, et al, The G-protein-coupled formylpeptide receptor FPR confers a more invasive phenotype on human glioblastoma cells.Br J Cancer, 2010, 102(6): 1052-1060.
[2]Wang W, Steward CE, Des-mond PM, et al, Diffusion tensor imaging in glioblastoma multiforme and brain metastases: the role of p, q,L, and fractional anisotropy.AJNR Am J Neuroradiol, 2009.30(1):203-208.
[3]Goebell E, Fiehler J, Ding XQ, et al.Disarrangement of fi ber tracts and decline of neuronal density correlate in glioma patients: a combined diffusion tensor imaging and1H-MR spectroscopy study.AJNR Am J Neuroradiol,2006, 27(7): 1426-1431.
[4]Yamasaki F, Kurisu K, Kajiwara Y, et al, Magnetic resonance spectroscopic detection of lactate is predictive of a poor prognosis in patients with diffuse intrinsic pontine glioma.Neuro Oncol, 2011, 13(7):791-801.
[5]Engelhorn T, Savaskan NE, Schwarz MA, et al, Cellular characterization of the peritumoral edema zone in malignant brain tumors.Cancer Science, 2009, 100(10): 1856-1862.
[6]Soares DP, Law M.Magnetic resonance spectroscopy of the brain:review of metabolites and clinical applications.Clinical Radiology,2009, 64(1): 12-21.
[7]McKnight TR, Noworolski SM, Vigneron DB, et al.An automated technique for the quantitative assessment of 3D-MRSI data from patients with glioma.J Magn Reson Imaging, 2001, 13(2): 167-177.
[8]Zheng XH, Chen W, Yang ZX, et al.Magnetic resonance spectroscopy study of patients with metabolic syndrome.Chin J Magn Reson Imaging, 2013.4(2): 87-92鄭曉紅, 陳薇, 楊忠現, 等.代謝綜合征患者的腦MR波譜研究.磁共振成像, 2013, 4(2): 87-92.
[9]Tate AR, Majós C, Moreno A, et al.Automated classifi cation of short echo time in in vivo1H brain tumor spectra: a multicenter study.Magn Reson Med, 2003, 49(1): 29-36.
[10]Ziegler A, von Kienlin M, Décorps M.High Glycolytic Activity in Rat Glioma Demonstrated in Vivo by Correlation Peak1H Magnetic Resonance Imaging.Cancer Res, 2001, 61(14): 5595-5600.
[11]H ekmatyar SK, Wilson M, Jerome N, et al.1H nuclear magnetic resonance spectroscopy characterisation of metabolic phenotypes in the medulloblastoma of the SMO transgenic mice.Br J Cancer, 2010,103(8): 1297-1304.
[12]Opstad KS, Bell BA, Griffi ths JR, et al.Taurine: a potential marker of apoptosis in gliomas.Br J Cancer, 2009,100(5): 789-794.
[13]Toker A, Cantley LC.Signalling through the lipid products of phosphoinositide-3-OH kinase.Nature, 1999, 387(6634): 673-376.
[14]Brand A, Richter-Landsberg C, Leibfritz D, et al.Multinuclear NMR studies on the energy metabolism of glial and neuronal cells.Dev Neurosci, 1993, 15(3-5): 289-298.
[15]Geng K, Jia YL, Huang DX, et al.Study of Gd-DTPA labeled bone marrow mesenchymal stem cells in vitro with 7.0 T MRI.Chin J Magn Reson Imaging, 2013.4(6): 431-436耿寬, 賈巖龍, 黃得校, 等.7.0 T MRI體外標記Gd-DTPA對骨髓間充質干細胞的實驗研究.磁共振成像, 2013, 4(6): 431-436.

